胡黄连苷Ⅱ对过氧化氢诱导急性肝细胞损伤中Ⅱ相代谢酶mRNA表达的影响*
2014-02-08李白雪冯全生张传涛范昕建
李白雪,冯全生△,张传涛,吴 疆,范昕建
(1.成都中医药大学,成都 610075;2.成都中医药大学附属医院,成都 610071)
氧化应激在肝细胞损伤的发生发展过程中发挥着重要作用,抗氧化治疗对防治肝脏疾病有着重要的意义。核因子相关因子2(Nrf2)是一种氧化应激基本表达的关键转录因子,通过与抗氧化反应元件(antioxidant responsive element,ARE)结合,调控下游Ⅱ相代谢酶基因的转录活性,包括醌氧化还原酶(NAD(P)H:quinone oxidoreductase 1,Nqo1)、谷胱甘肽-S-转移酶(glutathione-S-transferase,GST)以及谷氨酸-半胱氨酸连接酶(glutamate-cysteine ligase,Gcl),Gcl是谷胱甘肽(glutathione,GSH)合成的限速酶,其本身是由催化亚基(Gclc)和调节亚基(Gclm)2个亚单位构成,这一系列保护性蛋白能够保护机体免受活性物质(ROS)及一些毒性物质(致癌物、药物代谢活化产物)的侵害,同时在抗炎症[1]、抗应激[2]、抗凋亡[3]以及神经保护[4]等方面具有广泛的细胞保护功能。Nrf2-ARE也是迄今为止发现的最为重要的抵抗各种外环境应激和内源性应激的通路。
胡黄连是传统中药,来源于玄参科植物黄连或西藏胡黄连的根茎,具有清湿热、除骨蒸、消疳热、利肝胆的作用,用于湿热泻痢、黄疸、痔疾、骨蒸潮热、小儿疳热等[5]。现代中药药理表明,西藏胡黄连的主要含有环烯醚萜苷类、葫芦素类、酚甙类三大类成分及少量的芳香酸和D-甘露醇,其中胡黄连环烯醚萜苷主要活性成分为胡黄连苷Ⅰ~Ⅲ(PicrosideⅠ~Ⅲ),具有明显保肝作用。我们前期研究也发现,胡黄连苷Ⅱ具有明显的保肝作用,且与其抗氧化作用有关[6]。本实验拟通过胡黄连苷Ⅱ作用于人肝细胞细胞株(L-02),检测肝细胞内抗氧化通路Nrf2-ARE及下游Ⅱ相解毒酶和抗氧化酶mRNA的变化,观察胡黄连苷Ⅱ的保肝作用机制。
1 材料与方法
1.1 试剂与仪器
DMEM培养基(Gibco,Grand Island,NY,美国),小牛血清(兰州民海生物有限公司),噻唑蓝(MTT,sigma公司,美国),丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)试剂盒(南京建成生物工程研究所),RNA提取试剂盒( RNAiso plus,大连TaKaRa公司),SYBR染料法实时荧光定量试剂盒(SYBR Premix Ex TaqTMⅡ,大连TaKaRa公司),逆转录试剂盒(EasyScript First-Strand cDNA Synthesis SuperMix,北京全式金生物技术有限公司),Nrf2、Gclc、Gclm、Nqo1、GST和GAPDH引物(上海生工生物工程技术服务有限公司)。倒置显微镜(CKX-31 Olympus,日本),酶标仪(Bio-rad 550,美国),PCR仪(Bio-rad iCycler,美国),荧光定量 PCR仪(Bio-rad IQ5,美国)。
1.2 细胞培养
人肝细胞系L-02细胞株由四川大学华西医院生物治疗国家重点实验室保种、传代,细胞接种于含10%胎牛血清的DMEM培养液中,置于37℃、5%CO2、95%湿度的培养箱。
1.3 药物制备
胡黄连苷Ⅱ标准品 (picroside Ⅱ,批号111596-200402)购于中国药品生物制品检定所;胡黄连苷Ⅱ用无血清培养液(DMEM)溶解,配制成5 mmol/L浓度的含药培养液。
1.4 分组、造模及药物处理[7]
将成对数成长期的L-02细胞接种于96孔板内,接种密度为1×104个/孔,在37℃、5%CO2条件下培养过夜后,依据前期研究分别选用胡黄连苷Ⅱ(0、0.5、5 mmol/L)预处理3 h后[6]同时设对照组,除对照组外各组加入0.6 mmol/LH2O2作用1 h造成氧化损伤模型处理,继续培养细胞24 h后进行相关检测。
1.5 主要方法
1.5.1 MTT检测细胞活力 细胞处理好之后,吸去含有药物的培养液,每孔加入100 μL含1 mg/mlMTT的细胞培养液,继续培养4 h进行显色反应,然后吸去培养液,每孔加入200 μL的二甲基亚砜(DMSO),震荡混匀后,用BIO-RAD550型酶标仪测定570nm处的光密度值(OD),并依据OD值按公式计算细胞存活率:实验组OD值/对照组OD值×100%(各组OD值均已减去空白调零孔OD值)。
1.5.2 ALT和AST检测 收集各组细胞培养液,按ALT、AST测试盒(赖氏法)说明操作,以测定吸光度值,并查标准曲线得相应的AST/ALT单位。
1.5.3 qRT-PCR检测 通过RNAiso plus提取细胞总RNA,利用EasyScript试剂盒逆转录得到cDNA。逆转录反应条件为25℃10 min、42℃30 min、75℃5 min。荧光定量PCR引物为: Nrf2 sense:5’- ACAATGAGGTTTCTTCGGCTAC-3’,anti-sense:5’- CGTCTAAATCAACAGGGGCTAC-3’;Gclc sense:5’-ATGGAGGTGCAATTAACAGAC-3’,anti-sense:5’-CTGCATTGCCACCTTTGCA-3’;Gclm sense:5’-GCTGTATCAGTGGGCACAG-3’, Anti-sense:5’-CGCTTGAATGTCAGGAATGC-3’;Nqo1 sense:5’-GGTTTGAGCGAGTGTTCATAGG-3’,anti-sense:5’-GCAGAGAGTACATGGAGCCAC-3’;GSTa4 Sense:5’-GAGAACCCTGATTGACATGTA-3’,Anti-sense:5’-GCTGATTACCAACAAGAAAGC-3’;GAPDH sense:5’-TGAAGGTCGGAGTCAACGGA-3’,anti-sense:5’-CCTGGAAGATGGTGATGGGAT-3’;荧光定量PCR反应体系(10 μL)为2×TaqPCR Master Mix 5 μL,上下引物(10 μmol/L)各0.25 μL,cDNA1 μL,双蒸水补足至10 μL。反应条件为94℃5 min、94℃30 s、60℃30 s、72℃30 s,40个循环。以GAPDH为内参,通过Gene Expression Divisio Outline软件计算目的基因荧光实时定量PCR结果(Ct值)的相对表达量(以对照组相对表达量=1)。
1.6 统计学方法

2 结果
2.1 胡黄连苷Ⅱ对H2O2损伤L-02肝细胞MTT OD值的影响


表1 胡黄连苷Ⅱ对H2O2损伤L-02肝细胞MTT OD值的影响
注:与对照组比较:*P<0.05,**P<0.01;与模型组比较:#P<0.05,##P<0.01;与0.5 mMpicⅡ+H2O2组比较:△P<0.05,△△P<0.01;与5 mMpicⅡ+H2O2组比较:□P<0.05,□□P<0.01
2.2 胡黄连苷Ⅱ对H2O2诱导L-02肝细胞损伤ALT和AST酶活性的影响


表2 胡黄连苷Ⅱ对H2O2诱导L-02肝细胞损伤的ALT和AST活性影响
注:与对照组比较:*P<0.05,**P<0.01;与模型组比较:#P<0.05,##P<0.01;与0.5 mM picⅡ+0.6 mM H202组比较:△P<0.05,△△P<0.01; 与5 mMpicⅡ+H2O2组比较:□P<0.05,□□P<0.01
2.3 胡黄连苷Ⅱ干预对Nrf2及下游靶基因NQO1、Gclm、Gclc和GST mRNA表达水平的影响
图1、2显示,Real Time RT-PCR检测结果显示,胡黄连苷Ⅱ处理后,Nrf2及下游基因Gclc、Gclm、NQO1和GST表达显著变化,均较模型组均增高(P<0.05)。同时胡黄连苷Ⅱ 高浓度处理组Gclm、NQO1和GSTmRNA表达较对照组增高(P<0.05),并随浓度升高呈上升趋势,说明胡黄连苷Ⅱ对于Nrf2及下游抗氧化蛋白和Ⅱ相解毒酶mRNA水平有上调作用。本实验过程进行3次生物学重复,以GAPDH为内参,通过Gene Expression Divisio Outline软件计算目的基因荧光实时定量PCR结果(Ct值)的相对表达量(以对照组相对表达量=1)。
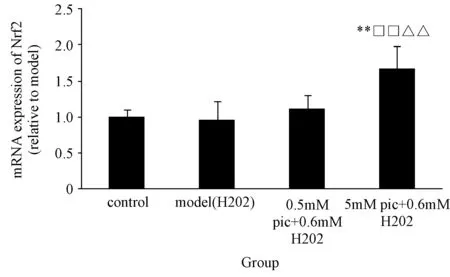
图1 胡黄连苷Ⅱ对H2O2诱导氧化损伤肝细胞(L-02)Nrf2 mRNA表达的影响注:与模型组比较:* P<0.05,** P<0.01;与对照组比较:△P<0.05,△△ P<0.01;与0.5 mM pic+0.6 mM H2O2比较:□P<0.05, □□P<0.01;与5 mM pic+0.6 mM H202比较:#P<0.05, ##P<0.01

图2 胡黄连苷Ⅱ对H2O2诱导氧化损伤肝细胞L-02的Gclc、Gclm、NQO1、GSTmRNA表达影响
图3 Nrf2、Gclc、Gclm、NQO1、GST基因溶解曲线图
3 讨论
在肝细胞损伤过程中,氧自由基引起的氧化损伤,再加上炎症反应起重要作用。氧化应激不仅是肝功能障碍的一部分,也是所有肝损伤的病理生理基础。本实验应用H2O2诱导肝细胞氧化损伤,H2O2可诱导L-02细胞发生氧化应激及细胞凋亡并可在细胞内产生(OH·),肝细胞在氧化应激作用下,细胞模型结构包括线粒体膜受到破坏,膜通透性增加,造成钙超载[8],肝细胞内ALT与AST释放增加。近年来研究发现,核因子 NF-E2 相关因子 ( nuclear fac-tor erythroid 2-related factor 2,Nrf2) 是 ARE 的激活因子。静息状态下,Nrf2与其胞浆抑制蛋白Kelch样ECH相关蛋白1(Kelch-likeECH-associatedp-rotein1,Keap1)相结合,被泛素蛋白酶体途径迅速降解,从而处于相对抑制状态,当受到亲电试剂或 ROS的刺激时,Nrf2从Keap1中解离,然后稳定状态的Nrf2转移入核,与ARE的启动子序列结合,调节抗氧化蛋白和Ⅱ相代谢酶的表达,增强肝细胞的解毒及抗氧化能力[9],对维持肝脏功能的稳定以及阻止肝脏疾病的发生有重要的作用。Nrf2调控的代表性下游基因NQO1、GST和Gclc等,都是对抗应激反应和抗氧化损伤的重要组成部分[10]。
实验表明,H2O2损伤导致肝细胞氧化损伤,肝细胞膜及线粒体膜破坏,通透性增高,以致细胞存活率下降,同时培养上清液中ALT、AST水平明显升高,而经胡黄连苷Ⅱ预处理各组细胞存活率增高,ALT、AST水平也较模型组明显降低,提示肝细胞损伤程度较模型组轻,同时Nrf2及其下游Gclc、Gclm、NQO1和GST基因的mRNA表达较模型组升高,并随药物浓度升高呈上升趋势,提示细胞抗氧化能力增强,而Nrf2模型组与对照组差异较小,考虑存在仅为Nrf2核转位增加,而细胞内总Nrf2含量不变,需检测Nrf2胞浆胞核分布情况进一步阐明机制。通过激活Nrf2/ARE通路抵抗H2O2所致的L-02肝细胞氧化损伤,可能是胡黄连苷Ⅱ发挥抗氧化保肝作用的重要机制之一,同时为临床该药物的合理应用提供了实验依据。
[1] Haworth O,Bucklcy CD,Resolving the problem of persistence in the switch from acute to chronic inflammation[J].Proc Natl Acad Sci USA,2007,104:20647-20648.
[2] 李梅,金晶,等.五味子乙素激活Nrf2/ARE通路对顺铂致HK-2细胞氧化应激损伤的保护作用[J].药学学报,2012,7(11):1434-1439.
[3] Hirota A,Kawachi Y,Itoh K,et al.Ultraviolet a irradiation induces NF-E2-related factor 2 activation in dermal fibroblasts:protective role in UVA-induced apoptosis[J].J Invest Dermatol, 2005,124(4):825-832.
[4] 郭明川,曹艳,刘建文.胡黄连苷Ⅱ在谷氨酸诱导的PC12细胞损伤中的保护作用[J].中国临床药理学与治疗学,2007,12(4):440-443.
[5] 江苏新医学院中药大辞典编写组.中药大辞典(下册)[M].上海:上海科学技术出版社,1996:1548-1550.
[6] 顾伟,范昕建,吴疆,等.胡黄连苷Ⅱ对H2O2损伤L-02细胞的保护作用[J].世界华人消化杂志,2008,16(29):3274-3278.
[7] 顾伟,范昕建. 体外肝细胞损伤模型构造[J], 西部医学,2008, 20(3):474-475,479.
[8] 卢绮萍,田磊,吴在德.H2O2诱导人类肝细胞、内皮细胞凋亡时Ca2+流变化的对比研究[J].中华实验外科杂志,1999,16(3):147-148.
[9] Jutta L,Silke M,J·rgen B.Nuclear factor-eythroid 2-related factor 2 prevents alcohol-induced fulminant liver injury[J].Gastroenterology,2008,134(4):1159-1168.
[10] Min KJ,Kim JH,Jou I,et al.Adenosine induces hemeoxy genase-1 expression in microglia through the activation of phosphatidylinositol 3-kinase and nuclear factor E2-related factor2[J].Glia,2008,56:1028-1037.
