奥美拉唑激活乙醛脱氢酶2的抗神经元凋亡作用研究
2014-02-08邹浩军林莉莉
邹浩军,林莉莉,孙 达
心脑血管缺血性疾病是临床常见疾病,具有发病率高、病死率高、致残率高等特点[1-3],严重损害人类健康。因此,寻找有效的防治措施至关重要,如改变生活习惯、降压降脂、抗动脉粥样硬化以及相关的基因、蛋白调控,均能有效防治缺血性心脑血管疾病[4]。2008年斯坦福大学Mochly-Rosen D所领导的课题组首次发现乙醛脱氢酶2(ALDH2)对缺血心脏的保护作用,明确显示激活ALDH2能显著抑制心肌梗死面积[5],后期又有研究显示ALDH2与缺血性脑卒中关系密切[6]。目前已知的ALDH2激动剂为化合物Adal1,故寻找能提高ALDH2活性的药物有重要意义。本课题组在研究中偶然发现质子泵抑制剂奥美拉唑(OME)能增加ALDH2活性,其是否能通过提高ALDH2活性而保护神经元呢?本研究利用原代神经元缺氧缺糖(OGD)模型,探讨OME对原代神经元凋亡的影响及可能作用机制。
1 材料与方法
1.1 动物及试剂 清洁级SD孕鼠,购自上海斯莱克动物实验中心,动物合格证号:SCXK(沪)2007-0005;注射用OME(配溶媒),购自阿斯利康公司;Adal1和Cya均购自Sigma公司;Neurobasal培养基、改良Eagle培养基、胎牛血清均购自GIBCO公司;活细胞计数(cell counting kit-8,CCK-8)试剂盒购自日本株式会社同仁化学研究所;Hoechst 33342荧光染色试剂盒和TUNEL试剂盒购自碧云天生物技术研究所。
1.2 方法
1.2.1 原代皮质神经元的培养及鉴定 取妊娠15~16 d孕鼠1只,颈椎脱臼处死,75%乙醇消毒腹部,打开腹腔,取出胎鼠。解剖显微镜下分离并剪碎脑组织,用0.25%胰蛋白酶37 ℃水浴消化10 min,磷酸盐缓冲液(PBS)终止消化反应。离心后彻底洗净胰酶,加入接种培养基,200目不锈钢滤器过滤,以2.5×105/cm密度种板。24 h后更换Neurobasal生长培养基,第5天全量换液,于第7天半量换液后用于实验。用神经元特异性烯醇化酶抗体进行免疫细胞化学染色,计数阳性神经元达95%以上,符合实验要求。
1.2.2 实验分组 神经元增殖和凋亡实验:将培养的神经元用Rand A 1.0软件完全随机分为正常对照组(Control组)、模型组(OGD组)和OGD+OME组(分别加入3、10、30、100、300 μg/ml的OME)。ALDH2激动剂Adal1和阻滞剂Cya对OGD神经元凋亡的影响:将培养的细胞随机分为Control组、OGD组、OGD+Adal1组和OGD+Cya组。ALDH2活性测定:将培养的神经元随机分为Control组、OGD组和OGD+OME组(10 μg/ml的OME)。
1.2.3 OGD模型的建立 培养7 d的神经元更换正常培养基为无糖DMEM培养基,置于37 ℃、体积分数为94%氮气、5%二氧化碳(CO2)的缺氧箱中进行OGD处理12 h。然后用流式细胞仪检测细胞凋亡率在35%~50%即为造模成功。
1.2.4 CCK-8法检测神经元的增殖 取细胞密度为2×105/ml对数生长期细胞,每孔100 μl接种至96孔培养板中,Control组、OGD组及不同浓度OGD+OME组各6复孔。24 h后OGD+OME组分别加入终浓度为3、10、30、100、300 μg/ml的OME,OGD组加入等体积溶媒,并均进行OGD处理12 h。采用CCK-8试剂盒检测细胞增殖能力:每孔加入10 μl CCK-8检测液,置37 ℃、5%CO2培养箱孵育4 h后,使用酶标仪于450 nm 波长检测各孔吸光度值(A450),重复3次。以OD450表示细胞增殖能力,OD450=实验组A值/Control组A值×100%。以Control组为标准(即100%),其他组的OD450值与Control组的OD450值之比即为该组的相对存活率。
1.2.5 Hoechst 33342荧光染色及TUNEL法观察神经元凋亡 收集Control组、OGD组及不同浓度OGD+OME组处理过的细胞,PBS洗涤1次。加入Hoechst 33342(终浓度10 μg/ml),常温下孵育15 min,离心去上清液。然后按照试剂盒说明书进行操作,滴片后于荧光显微镜下观察神经元凋亡情况。实验重复3次。
1.2.6 Annexin V/PI双染流式细胞术检测神经元凋亡 将Control组、OGD组及不同浓度OGD+OME组、OGD+Adal1组、OGD+Cya组培养12 h的神经元用胰酶消化、吹打,细胞悬浮后用胎牛血清终止消化,PBS洗涤2次。收集细胞,取106/mm3重悬细胞,按Annexin V/PI染色试剂盒说明书操作后,用流式细胞仪检测、分析神经元凋亡率,实验重复3次。
1.2.7 ALDH2活性测定 收集Control组、OGD组和OGD+OME组(10 μg/ml的OME)神经元,按照操作说明书提取线粒体蛋白,用二辛可酸法测定蛋白浓度,并用PBS调整蛋白浓度一致。采用半自动生化分析仪测定ALDH2活性:方法为速率法,波长340 nm,温度37 ℃,读数时间60 s,延迟时间30 s,吸入量450 μl,反应方向为正方向,因数1 746。因为ALDH2活性测定受到很多因素影响,如温度、湿度等,而且每次测定时即使条件一致,仪器本身也会影响结果,故每次测定后将Control组ALDH2活性标准化为100%,其他组ALDH2活性再与Control组比较后再相对化,称为ALDH2相对活性。整个ALDH2活性测定需要重复3次。
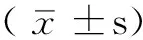
2 结果
2.1 OME对OGD神经元增殖的影响 与Control组比较,OGD处理12 h后原代神经元增殖能力(OD450值)下降,差异有统计学意义(P<0.05),相对存活率减少了61.42%;与OGD组比较,10、30 μg/ml OME均能促进神经元增殖,差异有统计学意义(P<0.05),相对存活率提高;但与OGD组比较,100 μg/ml的OME对神经元的增殖能力无影响,差异无统计学意义(P>0.05);而与OGD组比较,300 μg/ml的OME反而使细胞增殖能力降低,差异有统计学意义(P<0.05),相对存活率下降(见表1)。
2.2 OME对OGD神经元凋亡的影响 Hoechst 33342荧光染色后,在荧光显微镜下观察到正常神经元的细胞核染成暗蓝色,细胞核大小、形态正常;凋亡的神经元细胞核呈亮蓝色、大小不等,核固缩、碎裂甚至可见凋亡小体(如箭头所示)。TUNEL染色为绿色的即为凋亡细胞核(如箭头所示),与OGD组比较,10、30 μg/ml OME使凋亡细胞数目明显减少(见图1)。
神经元增殖实验中设置了OGD+300 μg/ml OME组,发现神经元增殖能力反而下降,可能是药物浓度太高导致细胞毒性反应,故神经元凋亡实验中不再设置OGD+300 μg/ml OME组。流式细胞术检测神经元凋亡率显示,与Control组比较,OGD处理12 h后神经元凋亡率升高,差异有统计学意义(P<0.05);而与OGD组比较,10、30 μg/ml的OME则可使神经元凋亡率降低,差异均有统计学意义(P<0.05);但与OGD组比较,100 μg/ml的OME对神经元凋亡率无影响,差异无统计学意义(P>0.05,见表2)。
2.3 ALDH2激动剂Adal1和阻滞剂Cya对OGD神经元凋亡的影响 与Control组比较,OGD处理12 h后,神经元凋亡率增加,差异有统计学意义(P<0.05);与OGD组比较,ALDH2激动剂Adal1能降低神经元凋亡率,而ALDH2阻滞剂Cya则能增加神经元凋亡率,差异均有统计学意义(P<0.05,见表3)。

表1 各组神经元增殖情况比较
注:OME=奥美拉唑;-表示无数据;与Control组比较,*P<0.01;与OGD组比较,△P<0.05,▲P<0.01

注:a/A为Control组,b/B为OGD组,c/C为OGD+OME 3 μg/ml组,d/D为OGD+OME 10 μg/ml组,e/E为OGD+OME 30 μg/ml组,f/F为OGD+OME 100 μg/ml组
图1 Hoechst 33342和TUNEL检测OME对神经元凋亡的影响
Figure1 The effects of OME on neuron apoptosis by Hoechst 33342 fluorescence staining and TUNEL

表2 各组神经元凋亡率比较
注:与Control组比较,*P<0.01;与OGD组比较,△P<0.01,▲P<0.05

表3 Adal1和Cya对神经元凋亡率的影响
注:与Control组比较,*P<0.01;与OGD组比较,△P<0.01;与OGD+Adal1组比较,▲P<0.01
2.4 OME对OGD神经元ALDH2活性的影响 与Control组比较,OGD组神经元ALDH2相对活性降低了74.01%,而10 μg/ml OME使OGD神经元ALDH2相对活性增加了130.00%(见图2)。

图2 各组神经元ALDH2相对活性比较
Figure2 Comparison of the activities of ALDH2 in neuron among different groups
3 讨论
脑缺血缺氧后,神经元细胞器结构受损,能量代谢障碍、细胞内钙超载、激发一系列级联反应导致神经元死亡[7-9]。已有研究发现,缺血性脑病早期,缺血中心神经元死亡以坏死为主;而其周围(缺血半暗带) 的神经元仍然具有代谢活性,最终的死亡以凋亡为主[10-12]。由于细胞凋亡是一个长期、慢性的过程,且具有可预防性和可逆的,故在缺血早期前用药抑制神经元的凋亡,可有效地保护半暗带神经元,阻止凋亡的发展,从而阻止疾病发展和恶化,使缺血性脑损伤得到有效的治疗。因而抑制神经元凋亡也是治疗缺血性脑卒中的一个重要策略。
OGD模型又称氧糖剥夺模型,自Goldberg等[13]成功建立了原代培养神经元OGD模型后,被广泛用于研究离体水平脑缺血损伤[14],这一模型不仅能够模拟整体水平脑缺血损伤,还是离体水平评价药物神经保护作用的有效手段。因此本研究也选择在该模型上进行深入探讨,结果显示原代神经元OGD处理后凋亡率增加,显微镜下见细胞大小不等,核固缩、碎裂,甚至可见凋亡小体。说明在低氧低糖的情况下,细胞凋亡增加,增殖能力下降,细胞的存活率下降。同时本研究还发现激动ALDH2,能对抗OGD导致的神经元凋亡,而阻断ALDH2,则使神经元凋亡更加明显,说明ALDH2活性与神经元凋亡有相关性。加入OME干预后,神经元凋亡减少,增殖能力和存活率增加,且ALDH2活性增高,这表明OME对OGD致神经元的损伤具有一定的保护作用,这与抗凋亡、增高ALDH2的活性相关。但在OME浓度过高(300 μg/ml)时,神经元增殖能力反而降低,这可能与药物浓度过高带来的细胞损害作用相关。
ALDH2是存在于线粒体的一种酶,主要功能是参与乙醇的代谢,使乙醇的毒性中间产物乙醛被氧化为无害的乙酸。近年来,许多研究表明ALDH2具有心脑血管保护作用,ALDH2改变与氧化损伤密切相关。有研究表明,激活ALDH2会降低缺血性损伤所致的心肌损害,其机制与ALDH2协同调节心肌腺苷酸活化蛋白激酶(AMPK)和丝氨酸/苏氨酸蛋白激酶(Akt)内源性保护信号有关[15-16];对于缺血性脑损伤,ALDH2与脑内蛋白激酶Cε(PKCε)直接相互结合,PKCε可以调节ALDH2的激活,从而发挥脑保护作用[6]。ALDH2过表达小鼠的心肌梗死及脑梗死面积较野生型小鼠显著减小;反之,ALDH2敲除小鼠的心肌梗死面积及脑梗死面积较野生型小鼠显著增加。因此,增强ALDH2活性可能为脑缺血的防治提供新的方向。
OME是全球公认的治疗消化性溃疡及反流性食管炎等酸相关性疾病的质子泵抑制剂,临床也利用其对胃黏膜保护作用而用于急性酒精中毒的治疗。本课题组前期实验偶然发现OME可以提高肝脏线粒体ALDH2活性,考虑OME对血-脑脊液屏障穿透性差,故选择在离体神经元上研究,发现OME亦能提高神经元线粒体内ALDH2活性,从而促进神经元增殖,抑制神经元凋亡。这也许会给OME的应用带来新的机遇,但还需要对此进一步探讨。
1 Jauch EC,Cucchiara B,Adeoye O,et al.Part 11:adult stroke:2010 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care[J].Circulation,2010,122(18 Suppl 3):S818-828.
2 Feigin VL,Lawes CMM,Bennett DA,et al.Worldwide stroke incidence and early case fatality reported in 56 population-based studies:a systematic review[J].Lancet Neurol,2009,8(4):355-369.
3 World Health Organization.World Health Statistics 2008[R].Geneva:World Health Organization,2008.
4 Strong K,Mathers C,Bonita R.Preventing stroke:saving lives around the world[J].Lancet Neurol,2007,6(2):182-187.
5 Chen CH,Budas GR,Churchill EN,et al.Activation of aldehyde dehydrogenase-2 reduces ischemic damage to the heart[J].Science,2008,321(5895):1493-1495.
6 Guo JM,Liu AJ,Zang P,et al.ALDH2 protects against stroke by clearing 4-HNE[J].Cell Res,2013,23(7):915-930.
7 Mdzinarishvili A,Sumbria R,Lang D,et al.Ginkgo extract EGb761 confers neuroprotection by reduction of glutamate release in ischemic brain[J].J Pharm Pharm Sci,2012,15(1):94-102.
8 Yang M,Wang S,Hao F,et al.NMR analysis of the rat neurochemical changes induced by middle cerebral artery occlusion[J].Talanta,2012,88:136-144.
9 Sutherland BA,Minnerup J,Balami JS,et al.Neuroprotection for ischaemic stroke:translation from the bench to the bedside[J].Int J Stroke,2012,7(5):407-418.
10 Nakajima W,Ishida A,Lange MS,et al.Apoptosis has a prolonged role in the neurodegeneration after hypoxic ischemia in the newborn rat[J].J Neurosci,2000,20(21):7994-8004.
11 Mansouri B,Henne WM,Oomman SK,et al.Involvement of calpain in AMPA-induced toxicity to rat cerebellar Purkinje neurons[J].Eur J Pharmacol,2007,557(2/3):106-114.
12 Ekshyyan O,Aw TY.Apoptosis:a key in neurodegenerative disorders[J].Curr Neurovasc Res,2004,1(4):355-371.
13 Goldberg MP,Strasser U,Dugan LL.Techniques for assessing neuroprotective drugs in vitro[J].Int Rev Neurobiol,1997,40:69-93.
14 Goldberg MP,Choi DW.Combined oxygen and glucose deprivation in cortical cell culture:calcium-dependent and calcium-independent mechanisms of neuronal injury[J].J Neurosci,1993,13(8):3510-3524.
15 Ma H,Li J,Gao F,et al.Aldehyde dehydrogenase 2 ameliorates acute cardiac toxicity of ethanol:role of protein phosphatase and forkhead transcription factor[J].J Am Coll Cardiol,2009,54(23):2187-2196.
16 Ma H,Yu L,Byra EA,et al.Aldehyde dehydrogenase 2 knockout accentuates ethanol-induced cardiac depression:role of protein phosphatases[J].J Mol Cell Cardiol,2010,49(2):322-329.
本文链接:
乙醛脱氢酶(acetaldehyde dehydrogenase)(EC1.2.1.10)(CAS[9028-91-5])是醛脱氢酶的一种,负责催化乙醛氧化为乙酸的反应。肝中的乙醇脱氢酶负责将乙醇氧化为乙醛,生成的乙醛作为底物进一步在乙醛脱氢酶催化下转变为无害的乙酸(醋的成分)。乙醛毒性高于乙醇,是造成宿醉的主要原因之一。而且乙醛被怀疑具有致癌性,与人类肿瘤的发生存在一定的关系。负责人体内乙醛转化的主要是肝中的乙醛脱氢酶,乙醛脱氢酶1与乙醛脱氢酶2在催化速率上有很明显的差异。
