原发性高血压病患者脑小血管病与尿微量清蛋白的关系研究
2014-02-08蒋广恩沈秀张甘利萍周乃珍
蒋广恩,沈秀张,甘利萍,周乃珍
脑小血管病(SVD)是指颅内小动脉和微动脉病变引起脑的缺血或出血性损害,影像学上主要表现为脑白质疏松(WML)和腔隙性脑梗死(LI),临床上早期可无任何症状,随损害进展,与认知功能下降、缺血性卒中等密切相关。高血压患者尿微量清蛋白(microalbuminuria,MAU)的出现不仅是早期肾损害指标,也是亚临床靶器官损害的早期预测指标[1]。国外研究报道MAU不仅与老年人的SVD密切相关,而且是脑血管疾病独立的危险预测因子[2]。而有关高血压患者SVD与早期肾损害指标MAU之间关系的报道较少,本研究通过对100例尿常规蛋白阴性且无神经症状的原发性高血压病患者的临床资料进行回顾性分析,探讨SVD和MAU之间的关系,进而为临床干预提供依据。
1 资料与方法
1.1 临床资料 按2004年《中国高血压防治指南》(实用本)公布的高血压诊断标准,选择厦门大学附属中山医院2008年1月—2012年12月住院及门诊诊断为原发性高血压病的患者100例为研究对象,临床上无神经症状,且尿常规检查蛋白阴性,并经心脏超声、颈动脉超声、磁共振血管造影(MRA)检查排除潜在心源性栓塞、大动脉粥样硬化性脑梗死、穿支动脉病、任意大小的皮质梗死或皮质下梗死直径>15 mm及脑出血,并排除糖尿病、继发性高血压、原发性肾脏疾病、恶性肿瘤、血管性认知功能障碍和/或痴呆患者。其中男58例,女42例;年龄45~73岁,平均(59.0±8.4)岁。根据磁共振成像(MRI)表现定义为:WML为脑室周围或半卵圆中心区脑白质斑点样或斑片样改变,MRI T1加权像显示等或低信号,T2加权像和液体衰减反转恢复(FLAIR)像为高信号;LI为皮质下直径在3~15 mm边界清楚的缺血性病灶。将颅脑MRI未见异常的归为SVD阴性组55例;存在WML和/或LI影像学表现归为SVD阳性组45例。入院诊断单纯收缩期高血压患者12例,SVD阳性组10例,SVD阴性组2例;1级高血压患者36例,SVD阳性组2例,SVD阴性组34例;2级高血压患者44例,SVD阳性组28例,SVD阴性组16例;3级高血压患者8例,SVD阳性组5例,SVD阴性组3例。
1.2 研究方法 分别对入选的100例患者进行回顾性调查,详细记录患者的临床资料,包括:性别、年龄、身高、体质量、体质指数、诊室血压、空腹血糖、总胆固醇、三酰甘油、肌酐、MAU水平。其中MAU为采集患者清晨第一次尿5 ml,使用德灵原装试剂在德灵BN2特定蛋白分析仪上应用颗粒散射比浊法测定,参考值:0~30 mg/L。
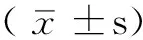
2 结果
2.1 原发性高血压病患者SVD影响因素单因素分析 SVD阴性组与SVD阳性组患者性别、体质指数、舒张压、空腹血糖、总胆固醇、三酰甘油、肌酐水平比较,差异均无统计学意义(P>0.05);而年龄、收缩压、脉压、MAU比较,差异均有统计学意义(P<0.05,见表1)。
2.2 原发性高血压病患者SVD影响因素多因素Logistic回归分析 以原发性高血压病患者有无SVD为因变量,将单因素分析差异有统计学意义的因素为自变量(见表2),多因素Logistic回归分析结果显示,年龄、收缩压、MAU与原发性高血压病患者SVD有回归关系(P<0.05,见表3)。
表1 原发性高血压病患者SVD影响因素单因素分析
Table1 Univariate Logistic regression analysis on influencing factors for SVD among essential hypertension patients

组别SVD阴性组(n=55)SVD阳性组(n=45)检验统计量值P值男/女30/2528/170.599*0.439年龄(x±s,岁)53.4±5.865.7±5.710.650 0.000体质指数(x±s,kg/m2)24.31±1.0224.21±1.130.465 0.643收缩压(x±s,mmHg)152±6167±612.370 0.000舒张压(x±s,mmHg)98±696±101.102 0.273脉压(x±s,mmHg)54±970±137.430 0.000空腹血糖(x±s,mmol/L)4.84±0.634.91±0.520.597 0.552总胆固醇(x±s,mmol/L)4.76±0.384.85±0.461.072 0.287三酰甘油(x±s,mmol/L)1.46±0.421.53±0.540.729 0.468肌酐(x±s,μmol/L)71±1976±191.162 0.248MAU〔M(QR),mg/L〕24(12)108(74)-7.086△0.000
注:MAU=尿微量清蛋白;*为χ2值,△为U值,余检验统计量值为t值
表2 原发性高血压病患者SVD影响因素赋值
Table2 Assignment of SVD influencing factors among essential hypertension patients

变量赋值年龄(岁)<60=0,≥60=1收缩压(mmHg)<160=0,≥160=1脉压(mmHg)≤40=0,>40=1MAU(mg/L)<30=0,≥30=1SVD阴性=0,阳性=1
注:SVD=脑小血管病
表3 原发性高血压病患者SVD影响因素多因素Logistic回归分析
Table3 Multivariate Logistic regression analysis on influencing factors for SVD among essential hypertension patients

变量回归系数标准误Waldχ2值P值OR值95%CI年龄0.1500.0724.3370.0371.162(1.009,1.339)收缩压0.2530.0966.8840.0091.288(1.066,1.556)脉压0.0150.0650.0510.8211.015(0.893,1.154)MAU1.7470.8434.2950.0385.738(1.099,29.951)
3 讨论
3.1 SVD与年龄、血压的关系 临床流行病学证实年龄、高血压是SVD的重要危险因素。本研究结果显示,单因素分析中,SVD阳性组与SVD阴性组相比,年龄、收缩压、脉压明显增高,而多因素回归分析中年龄、收缩压是高血压患者SVD的独立危险因素,而脉压相关性不大。分析这与血压随着年龄增长呈现不同的变化特点有关;弗莱明翰心脏研究报道收缩压随年龄的增长呈线性增加,早期舒张压也增加,到50~60岁以后,舒张压呈下降趋势[3]。增龄可致脑白质总体积减少、神经纤维脱髓鞘改变,而其所致小动脉硬化的发生率随血压的增高而增加。SVD的病理基础是小动脉硬化的透明样变[4];长期高血压可引起颅内小动脉和深穿支动脉壁增厚和透明样变性,其中长穿支动脉分布区血流障碍所致的为WML,而短穿支小动脉闭塞则引起深部灰质核团的LI,这两个区域几乎没有侧支循环的终末动脉供血,所以对缺血更为敏感[5];提示了高血压性小动脉硬化与由之引起的缺血在SVD发病机制中起着非常重要的作用。
3.2 SVD与MAU的关系 越来越多的证据表明MAU是高血压/糖尿病患者和普通人群心血管和肾脏疾病发病和死亡的独立高危因素[6-7]。国外研究报道糖尿病患者MAU的出现是SVD的独立危险因素[8]。Meta分析表明,卒中的风险随着尿清蛋白排泄率增加而相应地增加[9];校正已知的心血管危险因子,发现有MAU的患者卒中风险更高[10]。本研究中,单因素分析SVD阳性组与SVD阴性组相比,MAU明显增高,多因素分析也提示了MAU是SVD的独立危险因素。分析这与肾和脑的血管床具有相似的血流动力学特征,具有高灌注、低阻抗的特点有关。高血压作为肾和脑的小血管病共有的危险因素,最易累及决定血流阻力和自动调节功能的肌性小动脉和微动脉,可导致肾、脑血流的自动调节机制改变及血管内皮细胞损伤[11],随病情进展可出现MAU、侧脑室周围和半卵圆中心白质病变、基底核和丘脑多发性小梗死。高血压患者MAU的出现不仅反映肾小球内皮功能受损,也是全身血管内皮损伤的一个重要标志,预示着动脉粥样硬化性心血管疾病的病理生理过程已经启动。国内研究表明高血压伴MAU患者血小板活性增高及存在凝血纤溶指标的异常[12-13],与高血压病情进展、血栓性并发症的发生及远期预后密切相关。国外研究表明缺血性脑白质病变是亚临床期动脉粥样硬化的标志[14],与LI有共同的血管定位[15],随病情进展可在原有微血管病变基础上转变为真正的梗死[16]。本研究结果也进一步说明了肾小血管疾病可以成为SVD存在的一个指征。
本研究初步探讨了尿常规蛋白阴性且无神经症状的原发性高血压病患者SVD与MAU之间的关系,结果显示年龄、收缩压、MAU是SVD的独立危险因素。由于MRI能发现脑部很小的梗死灶,临床上常用于研究脑血管病及其对脑功能的损害,但价格昂贵;而高血压患者进行MAU筛查具有操作简便、价格低廉、效价比高的优点。本研究结果表明了肾和SVD之间有一定的关系,认识到肾和脑两脏器血管病变有相互影响,对于早期发现脑部损害有重要意义;但本研究为非前瞻性分析,且样本量较小,因此二者的关系有待进一步大样本前瞻性研究以明确。随着增龄,临床上应加强对高血压患者MAU的筛查,有效控制血压,早期干预MAU,可能对预防SVD的发生及进展具有重要意义。
1 吕留强,赵立,李晓波,等.厄贝沙坦/氢氯噻嗪对原发性高血压伴早期肾损害尿微量白蛋白和N-乙酰-β-D-氨基葡萄糖苷酶的影响[J].实用心脑肺血管病杂志,2012,20(1):34.
2 Wada M,Nagasawa H,Kurtia K,et al.Microalbuminuria is a risk factor for cerebral small vessel disease in community-based elderly subjects[J].Neurological Sciences,2007,255(1/2):27-34.
3 Franklin SS,Gustin W 4th,Wong ND,et al.Hemodynamic patterns of age-related changes in blood pressure.The Framingham Heart Study[J].Circulation,1997,96(1):308-315.
4 李强,孙继洲.肾小球滤过率与脑小血管病[J].国际神经病学神经外科学杂志,2008,35(4):315-318.
5 张东平,张波,胡长林.脑小血管病及其亚型与颈动脉粥样硬化的相关性[J].中国动脉硬化杂志,2008,16(6):487-491.
6 曹晓霞.氨氯地平和坎地沙坦联用对原发性高血压尿微量清蛋白的影响[J].实用心脑肺血管病杂志,2012,20(4):594.
7 莫小丽,安巍,万国华.2型糖尿病患者动态血压与尿微量清蛋白的关系研究[J].中国全科医学,2012,15(6):2020.
8 Anan F,Masaki T,Iwao T,et al.The role of microalbuminuria and insulin resistance as significant risk factors for white matter lesions in Japanese type 2 diabetic patients[J].Current Medical Research and Opinion,2008,24(6):1561-1567.
9 Lee M,Saver JL,Chang KH,et al.Level of albuminuria and risk of stroke:systematic review and meta-analysis[J].Cerebrovasc Dis,2010,30(5):464-469.
10 Lee M,Saver JL,Chang KH,et al.Impact of microalbuminuria on incident stroke:a meta-analysis[J].Stroke,2010,41(11):2625-2631.
11 赵洁,张小培,钟爱群,等.健康行为对原发性高血压患者脑卒中发病影响的病例对照研究[J].中国全科医学,2012,15(12):3963.
12 蒋广恩,黄子扬,陈治卿.高血压患者微量白蛋白尿与血小板活化关系[J].中华高血压杂志,2006,14(10):793-796.
13 蒋广恩,周乃珍,陈治卿.高血压患者微量白蛋白尿与凝血纤溶指标的关系[J].临床心血管病杂志,2012,28(8):587-589.
14 De Leeuw FE,De Groot JC,Oudkerk M,et al.Aortic atherosclerosis at middle age predicts cerebral white matter lesions in the elderly[J].Stroke,2000,31(2):425-429.
15 高徽,腾伟禹.缺血性脑白质病变的研究进展[J].国际脑血管病杂志,2008,16(5):353-359.
16 Schmidt R,Enzinger C,Ropele S,et al.Progression of cerebral white matter lesions:6-year results of the Austrian Stroke Prevention Study[J].Lancet,2003,361(9374):2046-2048.
