γ-干扰素受体在雌性山羊星状神经节的表达①
2014-02-06王志豪金秀芳徐永平陈文东西北农林科技大学杨凌712100
李 强 王志豪 金秀芳 徐永平 郭 晓 陈文东 董 伟 (西北农林科技大学,杨凌 712100)
γ-干扰素受体在雌性山羊星状神经节的表达①
李 强 王志豪 金秀芳 徐永平 郭 晓 陈文东 董 伟 (西北农林科技大学,杨凌 712100)
目的:为了解雌性山羊星状神经节是否具备接受γ-干扰素(Interferon-γ,IFN-γ)作用的条件,即是否有IFN-γ受体(Interferon-γreceptor,IFNGR)存在。方法:取雌性山羊星状神经节,用免疫组化SP法和PCR方法检测IFNGR在星状神经节的表达情况。结果:结果显示,在雌性山羊星状的神经元、支持细胞和神经纤维均有IFNGR免疫阳性产物分布,但主要分布于神经元细胞膜与细胞核,IFNGR在神经元胞体的相对表达量极显著高于非神经细胞结构(P<0.01)。在山羊星状神经节扩增到IFNGR1基因的cDNA片段全长376 bp,山羊IFNGR1基因与绵羊基因同源性最高(98%),其次为牛(97%)。结论:在雌性山羊星状神经节中IFNGR主要在交感节后神经元表达与分布,具备对IFN-γ刺激做出反应的条件,提示雌性山羊星状神经节可能作为IFN-γ对心血管免疫调节途径和自主神经对心血管调节的神经途径之间相互协调的关键点。
γ-干扰素受体;星状神经节;免疫组织化学SP法;PCR;山羊
IFN-γ是一种糖蛋白,主要是由抗原、有丝分裂素等刺激、活化的CD4+Th1、CD8+T细胞及NK细胞所分泌。抗原、T细胞促分裂素(PHA、ConA)、细胞因子 (IL-2、IL-12、IL-18、bFGF、PDGF、EGF)、葡萄球菌肠毒素B均会诱导IFN-γ的合成。其他细胞类型如神经元[1]、巨噬细胞、树突细胞(DC)和 γ/δT细胞在特定的条件下也能够表达IFN-γ。IFN-γ具有广泛的抗病毒、抗肿瘤和免疫调节作用。近年来研究发现,IFN-γ在免疫系统、神经系统和内分泌系统均有分布[2]。IFN-γ的生物活性依赖于靶细胞膜上的受体而发挥。IFNGR为IFNGR1和IFNGR2组成的二聚体[3-5]。IFN-γ 与受体结合可 以激活JAK1、JAK2和STAT1,进而诱导在启动子区域包含γ-激活序列(GAS)的基因的表达[5-7]。Eid 等研究发现,IFN-γ对血管平滑肌细胞的炎症反应起促进作用[8]。研究还发现IFN-γ不仅能抑制平滑肌细胞增殖,还可通过激活细胞表面的 Fas配体从而诱导平滑肌细胞的凋亡[9]。IFN-γ能通过激活单核细胞,降解胶原蛋白和弹力蛋白,使得动脉粥样硬化斑块不稳定而破裂,起到缓解脉粥样硬化的作用[10]。上述研究提示IFN-γ可以作用于心血管系统而发挥免疫调节作用。
星状神经节(又称颈胸神经节)由颈下交感节(颈后神经节)和第一胸交感节融合而成,支配很多组织器官如心脏、血管、汗腺等,其中发出心神经是支配心脏的交感节后神经纤维主要来源之一[11-13]。研究发现,单侧星状神经节阻滞后左心室收缩和舒张功能均减弱,并且刺激单侧星状神经节时,左心室的收缩功能和舒张功能也发生变化[14,15]。综上所述,IFN-γ可以直接作用于心血管而发挥调节作用。星状神经节也可对心血管起自主神经调节作用。那么支配心血管自主神经纤维主要来源的星状神经节对心血管的调节与IFN-γ对心血管的调节之间是如何协调的呢?本试验采用免疫组织化学SP法和分子生物学方法检测IFNGR在星状神经节上的表达及分布情况,旨在证明星状神经节上是否具备接受IFN-γ作用的条件,为进一步探讨IFN-γ与星状神经节对心血管的调节之间的关系提供形态学依据。
1 材料与方法
1.1 形态学检测
1.1.1 试验材料 实验动物:成年健康的空怀雌性关中奶山羊5只。
1.1.2 石蜡切片的制备及其染色 将成年健康的空怀雌性山羊保定、麻醉,动脉放血处死后,迅速取出星状神经节,星状神经节经40 g/L的多聚甲醛磷酸盐缓冲液中固定4 h后,用自来水冲洗10 h,经脱水、透明、石蜡包埋后,做6μm厚的切片。切片分4套,其中一套用于HE染色,用作组织定位对照;第二套切片脱蜡、复水,经抗原热修复之后,进行免疫组化SP法染色。按照免疫组化SP超敏试剂盒(迈新,福州)说明书程序操作,A、B、C、D 液依次分别15、15、20、20 min,在 B 液之后加 1∶200 稀释(稀释液,北京鼎国昌盛)的兔抗IFNGR多克隆抗体(博士德,武汉),4℃过夜,复温后依次加C液、D液之后,DAB(华美生物,武汉)显色,以上每步之后经PBS充分洗涤。常规脱水、透明、中性树脂封片。第三套SP法染色后用苏木精复染,用于IFNGR阳性细胞分布特点观察。第四套做阴性对照,用PBS替代兔抗IFNGR抗体做空白对照,其余步骤与第三套相似。Motic生物显微镜下观察,拍照,并记录结果。
1.1.3 图像分析 光学显微镜下观察并记录切片,Motic数码显微镜下拍照,测量数据。每只山羊分别选取连续5张切片,每张片子随机选取5个视野,用高清晰图像分析系统(江苏捷达)进行分析,计算出每种细胞的相对表达量(相对表达量=光镜倍数×阳性面积×平均光密度/像素)。将图像相对表达量数据用SPSS18.0软件分析,表达量的平均值用x-±s表示,用单因子方差分析(One-way ANOVA,LSD)进行显著性检验,差异显著P<0.05,差异极显著P<0.01。
1.2 IFNGR1 mRNA在星状神经节的PCR检测
1.2.1 实验材料 成年健康的空怀雌性关中奶山羊5只,经放血致死后,迅速准确地取出星状前神经节,放入液氮冻存以备用。
1.2.2 总RNA的提取 将星状神经节放研磨成粉末后,使用总RNA提取试剂盒TRIzol试剂盒(TaKa-Ra大连)提取总RNA,并利用紫外分光光度法在260 nm和280 nm处测量并计算RNA浓度。
1.2.3 引物设计与反转录 使用Primer 5软件设计IFNGR1的引物(金斯瑞合成,南京),其序列:上游为 5'-CTGAGGACAATCCAGGAAAAGT-3'(共 22个核苷酸);下游为 5'-TCTTTACCACCTTCATCCACAA-3'(共22个核苷酸)。内参物β-actin引物序列:上游为(20个核苷酸)5'-ATGGTGGGTATGGGTCAGAA-3';下游为 5'-CGGAGCTCGTTGTAGAAGGT-3'(共20个核苷酸)。RNA反转录根据试剂盒(试剂盒,TaKaRa大连)说明书操作,反应条件:37℃15min,85℃ 5 s。反应总体系(20μl)包括:Oligo dT Primer(50 mmol/L)1 μl,5×PrimerScript Buffer 4 μl,Random 6 mers(100 mmol/L)1 μl,PrimerScript Enzyme MixⅠ1 μl,Total RNA 4 μl,RNase free water 9μl。反应结束后将所得的cDNA放置于-20℃备用保存。
1.2.4 PCR扩增目的基因 PCR扩增以β-actin作为内参,根据Ferment Mix试剂盒(Ferment USA)说明操作。PCR反应体系(总体积25μl)包括:cDNA 2 μl,Mix 12.5 μl,下游引物 1 μl,上游引物 1 μl,ddH2O 8.5μl。充分吹打混匀后,在PCR仪上进行扩增,扩增程序:94℃预变性(5 min);94℃变性(40 s),60℃退火(40 s),72℃延伸(1 min),共经过40个循环;72℃延伸(5 min)。将所得的扩增产物放置于-4℃备用保存或直接使用。
1.2.5 琼脂糖凝胶电泳鉴定PCR产物 将所得的PCR扩增产物使用琼脂糖凝胶电泳进行检测。使用紫外凝胶成像系统,观察凝胶上是否有白色DNA荧光目标条带,并将结果通过凝胶成像系统拍照以便保存。
1.2.6 IFNGR部分基因序列的测定及结果分析将扩增成功的扩增产物50μl送至物科技公司(金斯瑞,南京)进行DNA序列的双向测序,并将测定结果在NCBI上进行比较和确认,并与其他物种的序列进行了同源性比对。
2 结果
2.1 颈胸神经节HE和免疫组织化学SP法染色结果 光镜下,空白对照组(见图1Ⅱ)无着色,为阴性,试验组IFNGR免疫阳性产物均呈褐色颗粒,说明IFNGR的SP染色具有特异性反应。根据染色程度,可将IFNGR染色结果分为四个等级:①阴性:无着色;②弱阳性:染色弱,呈淡黄色;③中等阳性:中等染色,呈黄褐色;④强阳性:染色强,呈棕褐色。
结果显示,在星状神经节内IFNGR免疫阳性产物广泛分布。在神经元(见图1Ⅲ,1ⅣA)中均有分布。神经元细胞膜(图1Ⅲ,ⅣD)上IFNGR免疫阳性产物呈颗粒状分布,着色为黄褐色,呈中等阳性。神经元胞质(见图1Ⅲ,ⅣC)着色表现差异性,胞体直径较小的神经元着色较深,为黄褐色,呈中等阳性,少数胞体直径较大的神经元胞质染色弱,为淡黄色或无色,呈弱阳性或阴性。神经元细胞核(见图1Ⅲ,1ⅣB)着色表现出差异性,91.87%的神经元细胞核呈阳性着色,核质部分明显呈棕褐色,为强阳性,而核仁染色相对较弱或无着色,为弱阳性或阴性;8.13%的细胞核染色弱呈淡黄色或无色,为弱阳性或阴性。卫星细胞(见图1Ⅲ,1ⅣF)染色情况不一,有的呈棕褐色,为强阳性,有的呈棕色,为中等阳性。神经纤维(见图1Ⅲ,1ⅣG)、血管内皮细胞(见图1ⅣI)等也有免疫阳性产物存在,呈黄褐色或淡黄色,为中等阳性或弱阳性。数据分析结果显示:在星状神经节中,IFNGR主要分布于神经元胞体,其相对表达量为75.98±5.80,高于过路纤维、卫星细胞等非神经细胞结构的4.57±1.88,两者相比较差异极显著(P<0.01)。
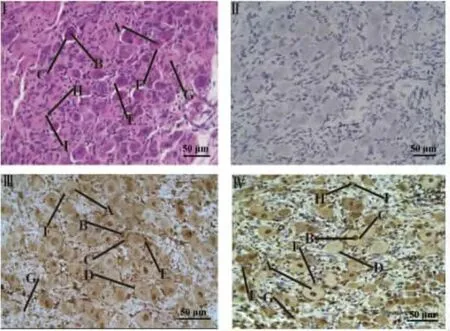
图1 IFNGR在星状神经节的HE染色和免疫组化染色Fig.1 HE and immunohistochem ical stains of IFNGR in stellate ganglion of female goat
2.2 IFNGR1 PCR检测结果
2.2.1 IFNGR1基因的PCR扩增结果 在雌性山羊星状神经节IFNGR1中扩增到的PCR产物在376 bp处有一个清晰的白色目标条带,β-actin PCR产物在150 bp处有一条清晰的白色条带,见图2。

将所得到的序列在NCBI上进行同源性比对显示:山羊与绵羊基因同源性最高(98%,XM_004011371.1),其次为牛(97%,NM_001035063.1),与褐家鼠(66%,NM_053783.1)的基因同源性最低。

图2 星状神经节IFNGR1部分cDNA PCR产物的琼脂糖凝胶电泳检测Fig.2 Agarose gel electrophoresis analysis of PCR product of IFNGR1 cDNA
3 讨论
在动物生产实际中,除了少数雄性动物留作种用外,大部分的雄性动物都被阉割做肉用,雌性动物承担了生产的主要任务。山羊作为反刍动物的一个代表,在实际生产中更是如此。星状神经节对心血管活动具有重要的调节作用。但是雌性山羊与雄性山羊的生理状态及生活习性存在较大的差别,并且雌性山羊怀孕期间的神经免疫内分泌机制明显不同于雄性山羊。因此,本研究综合生产实践与生物学研究的需求,选择以雌性山羊为研究对象检测IFN-γ受体在星状神经节的表达情况。
IFN-γ具有广泛的抗病毒、抗肿瘤和免疫调节作用。近年来研究发现,IFN-γ在免疫系统、神经系统和内分泌系统均有分布[2]。IFN-γ具有抑制血管平滑肌细胞增殖,调节细胞分化、增生的作用[16]。Karise等[17]曾报告IFN-γ能轻度刺激血管内皮细胞释放内皮素(ET),内皮素不仅是强烈的血管收缩剂,而且具有强烈的促血管平滑肌细胞增殖的效应[18]。研究还发现IFN-γ不仅能抑制平滑肌细胞增殖,还可通过激活细胞表面的Fas配体从而诱导平滑肌细胞的凋亡,并且IFN-γ还能刺激组织因子、MCP-1以及 CD40 的表达[9]。Liuzzo 等[10]研究发现,IFN-γ能通过激活单核细胞,降解胶原蛋白和弹力蛋白,使得动脉粥样硬化斑块不稳定而破裂,起到缓解动脉粥样硬化的作用。Eid等[8]对冠状动脉血管壁的炎症反应研究发现T细胞浸润冠状动脉并产生IFN-γ,它对血管平滑肌细胞的炎症反应起促进作用。以上资料表明IFN-γ可以直接或者间接地作用于心血管,对其功能活动及免疫活动起到一定的调节作用。
研究发现,IFN-γ广泛分布并作用于神经系统中。Kiefer等[2]曾报道,INF-γ样免疫反应产物分布于大鼠下丘脑乳头体核和中脑背侧被盖内,在外周神经系统,交感神经星状神经节细胞、脊神经节小细胞和胃肠道副交感神经节细胞中都有IFN-γ免疫阳性产物的广泛分布。本试验结果显示,在山羊星状神经节中IFNGR免疫阳性产物分布广泛,在神经元中均有分布,主要分布在细胞膜和细胞核上;星状神经节中神经元胞体中IFNGR的相对表达量与过路纤维相比差异极显著(P<0.01)。同时,PCR扩增到的星状神经节IFNGR1基因的cDNA片段全长376 bp,并且与绵羊基因同源性最高(98%),其次为牛(97%)。表明在山羊星状神经节中IFNGR主要在交感节后神经元表达和分布,具备对IFN-γ刺激做出反应的条件,提示山羊体内的星状神经节的交感节后神经元是IFN-γ主要作用的靶细胞。
研究发现,IFN-γ可以直接作用于神经元进而调节其功能活动。Song等[19]研究表明,IFN-γ可以诱导神经分化,促进神经突起生长。IFN-γ还可以促进并维持体外培养的皮质和海马神经元的神经突分支的形成[20]。Lein[21]用从大鼠颈前神经节分离的交感神经细胞培养证明IFN-γ可以直接作用于神经元而使树突收缩。而IFN-γ的生物活性的发挥是由IFNGR介导的。所以上述资料表明IFN-γ可以直接作用于神经元上的IFNGR而影响神经元的活动。本试验结果表明雌性山羊星状神经节中的交感节后神经元的细胞膜和细胞核中IFNGR广泛表达和分布。因此,星状神经节中的交感节后神经元是IFN-γ主要作用的靶细胞。所以,IFN-γ可以直接作用于星状神经节中的交感节后神经元而影响神经元的活动。这种影响的意义在于山羊星状神经节可能作为IFN-γ对心血管免疫调节途径和自主神经对心血管调节的神经途径之间相互协调的关键点。
4 结论
IFNGR免疫阳性产物在关中奶山羊星状神经节中广泛分布,IFNGR在神经元胞体的相对表达量极显著高于非神经元胞体结构(P<0.01)。同时PCR扩增到的山羊星状神经节IFNGR1基因的cDNA片段全长376 bp,并且与绵羊基因同源性最高(98%),其次为牛(97%),说明IFNGR在山羊星状神经节中有表达和分布,山羊星状神经节交感节后神经元具有对IFN-γ刺激反应的受体。提示IFN-γ可能通过影响星状神经节中神经元的活动,进而影响星状神经节支配的很多组织器官如心脏、血管、汗腺等组织器官的活动,其意义在于星状神经节的交感节后神经元有可能是IFN-γ作用于心血管等组织器官的免疫内分泌途径和自主神经途径之间相互协调的网络节点而发挥调节作用。
[1] Sun L,Tian ZZ,Wang JP.A direct cross-talk between interferongamma and sonic hedgehog signaling that leads to the proliferation of neuronal precursor cells[J].Brain Behav Immun,2010,24(2):220-228.
[2] Kiefer R,Kreutzberg GW.Gamma-interferon like immunoreactivity in the rat nervous system[J].Neurosci,1990,37(3):725-759.
[3] Randal M,Kossiakoff AA.The structure and activity of amonomeric interferon-gamma:alpha-chain receptor signaling complex[J].Structure,2001,9(2):155-163.
[4] Sadayuki Hashioka,Andis Klegeris,Claudia Schwab,et al.Differential expression of interferon-γreceptor on human glial cells in vivo and in vitro[J].JNeuroimmunol,2010,225(1-2):91-99
[5] Mübeccel Akdis.Interleukins,from 1 to 37,and interferon-γ:Receptors,functions,and roles in diseases[J].JAllergy Clin Immun,2011,127(3):E64-E70
[6] Igawa D,Sakai M,Saran R.An unexpected discovery of two interferon gamma-like genes along with interleukin(IL)-22 and-26 from teleost:IL-22 and-26 genes have been described for the first time outsidemammals.[J].Mol Immun,2006,43(7):999-1009.
[7] Rowse,Amber L,Naves,et al.Lithium controls central nervous system autoimmunity through modulation of IFN-γ signaling[J].PLoSOne,2012,7(12):e52658
[8] Eid RE,Rao DA,Zhou J,et al.Interleukin-17 and interferongamma are produced concomitantly by human coronary artery-infiltrating T cells and act synergistically on vascular smooth muscle cells[J].Circulation,2009,119(10):1424-1432.
[9] Weyand CM,Goronzy JJ,Liuzzo G,et al.T-cell immunity in acute coronary syndromes[J].Mayo Clin Proc,2001,76(10):1011-1020.
[10] Liuzzo G,Goronzy JJ,Yang H,et al.Monoclonal T cell proliferation and plaque instability in acute coronary syndromes[J].Circulation,2000,101:2883-2888.
[11] Selim K,Ayhan K,Mehmet DA,etal.Role of neuron density of the stellate ganglion on regulation of the basilar artery volume in subarachnoid hemorrhage:An experimental study[J].Auton Neurosci,2011,165(2):163-167.
[12] John Cravena.The autonomic nervous system,sympathetic chain and stellate ganglion[J].Anesth Intensive Care Med,2011,12(2):55-57.
[13] Elias M.Cervical sympathetic and stellate ganglion blocks[J].Pain Physician,2000,3(3):294-304.
[14] Schlack W,Sehafer S,Thamer V.Leftstellate ganglion block impairs left ventricular function[J].Anesth Analg,1994,79(6):1082-1088.
[15] Schlack W,Thämer V.Unilateral changes of sympathetic tone to the heart impair left ventricular function[J].Acta Anaesth Scand,1996,40(2):262-271.
[16] 孙双丹,王述妲,唐朝枢,等.γ-干扰素对内皮素促平滑肌细胞增殖效应的影响[J].中国应用生理学杂志,1993,9(2):172-173.
[17] Karise SM,TakanaihiK,Lam HC,etal.Cytokine stimulated endothelin release from endothelial cells[J].Life Sci,1991,48(14):1379-1384.
[18] Bobik,Grooills,Millar J,et al.Growth factor activity of endothelin on vascular smooth muscle[J].Am JPhysiol,1990,258(3):C408-C415
[19] Song JH,Wang CX,Song DK,et al.Interferon gamma induces neurite outgrowth by up-regulation of p35 neuron-specific cyclindependent kinase 5 activator via activation of ERK1/2 pathway[J].JBiol Chemi,2005,280(13):12896-12901.
[20] Barish ME,Mansdorf NB,Raissdana SS.Gamma-interferon promotes differentiation of cultured cortical and hippocampal neurons[J].Dev Bio,1991,144(2):412-435.
[21] Lein PJ.Interferon-gamma(IFNγ)causes dendrite retraction and synapse loss in rat sympathetic neurons in vivo[J].Auton Neurosci,2013,177(1):25.
[收稿2013-11-26 修回2013-12-25]
(编辑 张晓舟)
Expression characteristic of IFNGR in stellate ganglion of female goats
LIQiang,WANGZhi-Hao,JINXiu-Fang,XUYong-Ping,GUOXiao,CHENWen-Dong,DONGWei.Collegeof VeterinaryMedicine,NorthwestA&FUniversity,Yangling712100,China
Objective:To detect the existence of IFNGR in the stellate ganglion in female goats.Methods:The stellate ganglia were taken from female goats.The expression of IFNGR was detected by PCRmethod and immunohistochemical SP staining.Results:The results showed that:IFNGR immunoreactive substanceswere distributed in neurons,supporting cells and passing fiber,andmainly in the cytomembrane and nuclei of neurons.The relative expression of IFNGR was very significantly higher than that of non-neuronal cells(P <0.01).The sequence of IFNGR1 gene amplified by PCRmethod contained 376 bp,and IFNGR1 gene ofgoats exhibited the highest homology with sheep(98%),followed by cattle(97%).Conclusion:The results suggested that the IFNGR in the Stellate Ganglion of female goatsmainly expressed and located in sympathetic postganglionic neuronswhich were provided with the conditions for the role of IFN-γ,which implied that the Stellate Ganglionmay actas the critical point to concert the immune regulation of IFN-γ and neuroregulation of autonomic nerve on cardiovascular system.
Interferon-γ receptors;Stellate ganglion;Immunohistochemical SPmethod;PCR;Goats
S852.4
A
1000-484X(2014)05-0604-05
10.3969/j.issn.1000-484X.2014.05.007
①本文为国家自然科学基金项目(31072184)和陕西省农业推广项目(k332021309)。
李 强(1987年-),男,主要从事发育生物学研究,E-mail:dkyliqiang@sina.com。
及指导教师:徐永平(1971年-),硕士生导师,主要从事动物神经免疫内分泌的分子机制、动物生殖调控 机 理 研 究,E-mail:xuyp717@nwsuaf.edu.cn。
