红霉素对香烟烟雾刺激的人巨噬细胞组蛋白去乙酰化酶3表达影响的实验研究①
2014-02-06李梅华钟小宁文明智何志义彭信言广西医科大学附属第一医院呼吸科南宁530021
李梅华 钟小宁 文明智 何志义 彭信言 (广西医科大学附属第一医院呼吸科,南宁 530021)
红霉素对香烟烟雾刺激的人巨噬细胞组蛋白去乙酰化酶3表达影响的实验研究①
李梅华 钟小宁 文明智 何志义 彭信言 (广西医科大学附属第一医院呼吸科,南宁 530021)
目的:探讨红霉素对香烟烟雾刺激的人巨噬细胞组蛋白去乙酰化酶3(HDAC3)表达的影响。方法:体外培养人类单核细胞系U937细胞,用佛波脂(PMA)将其诱导分化为人巨噬细胞。按传统方法制备好香烟烟雾提取物(CSE)用于实验。将传代后的细胞分组:对照组、CSE组、红霉素+CSE组、HDAC特异性抑制剂曲古霉素(TSA)组。采用比色法检测细胞HDAC总活性;Western blot检测HDAC3和NF-κB蛋白表达;通过酶联免疫吸附实验(ELISA)检测细胞上清液中TNF-α的浓度。结果:1%CSE刺激人巨噬细胞引起细胞HDAC总活性减弱和HDAC3蛋白表达下降,诱导转录因子NF-κB活性增高,释放TNF-α;红霉素(1μg/m l)预孵育24 h可以增强CSE抑制的巨噬细胞HDAC3蛋白表达,下调NF-κB蛋白表达,抑制TNF-α的合成和释放。结论:红霉素通过上调HDAC3蛋白表达水平而抑制香烟烟雾诱导增强的转录因子NF-кB活性,进而影响炎症介质TNF-α的合成调控。
红霉素;组蛋白去乙酰化酶3;香烟烟雾
现在越来越多的证据支持大环内酯类药物(红霉素、罗红霉素、克拉霉素、阿奇霉素)作为免疫调节剂治疗方案在慢性肺部疾病,包括弥漫性泛细支气管炎、肺囊性纤维化、支气管哮喘和慢性阻塞性肺疾病(COPD)等的应用[1-3]。近期一些研究表明[4,5],长期小剂量应用大环内酯类治疗 COPD 取得了较好的效果。我们的前期研究发现红霉素可以抑制支气管上皮细胞IL-8、细胞间黏附因子(ICAM-1)的合成和释放,与抑制转录因子 NF-κB、激活蛋白-1(AP-1)活性有关[6],但有关红霉素抑制炎症基因转录活化的细胞内信号传导途径目前尚不清楚,因此我们在本实验中探讨红霉素抵抗香烟烟雾所诱导的炎症机制中的细胞内信号传导途径。
1 材料与方法
1.1 材料 佛波脂(PMA):美国Sigma公司产品;甲天下牌香烟(焦油:15 mg,烟碱:1.1 mg):广西南宁卷烟厂;红霉素:美国Sigma公司产品;IL-8酶联免疫吸附实验(ELISA)检测试剂盒:美国RD公司产品;DIG凝胶迁移率试剂盒:瑞士Roche公司产品;核蛋白提取试剂盒:美国Pierce公司产品;BCA蛋白浓度测定试剂盒:美国Pierce公司产品;HDAC活性测定试剂盒:美国Santa Crus公司产品;HDAC3多克隆抗体:美国Santa Crus公司产品。人类单核细胞系细胞株(U937细胞)从中国科学院细胞库购买。
1.2 分组 将传代后的人巨噬细胞分组:①对照组;②CSE组(加入1%CSE孵育24 h);③红霉素+CSE组(1μg/ml红霉素预孵育24 h后,加入1%CSE继续孵育24 h);④HDAC特异性抑制剂曲古霉素(TSA)组(加入TSA 100 ng/ml孵育24 h)。
1.3 方法
1.3.1 细胞培养 细胞在5%CO2,37℃,以含10%胎牛血清的RPMI1640培养基中培养,每周传代约2次。
1.3.2 应用佛波脂将U937单核细胞系诱导分化成巨噬细胞[7]①将 U937单核细胞重悬,离心(800~1 000 r/min,30~60 s),弃上清液。②加入新的培养基,重悬,计数。③将细胞均匀地接种到6孔板中,每孔细胞数为0.5×107~1×107个细胞。④加入佛波脂(10 ng/ml)诱导24 h。⑤24 h后,细胞贴壁,并可见细胞伸出伪足,提示单核细胞经诱导分化成巨噬细胞,丢弃上清液,加入新的培养基。
1.3.3 香烟烟雾提取物(CSE)的制作 ①参照以往CSE的制作方法及Se-Ran的香烟烟雾提取物的改良制作方法[8-10],将2支去过滤嘴香烟(甲天下牌香烟,长度84 mm,焦油含量:15 mg,烟碱含量:1.1 mg)燃烧完全后所产生的香烟烟雾由注射器驱动装置连续抽吸,将烟雾缓慢通入20 m l无血清的培养基中,制成悬液,密封瓶内,摇动使其充分溶解,得到10%浓度的CSE溶液,其浓度计算为煤焦油含量1 500 mg/L和烟碱含量110 mg/L。②将溶液的pH值调至7.4。③用0.22μm滤膜过滤溶液。④溶液于1 h内用于实验,稀释到需要的浓度后加入细胞。
1.3.4 TNF-α检测 按照ELISA试剂盒内说明书进行。
1.3.5 HDAC总活性测定 ①核蛋白提取,收集:按照核蛋白提取试剂盒(Pierce公司)说明进行。②核蛋白浓度检测:按照Pierce公司BCA蛋白检测试剂盒进行。③HDAC活性测定:按照试剂盒(Santa Crus公司)实验说明进行测定。
1.3.6 HDAC3和NF-κB蛋白表达水平测定 应用蛋白印迹实验(Western blot)检测HDAC3和NF-κB蛋白表达。4℃ 0.01 mol/L PBS单洗细胞3次,加300μl蛋白裂解液,裂解产物在冰上继续裂解30 min后4℃、12 000 r/min离心10 min。取上清测蛋白浓度及调整蛋白浓度,至3μg/μl,SDS-PAGE蛋白缓冲液按照比例混合,煮沸5min,立即放入冰箱,4℃、12 000 r/min离心 10 min,取上清,分装,放 -20℃备用。制备10%SDS-PAGE胶,4℃保存过夜,恢复至室温使用,上样进行垂直电泳,用10%SDSPAGE胶分离,转移到PVDF膜上,PVDF膜用含有5%脱脂奶粉的TBST溶液封闭1 h后,用TBST溶液平衡5 min,再与相应一抗(1∶1 000)在4℃共摇床孵育过夜,PVDF膜用TBST洗4次,每次5 min,加相应二抗(1∶5 000)在室温共摇床孵育1 h,再用TBST洗4次,每次5 min。在暗房内用发光剂发光,显影,定影,分析。
1.4 统计学处理 采用SPSS13.0统计软件对实验数据进行分析,数据用x-±s表示,两组间比较采用成组计量资料t检验,多组间比较采用方差分析(ANOVA分析),P<0.05表示差异有统计学意义。
2 结果
2.1 CSE刺激对人巨噬细胞HDAC总活性的影响与对照组比较,CSE可以明显抑制HDAC总活性(P<0.05),红霉素预孵育24 h稍减轻 CSE对HDAC总活性的抑制作用,但无统计学意义(P>0.05)。作为阴性对照组,HDAC的特异性抑制剂TSA组的HDAC总活性被抑制(P<0.05),见图1。
2.2 红霉素对CSE刺激的人巨噬细胞HDAC3蛋白表达的影响 与对照组比较,CSE可以明显抑制HDAC3蛋白表达,红霉素预孵育24 h能明显减轻CSE对HDAC1蛋白表达的抑制作用。作为阴性对照组,HDAC的特异性抑制剂TSA组的HDAC3表达明显被抑制(P<0.05),见图2A、B。
2.3 红霉素对CSE刺激的人巨噬细胞NF-κB蛋白表达的影响及HDAC特异性抑制剂TSA对NF-κB蛋白表达的影响 与对照组比较,CSE可以明显增强NF-κB的蛋白表达,红霉素预孵育24 h可抑制CSE对NF-κB蛋白表达的上调作用;同时,HDAC特异性抑制剂TSA可以增强 NF-κB的蛋白表达(P<0.05),见图3A、B。

图2 红霉素对香烟烟雾刺激的人巨噬细胞HDAC3蛋白表达影响Fig.2 Effect of EM on CSE-induced HDAC3 protein expression in human macrophages
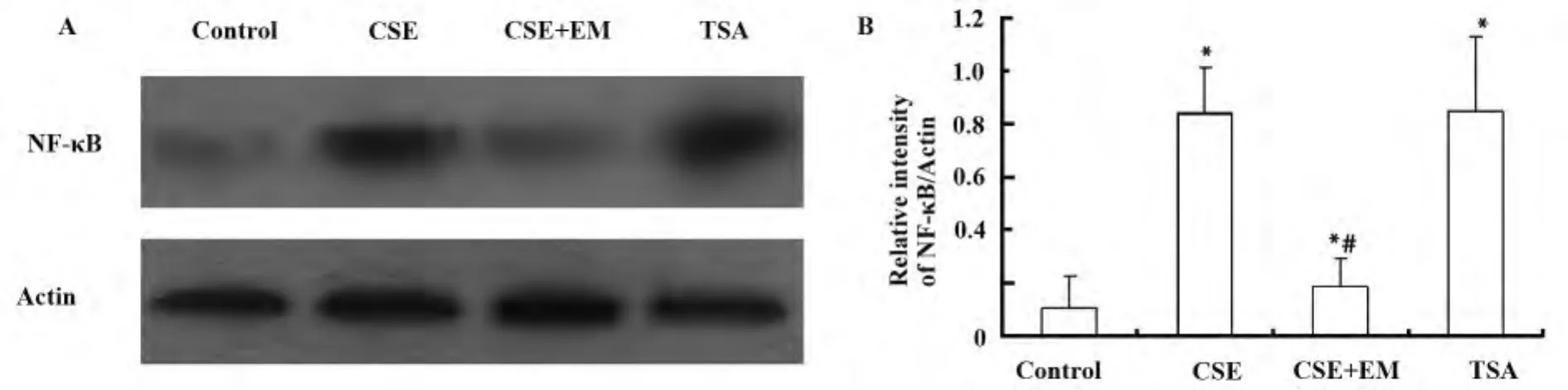
图3 红霉素对香烟烟雾刺激的人巨噬细胞NF-КB蛋白表达影响Fig.3 Effects of EM on CSE-induced NF-κB protein expression in human macrophages
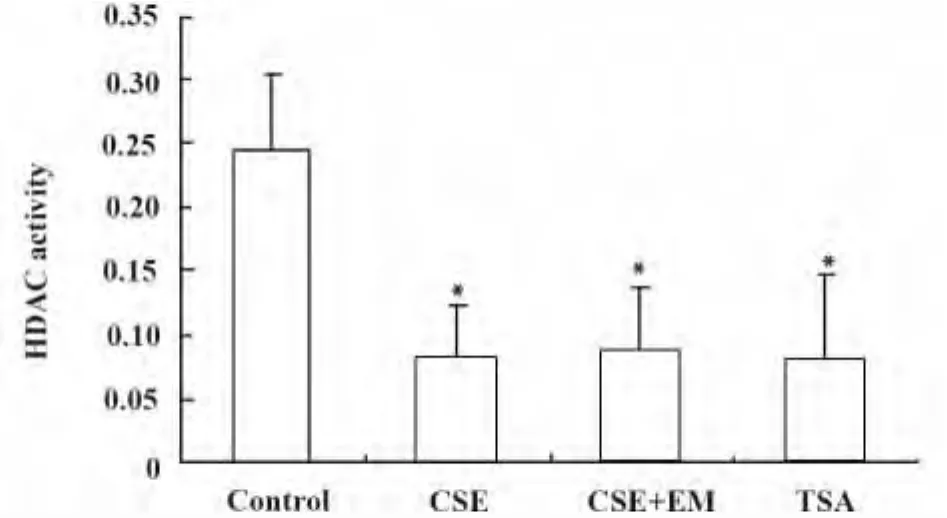
图1 红霉素对香烟烟雾刺激的人巨噬细胞HDAC总活性的影响Fig.1 Effect of EM on CSE-induced change in histone deacetylase(HDAC)activity in human macrophages

图4 红霉素对香烟烟雾刺激的人巨噬细胞释放TNF-α的影响Fig.4 Effect of EM on CSE-induced TNF-α protein release in human macrophages
2.4 红霉素对CSE刺激的人巨噬细胞释放TNF-α的影响 与对照组比较,CSE组细胞上清中的TNF-α含量明显增高(P<0.05),红霉素预孵育24 h能明显抑制 CSE对细胞 TNF-α的上调作用(P<0.05),见图4。
3 讨论
组蛋白乙酰化酶(HAT)和组蛋白去乙酰化酶(HDAC)是调节染色质结构的酶,因此影响炎症基因的表达[11,12]。具有内源性组蛋白乙酰化酶活性的核心组蛋白的乙酰化导致染色质解旋致转录因子和RNA聚合酶II结合到DNA上,促进基因转录。增强的组蛋白的乙酰化可以加强炎症基因的表达。核心组蛋白的去乙酰化通常与转录抑制相关[11,13]。HDACs可以抑制组蛋白的乙酰化,HDAC从组蛋白赖氨酸残基上转移乙酰基,致DNA缠绕、阻碍了基本转录单位蛋白质复合物进入启动子结合位点,导致转录功能受到抑制。HDACs在抑制基因表达以及抑制核心组蛋白的过度乙酰化方面起着重要作用[14]。HDACs家族包含四个组 18 亚型[15]。I型(HDAC1,2,3,8,11)已被证明在调控细胞增殖和炎症反应中起重要作用,HDAC3是HDACs中的一个重要亚型,可通过组蛋白去乙酰化作用,调控染色质重构和炎症基因的表达[15]。
最近有研究报道,香烟烟雾引起HDAC表达下降[10,16],香烟烟雾降低 HDAC1,2,3 蛋白表达水平[10],因此影响炎症基因的表达[17]。在这项研究中,我们观察到香烟烟雾引起人巨噬细胞HDAC总活性下降的同时,HDAC3蛋白表达明显下降,提示HDAC3在香烟烟雾所诱导的炎症机制中起重要作用。本研究同时显示,红霉素明显减轻香烟烟雾引起人巨噬细胞HDAC3蛋白表达下降,提示红霉素能够活化HDAC3,显著增加HDAC3蛋白的表达含量,这提示为红霉素具有对抗香烟烟雾诱导氧化应激所导致的炎症的分子学作用机制之一;此外,实验结果提示红霉素可提高HDAC总活性,但无统计学意义,可能与样本量小有关。
研究结果进一步显示,香烟烟雾引起巨噬细胞HDAC3蛋白表达下降的同时,诱导增强NF-κB的转录活性和蛋白表达,释放TNF-α增多;HDAC特异性抑制剂TSA抑制HDAC总活性和HDAC3蛋白表达的同时,促使 NF-κB蛋白表达增强,提示HDAC3调控NF-κB表达,香烟烟雾通过抑制HDAC总活性和HDAC3蛋白表达,诱导增强NF-κB蛋白表达,促进巨噬细胞释放炎症介质TNF-α,从而诱导炎症。既往一些研究支持我们的结果,HDAC1,2,3通过直接或间接改变核转录因子如NF-κB的活性从而在调节炎症反应中发挥重要作用[15]。实验结果同时显示红霉素不仅可增加HDAC3蛋白表达,并且抑制香烟烟雾诱导增强的 NF-кB活性,抑制TNF-α释放,提示红霉素通过增加HDAC3蛋白的表达含量,进而抑制香烟烟雾诱导增强的NF-κB活性和 TNF-α释放,从而对抗香烟烟雾所诱导的炎症。
综上所述,香烟烟雾引起炎症介质的释放,与HDAC3的调控有关。红霉素可抑制香烟烟雾诱导的炎症,主要与红霉素活化HDAC3,进而抑制炎症介质合成和释放相关,实验结果为红霉素治疗与吸烟密切相关的气道慢性炎症性疾病如慢性支气管炎、慢性阻塞性肺疾病、吸烟的支气管哮喘患者等提供了实验依据。
[1] Rubin BK,Henke MO.Immunomodulatory activity and effectiveness ofmacrolides in chronic airway disease [J].Chest,2004,125(2):70S-78S.
[2] Parnham MJ.Immunomodulatory effects of antimicrobials in the therapy of respiratory tract infections[J].Curr Opin Infect Dis,2005,18(2):125-131.
[3] Giamarellos-Bourboulis EJ.Macrolides beyond the conventional antimicrobials:a class of potent immunomodulators[J].Int JAntimicrob Agents,2008,31(1):12-20.
[4] Seemungal TA,Wilkinson TM,Hurst JR,et al.Long-term erythromycin therapy is associated with decreased chronic obstructive pulmonary disease exacerbations[J].Am J Respir Crit Care Med,2008,178(11):1139-1147.
[5] Wilkinson TM,Donaldson GC,Hurst JR,etal.Early therapy improves outcomes of exacerbations of chronic obstructive pulmonary disease[J].Am J Respir Crit Care Med,2004,169(12):1298-1303.
[6] 李梅华,钟小宁,柳广南,等.红霉素抑制肿瘤坏死因子α对人支气管上皮细胞核因子-κB的激活[J].中华内科杂志,2005,44(7):530-531.
[7] Verhoeckx KC,Bijlsma S,de Groene EM,etal.A combination of proteomics,principal component analysis and transcriptomics is a powerful tool for the identification of biomarkers for macrophage maturation in the U937 cell line[J].Proteomics,2004,4(4):1014-1028.
[8] Martey CA,Pollock SJ,Turner CK,etal.Cigarette smoke induces cyclooxygenase-2 and microsomal prostaglandin E2 synthase in human lung fibroblasts:implications for lung inflammation and cancer[J].Am J Physiol Lung Cell Mol Physiol,2004,287(5):L981-L991.
[9] Moodie FM,Marwick JA,Anderson CS,et al.Oxidative stress and cigarette smoke alter chromatin remodeling but differentially regulate NF-kappaB activation and proinflammatory cytokine release in alveolar epithelial cells[J].FASEB J,2004,18(15):1897-1899.
[10] Yang SR,Chida AS,Bauter MR,et al.Cigarette smoke induces proinflammatory cytokine release by activation of NF-kappaB and posttranslationalmodifications of histone deacetylase inmacrophages[J].Am JPhysiol Lung Cell Mol Physiol,2006,291(1):L46-L57.
[11] Urnov FD,Wolffe AP.Chromatin remodeling and transcriptional activation:the cast(in order of appearance)[J].Oncogene,2001,20(24):2991-3006.
[12] Gilmour PS,Rahman I,Donaldson K,et al.Histone acetylation regulates epithelial IL-8 releasemediated by oxidative stress from environmental particles[J].Am JPhysiol Lung Cell Mol Physiol,2003,284(3):L533-L540.
[13] Ito K,Ito M,Elliott WM,et al.Decreased histone deacetylase activity in chronic obstructive pulmonary disease[J].N Engl J Med,2005,352(19):1967-1976.
[14] Barnes PJ.Reduced histone deacetylase in COPD:clinical implications[J].Chest,2006,129(1):151-155
[15] de Ruijter AJ,van Gennip AH,Caron HN,et al.Histone deacetylases(HDACs):characterization of the classical HDAC family[J].Biochem J,2003,370(3):737-749.
[16] Rajendrasozhan S,Yao H,Rahman I.Current perspectives on role of chromatin modifications and deacetylases in lung inflammation in COPD[J].COPD,2009,6(4):291-297.
[17] Barnes PJ,Ito K,Adcock IM.Corticosteroid resistance in chronic obstructive pulmonary disease:inactivation of histone deacetylase[J].Lancet,2004,363(9410):731-733.
[收稿2013-09-25 修回2014-01-08]
(编辑 许四平)
Effect of erythrom ycin on cigarette smoke-induced histone deacetylase-3 protein expression in human macrophages
LIMei-Hua,ZHONGXiao-Ning,WENMing-Zhi,HEZhi-Yi,PENGXin-Yan.DepartmentofRespiratoryMedicine,theFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China
Objective:To study the effect of erythromycin(EM)on cigarette smoke-induced histone deacetylase-3(HDAC3)protein expression in human macrophages in vitro.Methods:The Aqueous cigarette smoke extract(CSE)was always prepared fresh on the day of the experiment.The U937 monocytic cellswere differentiated intomacrophages by using phorbol12-myristate 13-acetate(PMA)according to standard procedures.The U937 differentiated cells were treated with either CSE(1%)or EM(1 μg/ml)pretreatment,and HDAC inhibitor trichostatin A(TSA;100 ng/ml)for 24 h.HDAC activity wasmeasured with a colorimetric assay kit and Western blotwas used for HDAC3 and factor nuclear-kappaB(NF-κB)protein assays.The levels of tumor necrosis factor-α(TNF-α)release in the supernatantwere determined by enzyme linked immunosorbentassay(ELISA).Results:CSE(1%)significantly decreased HDAC activity and HDAC 3 protein levels at24 h.Preincubation with EM(1μg/ml)for 24 h significantly inhibit CSE(1%)induced decrease of HDAC3 protein expression.Furthermore,Preincubation with EM(1 μg/ml)for 24 h significantly inhibit NF-κB activity and TNF-α release in humanmacrophages.Conclusion:EM is able to restore HDAC3 levels decreased by cigarette smoke and inhibit NF-κB activity resulting in decreasing CSE-mediated TNF-α release,which has shown an importantexplanation that EM possess the anti-inflammatory effect induced by cigarette smoke.
Erythromycin;histone deacetylase 3;Cigarette smoke
R965
A
1000-484X(2014)05-0600-05
10.3969/j.issn.1000-484X.2014.05.006
①本文为国家自然科学基金资助项目(No.30760085)、国家自然科学基金资助项目(No.81360012)及广西壮族自治区卫生厅自筹经费科研课题(No.Z2012076)。
李梅华(1975年-),女,博士,副教授,硕士生导师,主要从事慢性阻塞性肺疾病的发病机制及防治研究。
及指导教师:钟小宁(1959年-),男,博士,教授,博士生导师,主要从事慢性阻塞性肺疾病的发病机制及防治研究。
