人脐带间充质干细胞培养上清对正常人淋巴细胞各亚群比例的影响①
2014-02-06邵红伟卢志毅张柳华黄树林
陈 璇 袁 茵 邵红伟 卢志毅 张柳华 黄树林
(广东药学院生命科学与生物制药学院生物制药研究所广东省生物技术候选药物研究重点实验室,广州 510006)
人脐带间充质干细胞培养上清对正常人淋巴细胞各亚群比例的影响①
陈 璇 袁 茵②邵红伟 卢志毅 张柳华 黄树林
(广东药学院生命科学与生物制药学院生物制药研究所广东省生物技术候选药物研究重点实验室,广州 510006)
目的:研究人脐带间充质干细胞(hUC-MSCs)培养上清对正常人外周血单个核细胞(PBMC)活化、生存及其各淋巴细胞亚群比例的影响。方法:通过密度梯度离心法分离PBMC,加入OKT3刺激,用含有hUC-MSCs培养上清的条件培养基(MSC-CM)处理PBMC,流式细胞术分析比较处理组和对照组各淋巴细胞亚群比例的变化,ELISA法检测MSC-CM对PBMC分泌IFN-γ、IL-10的影响,Annexin V/PI双染确定活化PBMC的凋亡情况。结果:MSC-CM下调了CD4+/CD8+T细胞比值,上调了PBMC中CD4+CD25+CD127lowTreg细胞的含量,而对其他淋巴细胞亚群的比例无显著影响;MSC-CM抑制了PBMCs分泌IFN-γ的能力,但对IL-10的分泌有促进作用;此外,MSC-CM对PBMCs有保护作用,降低了PBMC在OKT3刺激下的凋亡程度。结论:人脐带间充质干细胞的免疫抑制功能可不依赖于与免疫细胞的直接或间接接触,并且与诱导免疫细胞凋亡无关,促进Treg细胞的增殖和活化可能是人脐带间充质干细胞发挥其免疫抑制功能的途径之一。
人脐带间充质干细胞;调节性T淋巴细胞;免疫调节
间充质干细胞(Mesenchymal stem cells,MSCs)广泛存在于多种组织,具有自我更新和多向分化潜能,并具有独特的免疫调节作用,是细胞治疗领域理想的种子细胞[1]。目前,在MSCs的临床以及基础研究中广泛使用的是骨髓来源的MSCs(BMMSCs)。骨髓的来源有限,取样时要进行侵袭性操作,而且随着供体年龄增长骨髓中MSCs的数量急剧下降,使其应用受到了限制[2]。人脐带组织来源的间充质干细胞(hUC-MSCs)取材方便,无伦理学争议,增殖能力更强,能连续多次传代后仍保持干细胞特性,已成为BM-MSCs的良好替代物。
间充质干细胞能够调控体内多种免疫细胞的活化和功能,具有广泛的免疫抑制效应,在自身免疫性疾病和移植物抗宿主病(GVHD)的临床治疗中有潜在的应用价值[3,4]。因此,有关 MSCs免疫调节作用机制的研究已成为干细胞研究领域的热点。目前对于骨髓源MSCs免疫特性的研究比较充分,而脐带源MSCs免疫调节功能的研究则相对较少。本实验主要研究了hUC-MSCs培养上清对淋巴细胞活化、生存及其各亚群比例的影响,旨在明确 hUCMSCs是否具有固有的分泌性免疫调节功能,探究在hUC-MSCs免疫调节过程中发挥关键作用的免疫细胞,为人脐带来源间充质干细胞的临床应用提供理论基础。
1 材料与方法
1.1 主要试剂 DMEM/F12培养基购自美国Gibco BRL公司,人淋巴细胞分离液为天津灏洋生物制品科技有限公司产品,鼠抗人CD3-PE-Cy5、CD4-PE、CD8-PC7、CD19-ECD、CD16-FITC、CD56-PE、CD4-FITC、CD25-PC5、CD127-PE等荧光标记抗体购自Beckman Coulter公司,细胞因子 IFN-γ、IL-10 ELISA检测试剂盒购自武汉博士德生物公司,Annexin VFITC/PI细胞凋亡检测试剂盒为MBL公司产品。
1.2 细胞培养 人脐带间充质干细胞由本室分离和鉴定[5],培养于含10%胎牛血清的 DMEM/F12培养基中,取P3~P8代hUC-MSCs的培养上清用于实验。具体方法为:将1.5×106个hUC-MSCs细胞接种于10 cm塑料培养皿,加入10 ml DMEM/F12完全培养基培养3 d后(约80%融合)收集细胞培养上清,0.22μm滤膜过滤,4℃保存,1周内使用。用于培养PBMC的间充质干细胞条件培养基(MSCCM)的配方为:hUC-MSCs培养上清:DMEM/F12培养基(含10%胎牛血清)=3∶2,临用前配制。
使用淋巴细胞分离液从健康成年人外周血中分离PBMC。取等量的同一供者PBMC,分别以MSCCM和DMEM/F12培养基进行培养,培养体系中含1 000 U/ml的人重组IL-2和50 ng/m l OKT3,5 d后收集细胞进行流式检测,同时收集细胞培养上清用于ELISA检测。
1.3 流式细胞术检测淋巴细胞各亚群比例 离心收集对照组PBMC和MSC-CM处理组PBMC,加入PBS洗涤1次,按2×105细胞/管加入流式管,根据每一种淋巴细胞免疫表型检测的需要,设置相应的空白对照、同型对照、单色荧光补偿对照以及单色或多色标记的待测样本,加入对应的荧光标记抗体,室温避光孵育30min,洗涤2次,最后用500μl PBS重悬细胞,上BECKMAN COULTER Gallios流式细胞仪检测B细胞、T细胞以及NK细胞的含量,使用FlowJo软件分析检测结果。
1.4 细胞凋亡检测 取对照组PBMC和MSC-CM处理组PBMC各1×105个,用PBS洗涤1次,每管加85μl结合缓冲液重悬细胞,再加入10μl Annexin V-FITC和5μl PI,轻轻混匀后室温避光孵育15 min,最后向每管中加400μl结合缓冲液,用流式细胞仪测定两组PBMC的细胞凋亡情况。
1.5 ELISA法检测细胞因子分泌 取对照组PBMC和MSC-CM处理组PBMC的培养上清,过滤除去上清中残留的细胞,另取在CO2培养箱中同步培养的同批次无细胞DMEM/F12培养基和MSC-CM作为空白对照,以上4组分别按100μl/孔加入到预包被有IFN-γ抗体或IL-10抗体的酶标板孔内,每组3复孔,采用双抗夹心ELISA法测定各孔在450 nm处的OD值,具体操作按说明书进行。
1.6 统计学分析 本实验数据采用 GraphPad Prism软件进行处理,以x-±s表示,组间比较采用t检验(t检验前先做两样本的方差齐性检测)。
2 结果
2.1 淋巴细胞各亚群比例测定 通过单色或多色免疫荧光染色流式细胞术分析PBMC中淋巴细胞各亚群的含量,分别测定了CD19+B淋巴细胞、CD3+T淋巴细胞、CD4+CD25+CD127low调节性T淋巴细胞、CD3-CD16+CD56+NK细胞在两组PBMC中的比例以及两组PBMC中CD4+/CD8+T淋巴细胞的比值。通过比较得知,对照组PBMC和MSC-CM处理组PBMC的CD19+B淋巴细胞、CD3+T淋巴细胞和CD3-CD16+CD56+NK细胞的含量均无显著性差异,而 MSC-CM处理组 PBMC的 CD4+CD25+CD127low调节性 T淋巴细胞含量高于对照组,CD4+/CD8+T淋巴细胞比值低于对照组,差异有统计学意义(P<0.05),见表1和图1。
2.2 IFN-γ和IL-10的分泌水平 通过ELISA法分别检测了实验组PBMC和MSC-CM处理组PBMC分泌IFN-γ和IL-10的情况。结果显示,在OKT3刺激下,与对照组相比,经MSC-CM处理的PBMC分泌IFN-γ的能力下降,但分泌IL-10的能力增强,上述差异均有统计学意义,见图2。
2.3 PBMC凋亡率的改变 对照组PBMC和MSC-CM处理组PBMC体外培养5 d时的自发凋亡情况见图2。从流式图中可以看出,MSC-CM处理组PBMC发生早期凋亡(Annexin V+PI-,右下象限)和晚期凋亡(Annexin V+PI+,右上象限)的细胞均少于对照组;相应地,MSC-CM处理组PBMC的活细胞比例则显著高于对照组。上述差异均有统计学意义,见图3。
表1 hUC-M SCs培养上清对淋巴细胞各亚群比例的影响±s)Tab.1 Effect of hUC-MSC supernatant on subgroup proportions in lym phocytes± s)
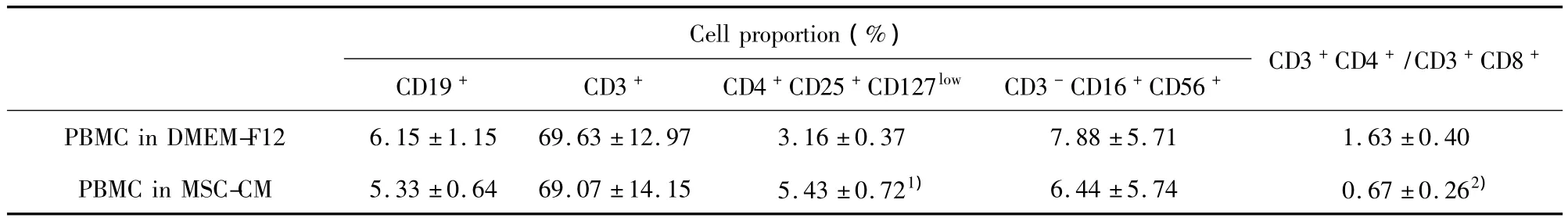
表1 hUC-M SCs培养上清对淋巴细胞各亚群比例的影响±s)Tab.1 Effect of hUC-MSC supernatant on subgroup proportions in lym phocytes± s)
Note:1)P <0.01;2)P <0.05.
Cell proportion(%)+CD19+ CD3+ CD4+CD25+CD127low CD3-CD16+CD56+ CD3+CD4+/CD3+CD8 PBMC in DMEM-F12 6.15 ±1.15 69.63 ±12.97 3.16 ±0.37 7.88 ±5.71 1.63 ±0.40 PBMC in MSC-CM 5.33 ±0.64 69.07 ±14.15 5.43 ±0.721) 6.44 ±5.74 0.67 ±0.262)
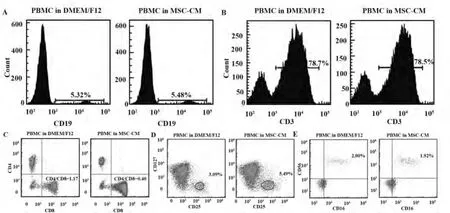
图1 hUC-MSCs培养上清作用下淋巴细胞各亚群比例变化的流式检测Fig.1 Representative flow cytometric analysis of subgroup proportions in PBMC treated w ith conditioned medium of hUC-MSCs

图3 hUC-M SCs培养上清降低活化PBMC的凋亡程度Fig.3 hUC-MSCs protect activated PBMC from apoptosis

图2 hUC-MSCs培养上清作用下PBMC分泌细胞因子IFN-γ、IL-10 的变化Fig.2 Secretion levels of IFN-γ and IL-10 by PBMC cultured in DMEM/F12 medium and in MSC-CM
3 讨论
间充质干细胞具有独特的免疫调节功能,能在体内外发挥免疫抑制作用,包括抑制同种异体PBMC诱导的T细胞、B细胞、NK细胞的增殖以及抑制树突细胞(DC)的成熟[6,7]。有研究证明,骨髓来源的MSCs(BM-MSCs)对于异基因造血干细胞移植后发生的急性顽固性移植物抗宿主病具有良好的临床治疗效果[8],在同种异体移植耐受诱导方面具有极大的临床应用价值。与BM-MSCs的低免疫原性相似,hUC-MSCs不表达HLA-DR或共刺激分子,不能激活异源PBMC的增殖反应[9],也可用于异基因移植。此外,hUC-MSCs还具有来源充足、无痛取样、微生物感染几率低和扩增性好等优点,脐带组织在人类胚胎发育中的特殊地位和作用也为hUCMSCs带来了更潜在的优势。
本文用含有hUC-MSCs独立培养上清的条件培养基处理OKT3刺激的PBMC,检测后发现处理组PBMC分泌IFN-γ的水平明显低于未处理组。IFN-γ的分泌水平是表征PBMC活化程度的标志之一。因此,我们的结果不仅证实hUC-MSCs具有免疫调节作用,同时也反映出hUC-MSCs不依赖于细胞直接接触而发挥其免疫抑制功能的特点。尽管有报道认为MSCs需要与靶细胞发生直接接触才能发挥免疫抑制作用[10],但大多数的研究仍然表明,MSCs的免疫抑制作用主要还是通过可溶性细胞因子的释放而实现的[11]。
已报道的由MSCs分泌并介导免疫抑制的可溶性因子有转化生长因子-β(Transforming growth factor-β,TGF-β)、肝细胞生长因子(Hepatocyte growth factor,HGF)[11]、白介素 2(Interleukin-2,IL-2)和 IL-10[12]、2,3-吲哚胺双加氧酶(IDO)、一氧化氮(Nitric oxide,NO)以及前列腺素 E2(PGE2)[13]。因此,除了直接接触以外,在Transwell实验中,MSCs仍可抑制丝裂原激活的PBMC增殖和IFN-γ的分泌,其免疫抑制效应持续不变[13]。但在间充质干细胞是否天生就具有免疫抑制能力这一问题上,有人提出MSCs的免疫抑制功能是在受到活化的免疫细胞所分泌的炎症因子刺激后才表现出来的,而并非天生固有的[14]。这种观点与Transwell实验的结果并不矛盾,因为用Transwell将MSCs与PBMC分隔并不能阻止两者之间通过可溶性因子进行动态的信号交换。而本文使用的是处于独立培养状态的MSCs培养上清,在用于处理PBMC之前并未与其发生过任何直接或间接的接触,却仍可抑制PBMC分泌IFN-γ,这提示hUC-MSCs可能具有固有的分泌型免疫抑制能力。
本文进一步研究了hUC-MSCs上清对PBMC各淋巴细胞亚群比例的影响。我们的数据显示,含有hUC-MSCs上清的条件培养基(MSC-CM)下调了CD4+/CD8+T淋巴细胞比值,使 CD4+CD25+CD127lowTreg细胞在淋巴细胞中的比例发生了上调,但对其他淋巴细胞亚群无显著影响。不仅如此,MSC-CM还促进了PBMC的IL-10分泌水平。Treg是机体发挥免疫抑制功能的关键性调节细胞,在体内的主要作用是调节机体免疫平衡,防止免疫反应无限制扩大及抑制自身免疫反应的发生。Treg细胞能够抑制CD4+CD25-T细胞的增殖活化,抑制NK细胞的增殖、细胞因子分泌和细胞毒作用,以及抑制B细胞的免疫活性[15]。IL-10是Treg细胞发挥其免疫抑制功能的关键性细胞因子,Treg通过分泌IL-10抑制Th1介导的免疫反应、Th2介导的抗体产生和CD8+细胞毒性T细胞的活化[16]。因此,本文的结果表明,hUC-MSCs不仅使Treg细胞在数量上发生了扩增,可能还对Treg细胞的活化和功能有促进作用,Treg细胞可能是hUC-MSCs发挥免疫抑制作用的重要效应细胞。
CD4+/CD8+T淋巴细胞的比值是判断机体免疫状态的敏感指标,它的下降提示机体免疫功能低下或处于免疫抑制状态。本研究发现,hUC-MSCs上清在使 Treg细胞比例增加的同时,还下调了CD4+/CD8+T淋巴细胞的比值,这进一步证明了hUC-MSCs所具有的免疫抑制功能。由于Treg细胞能够抑制CD4+T淋巴细胞亚群中起主要免疫效应的辅助性T细胞的活化增殖和细胞因子分泌[17],因此,本文推测hUC-MSCs上清引起的Treg细胞增加与CD4+/CD8+比值下降之间可能存在一定的关系,即:Treg细胞可能通过抑制CD4+T淋巴细胞主要亚群的增殖,进而影响CD4+T淋巴细胞的整体含量,并导致CD4+/CD8+T淋巴细胞的比值的下降。
本研究还发现,hUC-MSCs培养上清对活化的PBMC有保护作用,能降低PBMC在OKT3刺激下的凋亡程度,从而证明hUC-MSCs免疫调节功能的发挥与诱导免疫细胞凋亡无关。目前文献中关于MSCs影响免疫细胞凋亡的认识仍存在分歧,有报道认为MSCs通过启动活化T细胞的早期凋亡而发挥免疫调节作用[18],但是后期也有 MSCs保护 T细胞、使其免于凋亡的报道[19]。本研究的数据证明hUC-MSCs能够抑制免疫细胞凋亡而不是诱导凋亡,与Benvenuto等[19]的报道相一致。
综上所述,本文通过将独立培养的hUC-MSCs培养上清作用于活化的PBMC,发现hUC-MSCs可通过分泌可溶性因子抑制免疫反应,其免疫抑制功能的发挥可不依赖于与免疫细胞的直接或间接接触,也不会加剧免疫细胞的凋亡,并且证实促进Treg细胞的扩增和活化可能是hUC-MSCs发挥其免疫抑制功能的途径之一,为人脐带间充质干细胞在临床免疫治疗中的应用提供了理论基础。
[1] 徐 燕,李长虹,孟恒星,等.人脐带间充质干细胞分离培养条件的优化及其生物学特性[J].中国组织工程研究与临床康复,2009,13(32):6289-6294.
[2] 王国艳,张思英,李广云,等.人胎盘源间充质干细胞对脐血CD8+T细胞活化及周期和IL-17分泌的影响[J].细胞与分子免疫学杂志,2012,28(1):17-20.
[3] 付 裕,滕银燕,徐朝伟,等.骨髓间充质干细胞对实验性自身免疫性重症肌无力大鼠的治疗作用[J].中国现代神经疾病杂志,2012,12(2):161-165.
[4] 肖燕妮,张 曦,刘 耀,等.脐血间充质干细胞治疗GVHD的效果(附5例异基因造血干细胞移植术后GVHD的治疗)[J].中国输血杂志,2013(4):318-320.
[5] Yuan Y,Lu X,Tao CL,et al.Forced expression of indoleamine-2,3-dioxygenase in human umbilical cord-derived mesenchymal stem cells abolishes their anti-apoptotic effect on leukemia cell lines in vitro[J].In Vitro Cell Dev Biol Anim,2013,49(10):752-758.
[6] Glennie S,Soeiro I,Dyson PJ,et al.Bone marrow mesenchymal stem cells induce division arrest anergy of activated T cells[J].Blood,2005,105(7):2821-2827.
[7] Krampera M,Cosmi L,AngeliR,etal.Role for interferon-gamma in the immunomodulatory activity of human bone marrow mesenchymal stem cells[J].Stem Cells,2006,24(2):386-398.
[8] Le BK,Frassoni F,Ball L,et al.Mesenchymal stem cells for treatment of steroid-resistant,severe,acute graft-versus-host disease:a phase II study[J].Lancet,2008,371(9624):1579-1586.
[9] WeissML,Anderson C,Medicetty S,et al.Immune properties of human umbilical cord Wharton 's jelly-derived cells[J].Stem Cells,2008,26(11):2865-2874.
[10] Aldinucci A,Rizzetto L,Pieri L,et al.Inhibition of immune synapse by altered dendritic cell actin distribution:a new pathway ofmesenchymal stem cell immune regulation[J].J Immunol,2010,185(9):5102-5110.
[11] Di Nicola M,Carlo-Stella C,Magni M,et al.Human bonemarrow stromal cells suppress T-lymphocyte proliferation induced by cellular or nonspecific mitogenic stimuli[J].Blood,2002,99(10):3838-3843.
[12] Rasmusson I,Ringden O,Sundberg B,et al.Mesenchymal stem cells inhibit lymphocyte proliferation bymitogens and alloantigens by different mechanisms[J]. Exp Cell Res,2005,305(1):33-41.
[13] Chen K,Wang D,Du Wt,et al.Human umbilical cord mesenchymal stem cells hUC-MSCs exert immunosuppressive activities through a PGE2-dependent mechanism[J].Clin Immunol,2010,135(3):448-458.
[14] Aggarwal S,PittengerM F.Humanmesenchymal stem cellsmodulate allogeneic immune cell responses[J].Blood,2005,105(4):1815-1822.
[15] Larmonier N,Marron M,Zeng Y,et al.Tumor-derived CD4(+)CD25(+)regulatory T cell suppression of dendritic cell function involves TGF-beta and IL-10[J].Cancer Immunol Immunother,2007,56(1):48-59.
[16] Selmani Z,Naji A,Zidi I,et al.Human leukocyte antigen-G5 secretion by human mesenchymal stem cells is required to suppress T lymphocyte and natural killer function and to induce CD4+CD25highFOXP3+regulatory T cells.[J].Stem Cells,2008,26(1):212-222.
[17] Jonuleit H,Schmitt E,Kakirman H,et al.Infectious tolerance:human CD25(+)regulatory T cells convey suppressor activity to conventional CD4(+)T helper cells[J].J Exp Med,2002,196(2):255-260.
[18] Plumas J,Chaperot L,Richard MJ,et al.Mesenchymal stem cells induce apoptosis of activated T cells[J].Leukemia,2005,19(9):1597-1604.
[19] Benvenuto F,Ferrari S,Gerdoni E,et al.Human mesenchymal stem cells promote survival of T cells in a quiescent state[J].Stem Cells,2007,25(7):1753-1760.
[收稿2013-10-25 修回2013-12-23]
(编辑 张晓舟)
Influence of supernatant from human umbilical cord-derived mesenchymal stem cells on proportions of each human lym phoid subgroup
CHENXuan,YUANYin,SHAOHong-Wei,LUZhi-Yi,ZHANGLiu-Hua,HUANGShu-Lin.GuangdongProvincialKey LaboratoryofBiotechnologyCandidateDrugResearch,DepartmentofLifeScienceandBiologicalPharmacy,GuangdongPharmaceuticalUniversity,Guangzhou510006,China
Objective:To investigate the impact of human umbilical cord-derivedmesenchymal stem cells on the activation,the survival of human peripheral blood mononuclear cell(hPBMC)and the proportions of each human lymphoid subgroup.Methods:PBMC were isolated from healthy donors by density gradient centrifugation,then cultured in MSC-CM as treatment group after being activated by OKT3.Each lymphoid subgroup proportion was analyzed by flow cytometry to observe the difference between treatment and control group.The effect ofMSC-CM on activated PBMC for the production of IFN-γ and IL-10 were tested by ELISA.The level of apoptosis was assessed by flow cytometrywith Annexin-V/PIas fluorescentmarker.Results:Compared with the controlgroup,MSC-CM down-regulated the ratio of CD4+T cell to CD8+T cell,and increased the proportion of CD4+CD25+CD127lowTreg cell,thus other subgroup had no significantdifference.MSC-CM inhibited the production of IFN-γ by PBMC,but promoted the secretion of IL-10,and protected PBMCs from apoptosiswhen activated with OKT3.Conclusion:hUC-MSCmay play a role of immunosuppression by promoting the proliferation and activation of Treg cell.This kind of inhibitory activity is neither relied director indirect contactwith the lymphocytes,nor influenced by inducing immune cells apoptosis.
Human umbilical cord-derived mesenchymal stem cells;Regulatory T cells;Immunomodulation
10.3969/j.issn.1000-484X.2014.05.001
①本文受国家“重大新药创制”科技重大专项(2009ZX09103-708)、国家自然科学基金(31100664,31300737,81303292)和广东省自然科学基金(S2012040007958)资助。
②并列第一作者。
陈 璇(1988年-),女,主要从事肿瘤免疫治疗研究,E-mail:cissy09.angel@163.com。
及指导教师:黄树林(1953年-),男,教授,博士生导师,主要从事肿瘤免疫治疗方面的研究,E-mail:shulhuang@sina.com。
R392.9
A
1000-484X(2014)05-0577-05
