内蒙古奶豆腐中潜在益生性乳酸菌的筛选
2014-01-30顾芸佳马文慧杨贞耐
王 辑,顾芸佳,马文慧,杨贞耐,*
(1.北京工商大学 食品质量与安全北京实验室,北京 100048;2.吉林大学生物与农业工程学院,吉林 长春 130025)
益生菌是一类活性微生物,摄取一定量时,会对宿主产生确切健康功效从而改善宿主微生态平衡,发挥益生作用[1]。常见的益生菌主要包括乳杆菌(Lactobacillus)和双歧杆菌(Bifidobacterium)[2]。据报道,益生菌具有调节肠道菌群结构、降低胆固醇、抗氧化、预防癌症、抑制病原菌、缓解乳糖不耐症、增强人体免疫力、缓解过敏和抑制肿瘤生长 等生理功能[3-5]。另外,益生菌的添加还可以改善发酵乳制品的质构,形成独特的风味[6]。益生菌要想在人体内发挥功能特性,前提必须保证其在胃液的酸性环境、小肠中 的胆汁盐环境以及厌氧环境中存活下来,同时还要对 肠道细胞具有一定的黏附性。因此,在益生菌的筛选过程中,菌株的胃液耐受性、胆盐耐受性及细胞表面疏水性是必不可少的重要评定指标。
我国传统发酵乳制品资源丰富,具有制作简便、贮存时间较长、营养价值丰富及风味纯正等特点。此外,传统发酵乳制品中还具有丰富的乳酸菌资源。截止到目前,已有部分乳酸菌被分离出来,经研究发现这些菌株是安全可靠的,且具有潜在的益生性及功能特性。Li Shengyu等[7]从内蒙古奶豆腐中分离出一株产胞外多糖L.plantarum C88,研究发现该菌株具有良好的体 外抗氧化活性。张和平等[8]从新疆马奶酒中分离得到1株L.casei Zhang,研究表明该菌株具有降胆固醇、免疫调节及抑制病原菌等生理功能。Wang Yanping[9]和Zhang Li[10]等分别从西藏灵菇中分离出1株L.plantarum MA2和L.plantarum K25,通过体内实验发现2株菌均具有降低小鼠体内胆固醇的能力。崔文明等[11]从传统乳制品中分离得到1株自溶活性较强的保加利亚乳杆 菌LJJ。Bao Yan等[12]对从传统乳制品中分离出到的90株发酵乳杆菌的耐酸性、胃液耐受性、胆盐耐受性及抑菌活性进行了研究,指出发酵乳杆菌F6的益生性最好,具有潜在的应用价值。
本研究主要通过对内蒙古奶豆腐源乳酸菌菌株的模拟人工胃液耐受性、胆盐耐受性、疏水性、体外降胆固醇及抗氧化活性进行测定,着力于筛选出具有潜在益生特性的优良菌株,为今后开发新型功能性益生菌制品奠定基础。
1 材料与方法
1.1 材料与试剂
内蒙古各地区牧民自制的奶豆腐。
牛胆盐、胆固醇、胃蛋白酶、1,1-二苯基-2-三硝基苯 肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 美国Sigma公司;邻苯二甲醛、氢氧化钾 国药集团化学试剂有限公司;正己烷、冰醋酸、浓硫酸 北京化工厂;亮绿 上海捷瑞生物工程有限公司;溶菌酶 中国医科院友谊开发公司;蛋白酶K 美国Amresco公司;PCR反应所需相关试剂 北京鼎国生物有限公司;乳酸菌16S rDNA通用引物 中国农业大学提供。
1.2 仪器与设备
U-3900紫外-可见分光光度计 日本日立公司;BX53F正置荧光显微镜 日本奥林巴斯公司;T100TM Thermal Cycler PCR仪 美国Bio-Rad公司;MTN-2800W氮吹仪 北京华瑞博远科技发展有限公司;JY92-ⅡDN超声波细胞粉碎机 宁波新芝生物科技股份有限公司。
1.3 培养基
MRS液体培养基(g/L):大豆蛋白胨1 0.0、牛肉膏 10.0、酵母粉5.0、葡萄糖20.0、吐温-80 1.0、磷酸氢二钾2.0、乙酸钠5.0、柠檬酸钠5.0、硫酸镁0.2、硫酸锰0.054,蒸馏水1 000 mL,1 mol/L乙酸调pH值为6.5,121℃灭菌15 min。
MRS-THIO液体培养基:向100 mL MRS培养基中加入0.2 g 巯基乙酸钠,待充分溶解后,用1 mol/L乙酸调pH值为6.5,121℃灭菌15 min。
1.4 方法
1.4.1 菌株的分离纯化
称取1 g内蒙古奶豆腐样品,加入99 mL pH 6.5无菌磷酸盐缓冲液(phosphat buffered saline,PBS)中,充分振荡混匀后,稀释到10-4、10-5,取100 μL稀释液涂布于MRS琼脂平板上,置于37℃厌氧培养24~72 h,挑取典型单菌落,划线分离纯化。对分离所得的菌株进行革兰氏染色和过氧化氢酶实验。
1.4.2 菌株的16S rDNA分子鉴定
提取菌株的基因组DNA进行片段扩增:采用乳酸菌16S rDNA基因的通用引物,正向引物:A27F:5’-AGC GGATCACTTCACACAGGACTACGGCTACCTTGTTAC GA-3’,反向引物:A1495R:3’-GCAGAGTTCTCGGA GTCACGAAGAGTTTGATCCTGGCTCAG-5’,1.5%琼脂糖凝胶电泳,目标片段长度约1 500 bp。聚合酶链式反应(polymerase chain reaction,PCR)产物委托北京鼎国生物有限公司进行测序,将测序结果与国家生物技术信息中心(National Center for Biotechnology Info rmation,NCBI)数据库中的核酸序列进行比对。
1.4.3 菌株在模拟人工胃液中的耐受性测定
取活化好的菌液,4℃、6 000×g离心10 min,收集菌体。用无菌PBS缓冲液(pH6.5)洗涤2次,加入5 mL PBS缓冲液(pH 6.5)制成菌悬液。取1 mL菌悬液接入含9 mL pH 3.0的模拟人工胃液(0.2 g/100 mL NaCl,0.35 g/100 mL胃蛋白酶,过滤除菌)试管中,置于37℃厌氧培养。分别于接种后0 h和3 h取样,稀释涂布于MRS琼脂平板上,37℃厌氧培养48 h后,进行活菌计数[13]。菌株存活率计算见公式(1)[14]。

式中:N1为胃液处理3 h后活菌数(lg(CFU/mL));N0为胃液处理0 h活菌数(lg(CFU/mL))。
1.4.4 菌株对高质量浓度胆盐的耐受性测定
将活化好的菌株按3%(V/V)接种量分别接种于含有0.3、0.5、1.0 g/100 mL胆盐的MRS液体培养基中,37℃厌氧培养24 h,测定各培养基在560 nm波长处的吸光度(A560nm),以不添加胆盐的培养基为对照,测定菌株的存活情况。
1.4.5 菌株的疏水性测定
取活化好的菌液,4℃、6 000×g离心10 min,收集菌体,用无菌的PBS缓冲液(pH6.5)洗涤2次。缓冲液作空白对照,用缓冲液调整菌体浓度,使其A560nm值为1.00。取3 mL调整后的菌液,分别加入0.6 mL的甲苯和十六烷,涡旋振荡,静置分层后,取下层水相,缓冲液作空白对照,在560 nm波长处测吸光度[15]。疏水率计算见公式(2)。

式中:A0为菌液与吸附剂混匀前的吸光度;A1为菌液与吸附剂混匀后的吸光度。
1.4.6 菌株的体外降胆固醇能力测定
将活化好的菌株按3%接种量分别接种于含0.01 g/100 mL胆固醇的MRS-THIO液体培养基中,37℃培养24 h,4℃、6 000×g离心10 min,收集上清。采用邻苯二甲醛比色法测定上清液中胆固醇含量[13],并计算菌株的胆固醇降解率,见公式(3)。
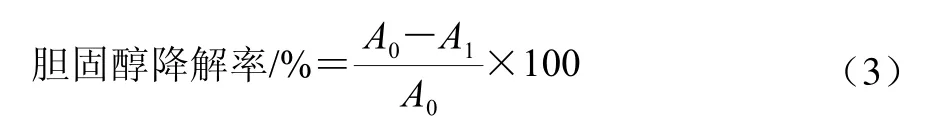
式中:A0为未接菌的高胆固醇培养基在550 mm波长处的吸光度;A1为发酵上清液在550 mm波长处的吸光度。
1.4.7 菌株的体外抗氧化活性测定
1.4.7.1 无细胞提取液的制备
将活化好的菌株按3%接种量接种于MRS液体培养基,37℃培养16 h,4℃、6 000×g离心10 min,收集菌体,无菌PBS缓冲液(pH 6.5)洗涤3次,重悬于PBS中,调整菌液浓度至108、109、1010CFU/mL。向各浓度菌液中添加溶菌酶至质量浓度0.1 g/100 mL,37℃恒温水浴30 min,冰浴超声破碎菌体细胞(超声波功率800 W,超声波每次辐射2 s,间隔2 s,总时间15 min)至显微镜下观察无完整菌体,4℃、8 000×g离心10 min,收集上清液即为无细胞提取液,4℃保存备用。
主要采用BA楼控控制的方式,通过硬接点的形式接入DDC模块实现,要了解风机盘管控制原理。风机盘管的电气设计情况(见图2)不同于通常的动力设备,风机盘管的功率较小,一般不单独设置控制箱,电气设计类似照明设计,单独设置回路,且同时并接多个风机盘管设备,设置的数量与回路功率有关,只要保持功率在合理范围内即可。
1.4.7.2 菌株对过氧化氢的耐受性测定
将活化好的菌株按1%接种量接种于含不同浓度(0、0.4、0.7、1.0 mmol/L)过氧化氢的MRS液体培养基中,37℃培养8 h,4℃、6 000×g离心10 min,收集菌体,无菌PBS缓冲液(pH6.5)洗涤3次,重悬于PBS中,于600 nm波长处测定其吸光度。
1.4.7.3 菌株清除羟自由基(•OH)能力的测定
采用Fenton法测定菌株对•OH的清除作用[15]。Fenton反应体系:0.435 mmol/L的亮绿1 mL,0.5 mmol/L的硫酸亚铁2 mL,3 g/100 mL的过氧化氢1.5 mL。向Fenton反应体系中加入1 mL不同浓度菌株(108、109、1010CFU/mL)的无细胞提取液,混合均匀后,37℃恒温水浴20 min,4℃、8 000×g离心10 min,取上清液,于624 nm波长处测吸光度。•OH清除率计算见公式(4)。

式中:A为无Fenton试剂、无样品、有亮绿的吸光度;A0为有Fenton试剂、无样品、有亮绿的吸光度;As为有Fenton试剂、有样品、有亮绿的吸光度。
1.4.7.4 菌株清除DPPH自由基能 力的测定
取1 mL不同浓度的菌液(109、1010CFU/mL)加入2 mL DPPH甲醇溶液(0.5 mmol/L),混合均匀后室温下避光反应30 min,4℃、8 000×g离心10 min,取上清液,于517 nm波长处测吸光度,无菌水空白调零。空白组以等体积甲醇代替DPPH溶液,对照组以等体积无菌水代替菌液[16]。DPPH自由基清除率计算见公式(5)。
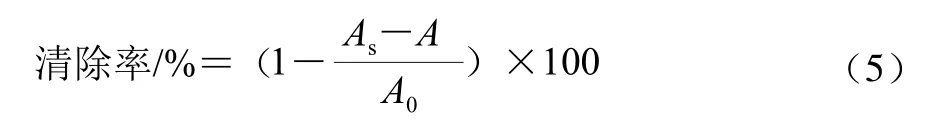
式中:A为空白组的吸光度;A0为对照组的吸光度;As为样品组的吸光度。
1.5 数据分析
2 结果与分析
2.1 菌株的分离纯化
从内蒙古奶豆腐中共分离得到16株革兰氏染色阳性、过氧化氢酶阴性的菌株。其中杆菌2株,球菌14株。
2.2 菌株16S rDNA分子鉴定

图1 菌株的16S rDNA PCR扩增结果Fig.1 Electrophoregram of 16S rDNA amplification products of the strains
对提取菌株的总DNA进行PCR扩增,结果如图1所示,扩增出16 条特异的、大小约为1 500 bp的条带。获得的特异性片段纯化后进行测序,将测序结果用BL AST进行序列同源性比对,根据比对结果可鉴定菌株到属。其中5株菌鉴定为屎肠球菌,分别是菌株M1-1、M6-2、M7-1、M8-1和M8-2;9株鉴定为乳酸片球菌,分别是菌株M1-3、M2-1、M2-2、M3-1、M4-1、M4-2、M5-1、M5-2和M5-3;1株鉴定为植物乳杆菌(M1-2);1株鉴定为鼠李糖乳杆菌(M6-1),结果见表1。

表1 菌株鉴定结果Table1 Identification of screened strains
2.3 菌株在模拟人工胃液中的耐受性

图2 菌株在模拟人工胃液中的耐受性Fig.2 The tolerance of the strains to simulated artificial gastric juice
由图2可知,16株菌表现出不同程度的模拟人工胃液耐受性。L.plantarum M1-2、L.rhamnosus M6-1、E.faecium M1-1和M6-2耐受性较好,在pH 3.0模拟人工胃液中培养3 h后的存活率均超过了80%,其中E.faecium M6-2的耐受性最高,存活率达到了96.90%。有10株菌的耐受性一般,存活率在60%~80%之间。而P.acidilactici M3-1和M5-3的耐受性较差,存活率仅为36.09%和49.81%。
2.4 菌株对高质量浓度胆盐的耐受性
小肠是人体吸收胆固醇的重要场所,同时也是乳酸菌发挥其降胆固醇作用的主要部位。正常人体小肠中胆汁盐质量浓度在0.03~0.3 g/100 mL范围内波动,乳酸菌若要定殖于小肠,就必须有一定的胆汁 盐耐受的能力。从表2可以看出,随着胆盐质量浓度的升高,各菌株的生长受到不同程度的抑制,各菌株在相同胆盐质量浓度下的生长情况存在显著差异。其中E.faecium M7-1、M8-1和M8-2对胆盐的耐受性较高,而其他菌株对胆盐的耐受性较弱。

表2 不同胆盐质量浓度下菌株的生长情况(以A56600 nnmm值表示)Table2 Tolerance of the strains to different concentrations of bile salts(represented by A560 nm)
2.5 菌株的疏水性
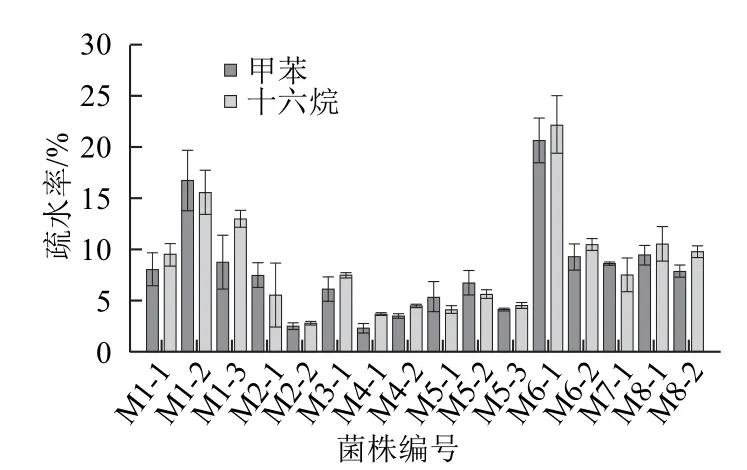
图3 菌株的疏水性比较Fig.3 Comparison of the hydrophobicity of the strains
由图3可知,在以甲苯和十六烷为吸附剂时,L.rhamnosus M6-1的疏水性最高,对甲苯和十六烷的疏水率分别为20.60%和22.15%,L.plantarum M1-2的疏水性较好,对甲苯和十六烷的疏水率分别为16.73%和15.58%,而其他菌株的疏水性较弱。
2.6 菌株的体外降胆固醇能力
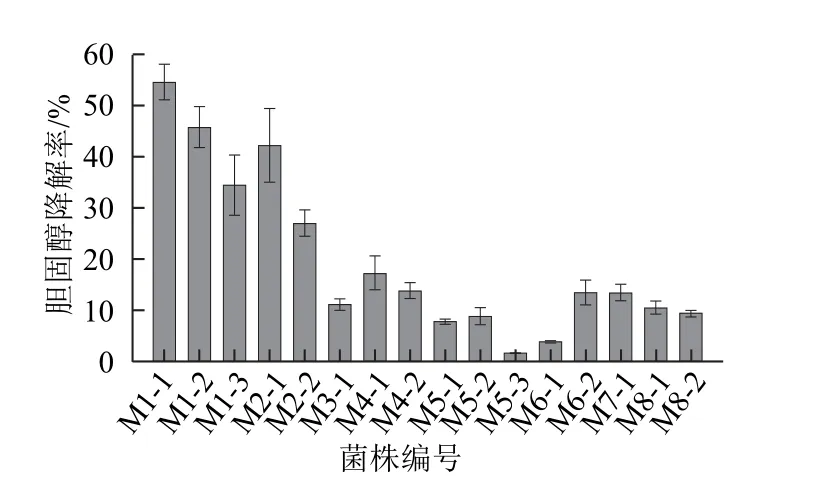
图4 菌株的体外降胆固醇能力比较Fig.4 Comparison of the in vitro cholesterol-reducing ability of the strains
由图4可知,大部分菌株均有相应降低胆固醇的能力,但其能力大小因菌株的不同有所差异。其中E.faecium M1-1、L.plantarum M1-2、P.acidilactici M1-3和M2-1的体外降胆固醇能力较高,胆固醇降解率分别为54.44%、45.56%、34.44%和42.01%。而其他菌株的降解率除了P.acidilactici M2-2为26.89%以外,均在20%以下。
2.7 菌株的体外抗氧化活性
过氧化氢作为•OH的前体参与氧化过程,是衡量菌体抗氧化活性的一个重要指标。因此,本实验通过分析菌株对过氧化氢的耐受情况,筛选具有抗氧化作用的益生菌株。受试16株菌在不同浓度过氧化氢中的生长状况(以A600nm值表示)如表3所示,菌株对过氧化氢的耐受呈浓度依赖关系,多数菌株对低浓度过氧化氢(0.4 mmol/L)具有较强的耐受能力,37℃培养8 h后,A600nm大于1.0,而对高浓度过氧化氢(1 mmol/L)耐受能力较弱。其中L.plantarum M2-1、L.rhamnosus M6-1和E.faecium M8-2相比于其他菌株,对高浓度过氧化氢(1 mmol/L)的耐受性较强。

表3 不同过氧化氢浓度下菌株的生长情况(以A60000 nnmm值表示)Table3 Tolerance of the strains to different concentrations of hydrogen peroxide (represented by A60000 nnmm))
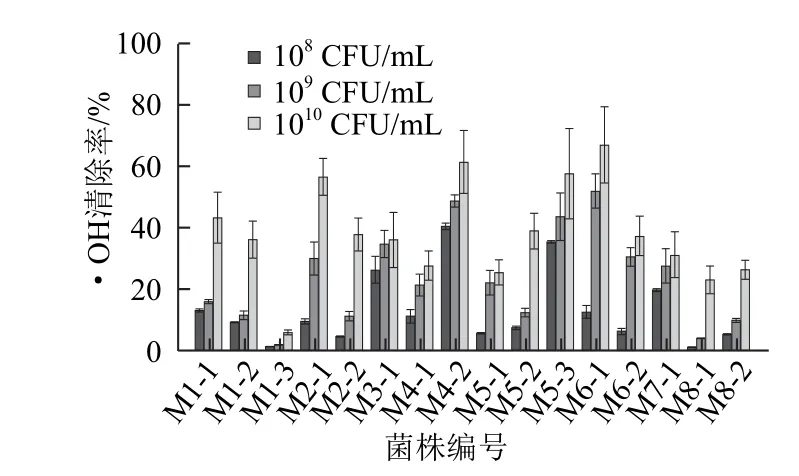
图5 菌株对•OH的清除能力比较Fig.5 Comparison of the strains for scavenging activities on hydroxyl radicals
由图5可知,不同菌株的•OH清除能力差异显著,且菌株的清除能力呈浓度依赖关系,随无细胞提取液浓度的增加,•OH的清除能力不断提高。在受试的16株菌中,L.rhamnosus M6-1在1010CFU/mL时对•OH的清除能力最高,清除率为66.87%。此外,P.acidilactici M2-1、M4-2和 M5-3也表现出较高的•OH清除能力,在1010CFU/mL时对•OH的清除率均在50%以上。

图6 菌株对DPPH自由基的清除能力比较Fig.6 Comparison of the strains for scave nging effects on DPPH free radicals
DPPH是一种稳定的有机自由基,当有自由基清除剂存在时,由于与其单电子配对颜色减退,从而检测自由基清除情况及物 质的抗氧化能力。由图6可知,16株菌对DPPH自由基的清除能力差异不明显。其中L.rhamnosus M1-2对DPPH自由基的清除能力最高,清除率为55.58%,而其他菌株的清除率也均在40%以上。此外,菌株 对DPPH自由基的清除能力与菌液浓度呈依赖关系,随菌液浓度的增加,DPPH自由基的清除能力不断提高。
3 讨 论
奶豆腐是我国蒙古族家庭经常食用的传统发酵乳制品,它是用生奶自然发酵,至乳清与乳酪分离后煮沸而制成[17]。奶豆腐中含有大量的乳酸菌,从中筛选具有潜在益生特性的菌株已成为目前国内研究的热点。本研究从内蒙古奶豆腐中分离得到16株疑似菌株,经革兰氏染色、过氧化氢酶及16S rDNA鉴定,5株为屎肠球菌,9株为乳酸片球菌,植物乳杆菌和鼠李糖乳杆菌各1株。周雨霞[18]对内蒙古地区传统发酵乳制品中乳酸菌进行了分离鉴定,认为植物乳杆菌是该地区乳制品中的优势菌株。旭日花[19]也做了相似的研究,结果发现植物乳杆菌和乳酸乳球菌乳酸亚种是该地区乳制品中的优势菌株。而本研究分离得到的16株菌中,乳酸片球菌占了56.3%,为优势菌群。
益生菌在人体内发挥益生特性的前提条件是保证其在胃液的酸性环境、肠道的胆盐环境和厌氧环境中存活下来。人体空腹时胃液pH值一般在1.3~1.8之间,进食后上升到3.0左右或更高,食物在胃中停留约3 h。正常人体小肠中胆汁盐质量浓度在0.03~0.3 g/100 mL范围内波动。本研究中,除了乳酸片球菌M3-1和M5-3以外,其余菌株均表现出较好的模拟人工胃液耐受性,在pH3.0的模拟人工胃液中培养3 h后,存活率均达到60%以上。在胆盐耐受实验中,屎肠球菌M7-1、M8-1和M8-2对胆盐的耐受性较高,而其他菌株对胆盐的耐受性较弱。
益生菌的筛选要求除了要具有耐受胃肠液的环境,还要对肠道上皮细胞具有一定的黏附性,保证其在微环境中成为优势菌株,有利于益生特性的发挥。有研究[20]表明,菌株的黏附性与疏水性呈正相关,疏水性高有利于菌株定殖于肠道内。本研究中筛选得到2株疏水性较好的菌株,分别为鼠李糖乳杆菌M6-1和植物乳杆菌M1-2。Zago等[21]研究发现多数植物乳杆菌具有良好的细胞表明疏水性。Tuo Yanfeng等[22]研究发现鼠李糖乳杆菌对HT-29细胞具有较高的黏附性。
本研究通过在培养基中添加胆固醇(0.01 g/100 mL),采用邻苯二甲醛比色法测定培养基中胆固醇质量浓度变化来评价菌株的体外降胆固醇能力。结果筛选出4株具有较高体外降胆固醇能力的菌株(屎肠球菌M1-1、植物乳杆菌M1-2、乳酸片球菌M1-3和M2-1),胆固醇降解率均超过了30%。目前,有关乳酸菌的降胆固醇机理大致可分为3种:1)乳酸菌的胆盐水解酶活性使胆盐由结合态转变为脱结合态,与胆固醇发生共沉淀[23];2)乳酸菌对胆固醇的直接吸附、吸收同化[24];3)其他机理。关于乳酸菌的降胆固醇机理之所以尚无定论,主要是因为研究中所采用的胆盐种类和添加量,胆固醇的种类和添加量,菌种自身的特性(耐酸、耐胆盐、降胆固醇机制),喂养的饲料、实验动物以及饲喂时间不同有关。
从表2菌株对胆盐的耐受性结果可知,屎肠球菌M1-1、植物乳杆菌M1-2、乳酸片球菌M1-3和M2-1虽然具有较强的体外降胆固醇能力,但是这4株菌对胆盐的耐受性均较弱。对于功能性较好而耐受性较弱的菌株,宜对菌株进行保护,如采用微胶囊化技术处理菌体,可以有效地保护菌体免受外界不良环境的影响,从而使其以活菌的形式到达人体肠道内,发挥其益生功能。Chávarri等[25]利用海藻酸和壳聚糖将格氏乳杆菌和双歧杆菌进行微胶囊化,结果发现2株菌在模拟胃肠液中均表现出良好的存活能力。Brinques等[26]研究发现利用微胶囊技术可提高乳杆菌在酸奶冷藏期间的存活能力。许女等[27]研究发现微胶囊化的植物乳杆菌MA2的耐热性和恒温储存性能都显著高于未微胶囊化的菌体。
抗氧化活性是益生菌非常重要的生理功能指标。研究表明,益生菌主要是通过耐受一定浓度O2或H2O2、清除机 体内有害自由基(DPPH自由基、•OH和超氧阴离子自由基)、抗脂质过氧化及产生抗氧化物质(超氧化物歧化酶、谷胱甘肽过氧化氢酶及过氧化氢酶)等作用发挥其抗氧化活性[28]。本研究主要通过对菌株的过氧化氢耐受性、•OH和DPPH自由基的清除能力,来评价其体外抗氧化活性。结果筛选出1株具有较强体外抗氧化活性的菌株,为鼠李糖乳杆菌M6-1。此外,本研究还发现菌株的体外抗氧化活性与菌液浓度呈依赖关系,随菌液浓度的增加,•OH和DPPH自由基的清除能力不断提高。
4 结 论
本研究从内蒙古奶豆腐中分离得到16株菌,其中9株鉴定为乳酸片球菌、5株为屎肠球菌、1株为植物乳杆菌、1株为鼠李糖乳杆菌。对这些菌株进行模拟人工胃液和胆盐耐受性、疏水性、体外降胆固醇及抗氧化活性测定的结果表明:菌株对模拟人工胃液和胆盐具有不同程度的耐受性,对甲苯和十六烷具有不同的疏水性;肠球菌M1-1、植物乳杆菌M1-2、乳酸片球菌M1-3和M2-1的体外胆固醇降解率均超过30%;鼠李糖乳杆菌M6-1对过氧化氢的耐受性、•OH和DPPH自由基的清除能力最高。综上所述,植物乳杆菌M1-2和鼠李糖乳杆菌M6-1具有较好的益生特性,可作为今后开发功能性产品的潜在益生菌资源。
[1]GUARNER F, SCHAAFSMA G J.Probiotics[J].International Journal of Food Microbiology, 1998, 39(3): 237-238.
[2]PIANO M D, MORELLI L, STROZZI G P, et al.Probiotics: from research to consumer[J].Digestive and Liver Disease, 2006, 38(Suppl 2): 248-255.
[3]FAO/WHO.Evaluation of health and nutritional properties of probiotics in food including powder milk with live lactic acid bacteria[C]//Cordoba, Argentina: Expert consultation report, 2001.
[4]LI Jinjie, ZHANG Wen, WANG Chuan, et al.Lactococcus lactis expressing food-grade β-galactosidase alleviates lactose intolerance symptoms in post-weaning BALB/c mice[J].Applied Microbiology and Biotechnology, 2012, 96(6): 1499-1506.
[5]ELMER G W, MARTIN S W, HORNER K L, et al.Survival of Saccharomyces boulardii in the rat gastrointestinal tract and effects of dietary fiber[J].Microbial Ecology in Health and Disease, 1999, 11(1):29-34.
[6]郭壮, 王记成, 闫丽雅, 等.益生菌Lactobacillus casei Zhang对酸奶风味、质地及感官特性的影响[J].中国乳品工业, 2009, 37(1): 14-20.
[7]LI Shengyu, ZHAO Yujuan, ZHANG Li, et al.Antioxidant activity of Lactobacillus plantarum strains isolated from traditional Chinese fermented foods[J].Food Chemistry, 2012, 135(3): 1914-1919.
[8]张和平, 孟和毕力格, 王俊国, 等.分离自内蒙古传统发酵酸马奶中L.casei Zhang潜在益生特性的研究[J].中国乳品工业, 2006, 34(4): 4-10.
[9]WANG Yanping, XU Nü, XI Aodeng, et al.Effects of Lactobacillus plantarum MA2 isolated from Tibet kefir on lipid metabolism and intestinal microflora of rats fed on high-cholesterol diet[J].Applied Microbiology and Biotechnology, 2009, 84(2): 341-347.
[10]ZHANG Li, ZHANG Xue, LIU Chunhong, et al.Manufacture of Cheddar cheese using probiotic Lactobacillus plantarum K25 and its cholesterol-lowering effects in a mice model[J].World Journal of Microbiology and Biotechnology, 2013, 29(1): 127-135.
[11]崔文明, 刘鹭, 张书文, 等.简并引物法克隆保加利亚乳杆菌β-N-乙酰氨基己糖苷酶基因[J].食品科学技术学报, 2013(1): 33-37.
[12]BAO Yan, ZHANG Yanchao, ZHANG Yong, et al.Screening of potential probiotic properties of Lactobacillus fermentum isolated from traditional dairy products[J].Food Control, 2010, 21(5): 695-701.
[13]VINDEROLA C G, REINHEIMER J A.Lactic acid starter and probiotic bacteria: a comparative “in vitro” study of probiotic characteristics and biological barrier resistance[J].Food Research International, 2003, 36(9/10): 895-904.
[14]GUO Zhuang, WANG Jicheng, YAN Liya, et al.in vitro comparison of probiotic properties of Lactobacillus casei Zhang, a potential new probiotic, with selected probiotic strains[J].LWT-Food Science and Technology, 2009, 42(10): 1640-1646.
[15]WANG Y C, YU R C, CHOU C C.Antioxidative activities of soymilks fermented with lactic acid bacteria and bifidobacteria[J].Food Microbiology, 2006, 23(2): 128-135.
[16]KAO T H, CHEN B H.Functional components in soybean cake and their effects on antioxidant activity[J].Journal of Agricultural and Food Chemistry, 2006, 54(20): 7544-7555.
[17]赵红霞.蒙古族奶皮子和奶豆腐的工艺研究及营养价值分析[J].乳品加工, 2008(4): 40-42.
[18]周雨霞.内蒙古牧区传统乳制品中乳杆菌生物学特性及其益生作用的研究[D].呼和浩特: 内蒙古农业大学, 2005.
[19]旭日花.通辽市牧区乳制品中乳酸菌的分离鉴定及发酵特性和保藏性的研究[D].呼和浩特: 内蒙古农业大学, 2006.
[20]赵维俊, 吕嘉枥, 马强, 等.嗜酸乳杆菌的表面疏水性分析[J].乳品工业, 2011, 39(10): 8-11.
[21]ZAGO M, FORNASARI M E, CARMINATI D, et al.Characterization and probiotic potential of Lactobacillus plantarum strains isolated from cheese[J].Food Microbiology, 2011, 28(5): 1033-1040.
[22]TUO Yanfeng, ZHANG Weiqin, ZHANG Lanwei, et al.Study of probiotic potential of four wild Lactobacillus rhamnosus strains[J].Anaerobe, 2013, 21: 22-27.
[23]KIMOTO H, OHMOMO S, OKAMOTO T.Cholesterol removal from media by lactococci[J].Journal of Dairy Science, 2002, 85(12): 3182-3188.
[24]BRASHEARS M M, GILLILAND S E, BUCK L M.Bile salt deconjugation and cholesterol removal from media by Lactobacillus casei[J].Journal of Dairy Science, 1998, 81(8): 2103-2110.
[25]CHÁVARRI M, MARAÑÓN I, ARES R, et al.Microencapsulation of a probiotic and prebiotic in alginate-chitosan capsules improves survival in simulated gastro-intestinal conditions[J].International Journal of Food Microbiology, 2010, 142(1/2): 185-189.
[26]BRINQUES G B, AYUB M A Z.Effect of microencapsulation on survival of Lactobacillus plantarum in simulated gastrointestinal conditions, refrigeration, and yogurt[J].Journal of Food Engineering,2011, 103(2): 123-128.
[27]许女, 王艳萍, 习傲登, 等.植物乳杆菌MA2微胶囊化的研究[J].食品科技, 2011, 36(10): 17-22.
[28]王豪, 郭本恒, 王荫榆, 等.益生菌潜在的抗衰老作用[J].中国微生态学杂志, 2009, 21(4): 37-39.
