地皮菜中一种新型水应激蛋白基因的克隆表达及其抗人结肠癌细胞SW480的作用
2014-01-30郭松佳单树花晋小婷李宗伟李卓玉
郭松佳,单树花,晋小婷,李宗伟,宋 莉,李卓玉,*
(1.化学生物学与分子工程教育部重点实验室,山西大学生物技术研究所,山西 太原 030006;2.山西医科大学汾阳学院医学检验系,山西 汾阳 032200;3.太原师范学院生物系,山西 太原 030031)
肿瘤是严重危害人类健康的恶性疾病,抗肿瘤药物的效果及安全性一直受到人们的广泛关注,从天然产物中寻找活性成分已成为当今抗肿瘤药物的发展战略之一[1]。如白藜芦醇对激素依赖性肿瘤有明显的预防及治疗作用,并已经进入临床试验阶段[2-3];黄酮类化合物可以诱导肿瘤细胞的凋亡,并具有干预细胞信号转导和增强抑癌基因活性等功效[4-5]。由此可见,天然产物活性成分的开发对于肿瘤的预防及治疗意义重大。
地皮菜,学名普通念珠藻(Nostoc commune Vauch.),为蓝藻科念珠藻属的片状藻类,在全球范围内均可生长[6]。地皮菜是一种营养极高的保健野菜[7],其中很多营养成分都参与了人体的正常新陈代谢和生理机能。Briones等[8]研究表明,地皮菜中蛋白质的含量可以达到干质量的22.8%~28.7%。此外,它还含有特殊的活性成分,如蓝藻蛋白、多糖等[9-11]。本实验前期研究发现地皮菜中的活性蛋白可以有效抑制结肠癌细胞的增殖,经分离纯化及质谱鉴定其为水应激蛋白。在组织缺水的情况下[12-14],普通念珠藻类合成水应激蛋白,具有抵御干旱、维持组织结构稳定的功能[15-16]。关于该蛋白的其他功能,尤其是抗肿瘤的功能,目前国内外尚未有报道。
根据已获得的前期数据,利用基因工程重组技术,从地皮菜中得到一种新型水应激蛋白(recombinant water stress protein 1,Re-WSP1),并将该蛋白的基因序列公布于GenBank, 其序列号为KF 003026。将该基因克隆到原核表达系统中,获得了高效表达工程菌,经亲和纯化获得Re-WSP1。体外实验结果显示,该蛋白对结肠癌细胞SW480的生长具有明显的抑制作用,与从天然产物中获得的水应激蛋白具有同样功能。因此,新型水应激蛋白的研究可以为抗癌功能食品或药物中间体的开发利用提供新的思路。
1 材料与方法
1.1 菌株、质粒与细胞株
E.coli DH5α、E.coli BL21、质粒pET28a、人结肠癌细胞系SW480,人结肠正常上皮细胞FHC均为本实验室保存。
1.2 试剂与仪器
RNA提取试剂Trizol、DNA Marker 大连宝生物公司;噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT) 北京索莱宝科技有限公司;质粒抽提试剂盒 Omega公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulfate polyacrylamide gel electrophoresis,SDS-PAGE)试剂 普利莱公司;蛋白Marker Ferment公司;核酸工具酶 日本TaKaRa公司;异丙基硫代-β-D-半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)、Ni-NTA resin 生工生物工程(上海)股份有限公司;Caspase 3、Caspase 8多克隆抗体 Bioworld Technology公司;BSA蛋白浓度测定试剂盒及蛋白裂解液 碧云天生物技术研究所;胶片 柯达公司;RPMI-1640、DMEM培养基美国Hyclone公司;胎牛血清 武汉博士德公司;其他无机盐均为进口或国内分析纯。
Infinite F50酶标仪 瑞士Tecan公司;Gene genius凝胶成像分析系统 英国Syngene公司;Mastercycler personnal PCR扩增仪 德国Eppendorf公司。
1.3 方法
1.3.1 地皮菜中cDNA的提取
将地皮菜组织在液氮中磨成粉末,加入Trizol液研磨。每毫升Trizol液加入0.2 mL氯仿,盖紧离心管,用手剧烈摇荡离心管15 s。取上清液于一新离心管,每毫升上清液加0.5 mL异丙醇的比例加入异丙醇,室温放置10 min,12 000×g离心10 min。弃去上清液,按每毫升Trizol液加入至少1 mL的比例加入75%乙醇,涡旋混匀,4℃条件下7 500×g离心5 min。小心弃去上清液,室温或真空干燥10 min,然后将RNA 用DEPC水溶解沉淀后,于-80℃保存。吸取1 mL ddH2O到EP管中,加入2 μL地皮菜总RNA溶液,充分混匀,在Thermo Nanodrop 2000上测定260、280 nm波长处的吸光度,然后计算RNA的质量浓度,并分析其纯度。在DEPC处理过的EP管中加入约4 μg总RNA和1 μL的Oligo(dT)18primer(0.5 μg/μL),小心混匀,70℃条件下保温5 min,立即浸入冰水中。按次序分别加入下列试剂:5 μL 5×M-MLV RT Buffer、2 μL dNTP mix(2.5 mmol/L)、1 μL RNase抑制剂 (30 U/μL),1 μL M-MLV Reverse Transcriptase,然后加DEPC水到25 μL。小心混匀,室温离心5 s,将所有溶液收集到管底,37℃条件下保温1 h;90℃条件下处理5 min,冰上冷却,用于聚合酶链式反应(polymerase chain reaction,PCR)扩增。
1.3.2 地皮菜水应激蛋白表达质粒的构建
利用P C R技术,并在W S P的N端添加6个组氨酸的His标签设计引物,上游引物引入BamHⅠ限制性酶切位点,下游引物引入XhoⅠ限制性酶切位点,引物设计如下,上游引物:5’-CGCGGATCC ATGGCTCTTTACGGCT-3’(BamHⅠ),下游引物:5’-CCGCTCGAG TTATTCATTAACAATCGT- 3’(XhoⅠ),引物由TaKaRa公司合成。以地皮菜cDNA为模板,扩增WSP基因片段,PCR反应条件如下:95℃预变性3 min,95℃变性1 min,60℃ 1 min,72℃ 1 min,30个循环,72℃延伸10 min。PCR产物送生工生物工程(上海)股份有限公司进行DNA序列测定,并和表达载体pET28a分别经BamHⅠ和XhoⅠ双酶切,酶切后回收的WSP DNA和pET28a按物质的量比3∶1的比例混合,用T4 DNA Ligase 37℃连接2 h,转化到DH5α感受态细菌中,铺在含有卡那霉素的琼脂平板上倒置于37℃培养箱中培养12~18 h,挑取颗粒饱满的单克隆菌落至5 mL LB培养基,37℃条件下220 r/min振荡培养过夜,然后进行菌液PCR和酶切鉴定。
1.3.3 WSP的基因序列测定及其表达
扩增、提取转化子质粒送生工生物工程(上海)股份有限公司进行测序。PCR产物及转化子质粒测序结果显示100%相同,通过序列同源性比对和蛋白保守序列分析,鉴定为一种新的水应激蛋白基因序列,该蛋白的基因序列已经发表于GenBank,序列号为:KF003026。将测序鉴定后的WSP-pET28a表达载体转化至BL21感受态细菌中,挑取单克隆菌落接种到含有卡那霉素的LB培养基中,37℃、220 r/min振荡培养过夜,将过夜培养的原核表达菌按照体积比1∶100的接种到含有卡那霉素的400 mL LB培养基中,30℃、220 r/min振荡培养,在600 nm波长处测定溶液的吸光度A600nm至0.5时,加入终浓度为1 mmol/L的IPTG,同时设不添加IPTG的对照组,诱导表达4 h,于4℃、8 000 r/min离心15 min收集细菌。将细菌溶于裂解缓冲液(50 mmol/L Na3PO4,300 mmol/L NaCl,pH 7.4)中,超声破菌,离心收集上清,样品分别加入5×蛋白上样缓冲液,100℃条件下煮5 min,12% SDS-PAGE蛋白凝胶电泳,电泳结束后考马斯亮蓝染色20 min,洗脱液(含40%甲醇和10%冰乙酸),脱色后观察分析。
1.3.4 Re-WSP1的纯化和脱盐浓缩
采用亲和层析的方法纯化目的蛋白,将5 mL预装填料Ni-NTA亲和材料加到空柱子中,待其沉降后加入冰预冷的结合缓冲液(50 mmol/L Na3PO4,300 mmol/L NaCl,10 mmol/L咪唑,pH 7.4)15 mL平衡柱子。将50 mL菌体破碎、离心后的上清用0.45 μm的微孔滤膜过滤,滤液加到层析柱中进行亲和纯化。用15 mL冰预冷的结合缓冲液洗脱非特异性结合的杂蛋白,再用冰预冷的15 mL含300 mmol/L咪唑的洗脱溶液洗脱目的蛋白,收集洗脱液,用磷酸盐缓冲溶液(phosphate buffered solution,PBS)过夜透析(透析用的透析袋的规格为MD34,截留分子质量为3 kD),加入l0 kD超滤管中,4℃、3 800 r/min离心30 min,最终获得脱盐并浓缩的蛋白溶液,保存于-80℃。以SDS-PAGE电泳检测上述步骤收集的样品中是否含有目的蛋白,同时以未诱导的菌悬液作为对照。
1.3.5 MTT法检测Re-WSP1对结肠癌细胞SW480生长的影响
采用MTT法,将处于对数生长期的人结肠癌SW480细胞、人正常结肠上皮FHC细胞,以8×103个/孔传入96 孔培养板,37℃含5%的CO2培养箱孵育24 h后,分别加入质量浓度为0.02、0.04、0.06、0.08、0.10 μg/μL的Re-WSP1,每组设5个复孔,并用PBS缓冲液作为对照。孵育48 h后吸弃孔内培养基,用 PBS洗涤2次后加入新的培养基,每孔加MTT溶液(5 mg/mL)20 μL,继续孵育4 h后终止培养。小心吸弃孔内培养上清液,每孔加入150 μL二甲基亚砜(dimethyl sulfoxide,DMSO),摇床振荡10 min,使结晶物充分溶解,用酶联免疫监测仪测定各孔A570nm值。

1.3.6 细胞凋亡及半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,caspase)检测
取对数生长期细胞接种于12 孔板中的盖玻片上,培养12 h后设对照组(不添加Re-WSP1),0.08 μg/μL Re-WSP1处理12 h组和0.08 μg/μL Re-WSP1处理24 h组,每组设4个复孔。24 h后每孔加入500 μL免疫染色固定液固定2 h,弃去固定液,每孔加入100 μL DAPI染色液避光染色15 min,激光共聚焦显微镜(60×)观察细胞核形态的变化并拍照。同时随机挑选5个视野,计算细胞凋亡率。
人结肠癌细胞SW480以4×105个/mL细胞密度接种于6 孔板,待细胞贴壁后,加入Re-WSP1至终浓度为0.08 μmol/L,37℃、5% CO2培养箱中培养24 h。细胞裂解液裂解细胞,提取细胞总蛋白,Western blotting检测Re-WSP1是否引起SW480细胞内Caspase蛋白表达量发生变化。
1.4 数据处理
2 结果与分析
2.1 编码WSP基因片段的扩增、克隆与鉴定

图1 WSP PCR产物Fig.1 PCR products of water stress protein

图2 表达质粒pET28a-WSP双酶切电泳图Fig.2 Restriction enzyme digestion analysis of the expression plasmid pET28a-WSP
以地皮菜组织cDNA做模板,根据天然蛋白测序结果设计特定的引物,通过PCR扩增出WSP基因片段(约1 000 bp)(图1)。将地皮菜WSP的PCR产物克隆到pET28a中,得到重组质粒pET28a-WSP。经BamHⅠ和XhoⅠ双酶切,凝胶电泳图显示有5 369 bp和1 000 bp两个条带,与pET28a和WSP基因大小相吻合(图2)。对PCR产物及重组质粒pET28a-WSP进行测序,两者结果完全相同,基因全长1 014 bp,编码氨基酸337个(图1),表明载体构建成功。该基因及蛋白序列已公布于GenBank,序列号为KF003026。
2.2 Re-WSP1的表达、纯化
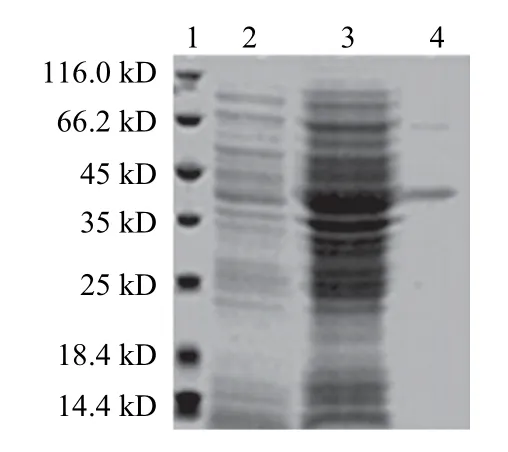
图3 Re-WSP1表达及SDS-PAGE分析Fig.3 Analysis of Re-WSP1 by SDS-PAGE
将上述重组质粒转入大肠杆菌BL21,获得原核表达工程菌pET28a-WSP/BL21。IPTG诱导表达后,SDS-PAGE结果显示:不加IPTG诱导时,融合表达载体pET28a-WSP不表达目的蛋白;IPTG诱导后,菌株大量表达Re-WSP1蛋白,表达后目的蛋白以可溶性形式存在,分子质量约40 kD,与理论值相符(图3)。蛋白经Ni-NTA纯化后,获得高纯度的Re-WSP1蛋白,经IMAGE J软件分析其纯度在90%以上。在595 nm波长处检测Re-WSP1质量浓度,计算出400 mL菌液得到脱盐、浓缩的纯化蛋白总量1.236 mg。
2.3 Re-WSP1对结肠癌细胞SW480的生长抑制作用
由图4可知,用纯化后不同质量浓度的Re-WSP1分别处理结肠癌上皮细胞SW480和正常肠上皮细胞FHC 48 h。MTT法检测SW480和FHC细胞增殖活力,结果表明Re-WSP1在质量浓度为0.08 μg/μL和0.10 μg/μL作用48 h后,对SW480细胞生长具有明显的抑制(P<0.01),抑制率分别为58.2%和59.7%;而对人正常结肠组织上皮细胞FHC生长无明显影响。

图4 Re-WSP1对SW480和FHC细胞增殖的影响Fig.4 Effects of Re-WSP1 on the growth of SW480 and FHC cells in vitro
2.4 Re-WSP1诱导细胞凋亡结果
用0.08 μg/μL Re-WSP1作用于SW480细胞,并分别于12、24 h对SW480细胞进行DAPI染色,观察SW480细胞核的变化。由图5可知,与对照组相比,经Re-WSP1作用12 h后,SW480细胞核出现固缩,有一部分细胞核呈半月形;经Re-WSP1作用24 h后,细胞核出现了典型的凋亡小体,SW480细胞凋亡率为27.3%。Western blotting结果显示,经Re-WSP1(0.08 μg/μL)处理24 h后,SW480细胞内Procaspase-3、Procaspase-8蛋白被激活,Caspase-3、Caspase-8剪切片段的量显著增加(图6),经灰度分析Re-WSP1处理组与对照组相比,Cleaved-caspase-8/Caspase-8和Cleaved-caspase-3/Caspase-3显著升高。提示Re-WSP1可能是通过激活Caspase而诱导SW480细胞发生凋亡。
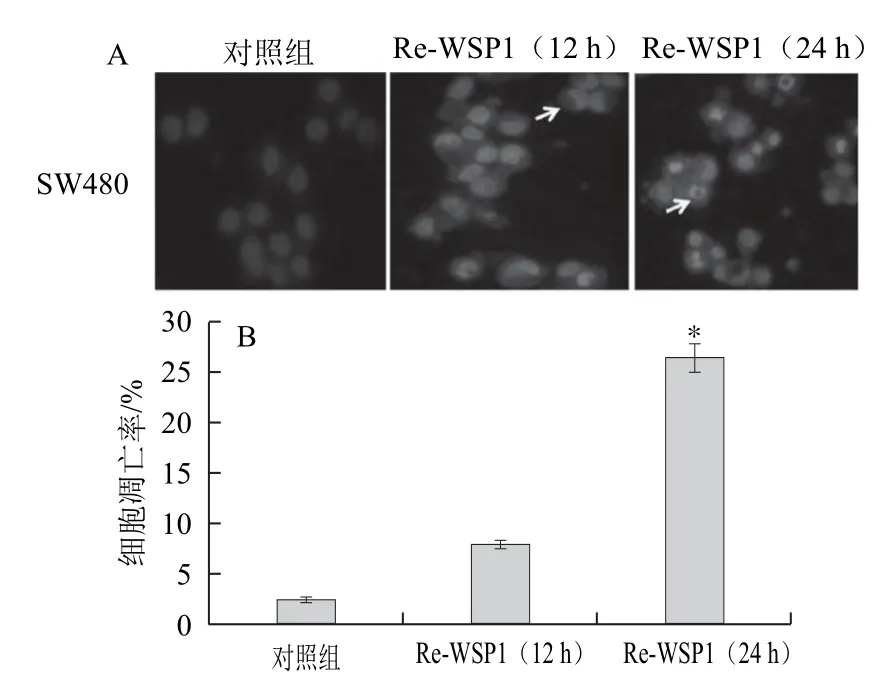
图5 Re-WSP1诱导结肠癌SW480细胞发生凋亡Fig.5 Effects of Re-WSP1 on apoptosis in SW480 colon cancer cells

图6 Re-WSP1诱导SW480细胞Caspase蛋白表达的变化Fig.6 Effects of Re-WSP1 on the expression of caspases in SW480 cells
3 讨 论
本实验前期研究发现,地皮菜(Nostoc commune Vauch.)中的天然水应激蛋白能够通过诱导结肠癌细胞凋亡而抑制其增殖。在此基础上,利用基因工程技术将地皮菜水应激蛋白基因片段克隆到原核表达系统并获得工程菌pET28a-WSP/BL21。目的蛋白在宿主菌中获得大量表达,并以可溶性状态存在,纯化后纯度高于90%。整个制备过程简单高效,无需复杂的处理,消耗试剂的种类均很少,为后续开发与生产提供了可能。
图4实验结果表明,Re-WSP1能够抑制结肠癌细胞SW480细胞的增殖,而对于正常结肠上皮细胞FHC生长无明显抑制作用。同时还发现,Re-WSP1可以引起SW480细胞的凋亡,该过程伴随着凋亡细胞一系列的典型改变,包括细胞的核质固缩,产生凋亡小体等(图 5)。半胱天冬酶(caspase)依赖途径是细胞凋亡的经典途径[17],图6实验结果说明Re-WSP1可以通过Caspase依赖途径诱导SW480细胞凋亡,地皮菜Re-WSP1处理后,上游的Procaspase-8被激活,活化的Caspase-8进一步激活下游的Caspase-3,最终导致细胞的凋亡。以上结果表明,Re-WSP1能够通过诱导SW480细胞的凋亡而抑制其增殖。对Re-WSP1抗肿瘤作用机制的深入研究,有利于进一步寻找Re-WSP1抑制结肠癌细胞的作用靶点,提高其疗效,同时也可以为其他抗肿瘤药物的筛选提供新的思路。
本实验成功获得了一种新型的Re-WSP1。实验结果显示,该蛋白可以诱导SW480细胞发生凋亡,进而抑制结肠癌SW480细胞的增殖,但它对人正常结肠癌上皮细胞却无明显抑制作用。该蛋白究竟是通过何种分子机制实现这一功能,作用于细胞的靶点是什么,还需要进一步的深入探讨。未来本课题组将对该蛋白进行截短优化,应用动物模型进行体内实验,以期获得在体内抑癌效果高,免疫反应小,安全性高的活性肽[18-20],为后续开发利用奠定基础。
[1]丁健.抗肿瘤药物的研究进展与发展策略[J].江西医学院学报,2004, 41(2): 33-39.
[2]SHIN K O, PARK N Y, SEO C H, et al.Inhibition of sphingolipid metabolism enhances resveratrol chemotherapy in human gastric cancer cells[J].Biomolecules & Therapeutics, 2012, 20(5): 470-476.
[3]SAIKO P, GRASER G, GIESSRIGL B, et al.Digalloyl resveratrol,a novel resveratrol analog inhibits the growth of human pancreatic cancer cells[J].Invest New Drugs, 2013, 31(5): 1115-1124.
[4]SHIN D Y, LEE W S, JUNG J H, et al.Flavonoids from Orostachys japonicus A.Berger inhibit the invasion of LNCaP prostate carcinoma cells by inactivating Akt and modulating tight junctions[J].International Journal of Molecular Sciences, 2013, 14(9): 18407-18420.
[5]LANDIS-PIWOWAR K R, MILACIC V, DOU Q P.Relationship between the methylation status of dietary flavonoids and their growthinhibitory and apoptosis-inducing activities in human cancer cells[J].Journal of Cellular Biochemistry, 2008, 105(2): 514-523.
[6]缪成贵, 刘健, 张永和, 等.滁菊总黄酮调控类风湿性关节炎模型大鼠滑膜组织Wnt通路SFRP4表达[J].中南大学学报: 医学版, 2013,38(7): 715-721.
[7]聂小兰, 程英魁.吉林省山野菜资源及开发前景[J].吉林农业,1996(7): 22.
[8]BRIONES M P, HORI K, MARTINEZ-GOSS M R, et al.A comparison of physical properties, oxalate-oxalic acid soluble substances, protein content, and in vitro protein digestibility of the blue-green alga Nostoc commune Vauch.from the Philippines and Japan[J].Plant Foods for Human Nutrition, 1997, 50(4): 287-294.
[9]PATEL A, MISHRA S, PAWAR R, et al.Purification and characterization of C-phycocyanin from cyanobacterial species of marine and freshwater habitat[J].Protein Expression and Purification,2005, 40(2): 248-255.
[10]KUDDUS M, SINGH P, THOMAS G, et al.Recent developments in production and biotechnological applications of C-phycocyanin[J].BioMed Research International.2013(1): 742859.
[11]牛生洋, 郝峰鸽, 赵瑞香, 等.地皮菜中多糖的抑菌特性研究[J].广东农业科学, 2011, 38(9): 93-94.
[12]CASTIGLIONI P, WARNER D, BENSEN R J, et al.Bacterial RNA chaperones confer abiotic stress tolerance in plants and improved grain yield in maize under water-limited conditions[J].Plant Physiology,2008, 147(2): 446-455.
[13]DAI M, DENG X P, YANG S S, et al.Effects of water stress on protein expression and physiological properties of different genotype wheat (Triticum aestivum L.) sprouts[J].The Journal of Applied Ecology, 2009, 20(9): 2149-2156.
[14]GHASSEMI-GOLEZANI K, LOTFI R.Influence of water stress and pod position on oil and protein accumulation in soybean grains[J].International Journal of Agronomy and Plant Production, 2013, 4(9):2341-2345.
[15]SCHERER S, POTTSM.Novel water stress protein from a desiccationtolerant cyanobacterium.Purification and partial characterization[J].Journal of Biological Chemistry, 1989, 264(21): 12546-12553.
[16]JOSHI C P, KING S W, NGUYEN H T.Molecular cloning and characterization of a cDNA encoding a water stress protein (WSP23)from wheat roots[J].Plant Science, 1992, 86(1): 71-82.
[17]ELMORE S.Apoptosis: a review of programmed cell death[J].Toxicologic Pathology, 2007, 35(4): 495-516.
[18]LUTZ S.Beyond directed evolution-semi-rational protein engineeringand design[J].Chemical Biotechnology-Pharmaceutical Biotechnology, 2010, 21(6): 734-743.
[19]CARTERP J.Introduction to current and future protein therapeutics:aprotein engineering perspective[J].Experimental Cell Research,2011, 317(9): 1261-1269.
[20]SANDBERG A, LUHESHI L M, SÖLLVANDER S, et al.Stabilization of neurotoxic Alzheimer amyloid-β oligomers by protein engineering[J].Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(35): 15595-15600.
