西洛他唑通过P38 MAPK信号途径对大鼠脑缺血再灌注损伤的保护作用
2014-01-29蓝琳友洪溪屏蔡元晖
蓝琳友 洪溪屏 蔡元晖
脑卒中目前是全球第2常见死因,在我国已成为第1位死因,其中缺血性脑卒中占全部脑卒中的大部分,而缺血再灌注损伤是大多数缺血性脑血管疾病的主要病理生理过程,其发生机制尚未完全阐明[1]。有研究表明,缺血后神经元细胞凋亡参与了缺血性脑损伤的过程[2]。因此,抑制神经元细胞凋亡可减轻脑缺血损伤。
西洛他唑是一种选择性磷酸二酯酶3抑制剂,可通过增加细胞内环磷腺苷酸含量和激活蛋白激酶A从而发挥抗血小板凝聚和舒张血管的作用,本研究拟观察西洛他唑对大鼠局灶性脑缺血再灌注损伤模型中神经细胞凋亡的影响及其作用机制[3]。
材料与方法
1.动物和材料:成年雌性 SD 大鼠,体重304.5 ±25.4g,由温州医学院动物实验中心提供;西洛他唑(纯度>98%)购自Sigma公司;免疫组化染色试剂盒购自上海碧云天生物技术研究所;Tunel试剂盒购自瑞士罗氏公司;caspase-3、p-P38、p-ERK、p-JNK和β-actin抗体购自美国Epitomics公司;BCA蛋白浓度测定试剂盒购自美国Sigma公司。
2.动物分组和模型制备:将SD大鼠按照数字表法随机分成5组:假手术组、模型组、西洛他唑低剂量(5mg/kg)组、西洛他唑中剂量(10mg/kg)组和西洛他唑高剂量(20mg/kg)组,每组15只。按照Longa EZ等报道的线栓法制作大鼠右侧大脑中动脉闭塞模型,以动物出现右眼Horner征为模型成功的标志,阻断血流2h后再灌注24h,成功建立缺血再灌注模型45只[5]。假手术组仅将缝线插入后拔出,不阻断大脑中动脉。西洛他唑在术前2h和6h分别经灌胃给药1次,模型组和假手术组分别灌胃给予等量生理盐水。
3.神经功能评分:所有实验大鼠在手术清醒后自由饮食,术后4、24和48h根据Longa EZ法分别进行神经功能评分:0分,无明显神经功能缺损;1分,提尾时不能伸展左前肢;2分,行走时向左侧旋转;3分,行走时向左侧倾斜;4分,不能自主活动或伴意识障碍。大鼠清醒后首次评分在1~3分者为造模成功,作为本次实验用大鼠。
4.Tunel法检测细胞凋亡:术后24h每组随机取5只大鼠同时腹腔内注射10%水合氯醛麻醉后,迅速开胸,用PBS灌注后用多聚甲醛灌注固定,取出脑组织后剔除小脑、脑干和嗅球取出脑组织,一半放置液氮中保存,一半置4%多聚甲醛中固定,石蜡包埋,进行连续切片,切片厚3μm,烘干备用。细胞凋亡检测按Tunel试剂盒说明书操作,细胞核固缩、染色体凝集呈棕褐色染色者为凋亡细胞,低倍镜(×100)下观察20个视野,图片结果用Image-Pro Plus 6.0图像处理软件进行分析。
5.Western blot法检测脑组织中蛋白的表达:将液氮中保存的脑组织粉碎后加入RIPA裂解液裂解细胞,提取上清液。用Bradford法测量蛋白浓度后取等量蛋白质样品(20微克/
结 果
1.各组神经功能缺损评分:与假手术组相比较,模型组各时间点神经功能评分均显著升高,在24h时达到高峰(P<0.05)。与模型组相比较,西洛他唑各剂量组在各时间点神经功能评分均降低(P<0.05)。与西洛他唑低剂量组相比较,西洛他唑高剂量组神经功能评分低于低剂量组,各时间点差异均有统计学意义(P <0.05,表1)。
表1 各组大鼠在不同时间点的神经功能评分比较(±s,n=5,分)
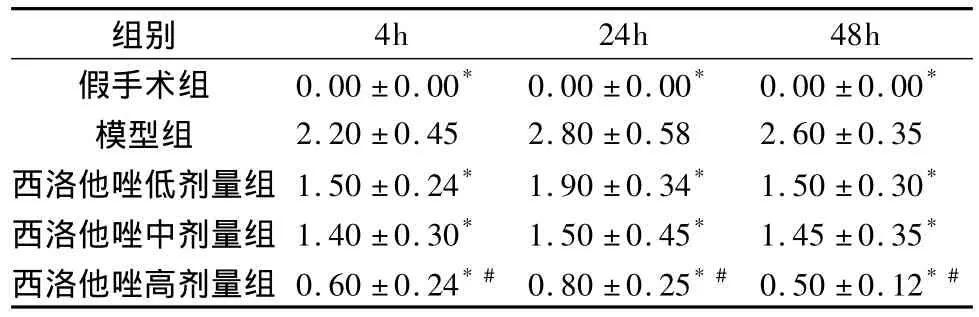
表1 各组大鼠在不同时间点的神经功能评分比较(±s,n=5,分)
与模型组比较,*P<0.05;与西洛他唑低剂量组比较,#P<0.05
4h 24h 48h假手术组 0.00 ±0.00* 0.00 ±0.00* 0.00 ±0.00组别*模型组 2.20 ±0.45 2.80 ±0.58 2.60 ±0.35西洛他唑低剂量组 1.50 ±0.24* 1.90 ±0.34* 1.50 ±0.30*西洛他唑中剂量组 1.40 ±0.30* 1.50 ±0.45* 1.45 ±0.35*西洛他唑高剂量组 0.60 ±0.24*# 0.80 ±0.25*# 0.50 ±0.12*#
2.Tunel法检测神经细胞凋亡:如图1所示,Tunel染色阳性细胞表现为仅为胞核染成棕褐色,图片经过Image-Pro Plus 6.0图像处理软件分析后,Tunel阳性细胞比例用累积光密度值IOD来表示。假手术组中有少量凋亡细胞,模型组中可见大量神经细胞凋亡,显著高于假手术组(P<0.05);西洛他唑低、中、高剂量组的细胞凋亡率均低于模型组,差异有统计学意义(P<0.05);与西洛他唑低剂量组相比较,西洛他唑中、高剂量组的IOD值均明显下降,有统计学差异(P<0.05),详见表2。
3.西洛他唑对大鼠脑组织细胞MAPK信号通路中p-P38、p-ERK、p-JNK以及 caspase-3蛋白表达的影响:如图2所示,与假手术组相比较,模型组中MAPK信号通路调节蛋白p-P38、p-ERK和 p-JNK以及caspase-3的表达均显著增加;与模型组相比较,西洛他唑作用后大鼠脑组织中p-P38的表达水平降低,呈浓度依赖性,而西洛他唑对其他MAPK的调节蛋白如p-ERK和p-JNK的表达无明显变化;同时随着西洛他唑剂量的增加,caspase-3的表达明显下降,且表达强度随药物剂量的增加而降低(表3)。

图1 各组大鼠脑组织神经细胞凋亡结果(×100)
表2 Tunel法检测各组大鼠神经细胞凋亡的IOD值比较(±s)

表2 Tunel法检测各组大鼠神经细胞凋亡的IOD值比较(±s)
与模型组比较,*P<0.05;与西洛他唑低剂量组比较,#P<0.05
组别 IOD值假手术组 34.59 ±6.19*模型组 254.51 ±35.45西洛他唑低剂量组 156.35 ±20.69*西洛他唑中剂量组 94.31 ±15.81*#西洛他唑高剂量组 61.29 ±8.24*#
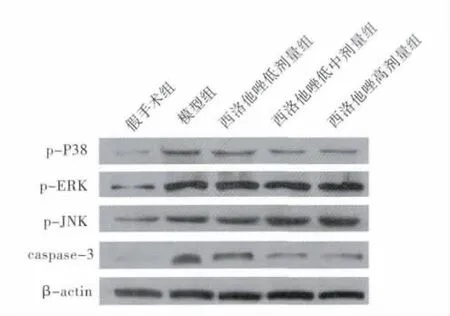
图2 Western blot检测各组大鼠脑组织中p-P38、p-ERK、p-JNK以及caspase-3蛋白表达
表3 各组大鼠脑组织p-P38、p-ERK、p-JNK以及caspase-3蛋白表达比较(±s)
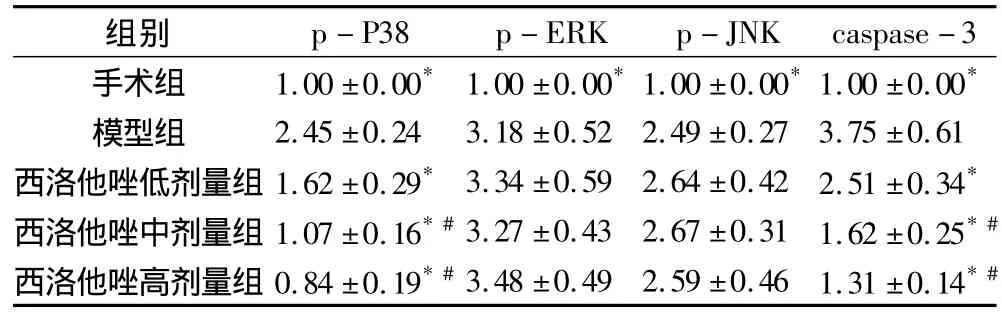
表3 各组大鼠脑组织p-P38、p-ERK、p-JNK以及caspase-3蛋白表达比较(±s)
与模型组比较,*P<0.05;与西洛他唑低剂量组比较,#P<0.05
p-P38 p-ERK p-JNK caspase-3手术组 1.00 ±0.00* 1.00 ±0.00*1.00 ±0.00*1.00 ±0.00组别*模型组 2.45 ±0.24 3.18 ±0.52 2.49 ±0.27 3.75 ±0.61西洛他唑低剂量组 1.62 ±0.29* 3.34 ±0.59 2.64 ±0.42 2.51 ±0.34*西洛他唑中剂量组 1.07 ±0.16*#3.27 ±0.43 2.67 ±0.31 1.62 ±0.25*#西洛他唑高剂量组 0.84 ±0.19*#3.48 ±0.49 2.59 ±0.46 1.31 ±0.14*#
讨 论
脑缺血再灌注后可产生一系列神经功能缺损的表现,严重危害患者的生活质量,Longa EZ法是在临床和科研实验中被广泛应用的神经功能评分法。在本研究中,模型组大鼠出现明显对侧肢体运动障碍和意识障碍等神经功能损害的表现,而假手术并未引起缺血再灌注,因此没有出现神经功能缺损症状,从而排除手术因素对大鼠神经学评分的影响,而西洛他唑可以有效改善缺血再灌注大鼠的神经症状,表明西洛他唑对大鼠缺血再灌注损伤有确切的保护作用,与文献报道相符[4]。
脑组织缺血再灌注后继发的病理生理改变所造成脑细胞的损伤是脑缺血再灌注损伤的重要原因,研究表明,细胞凋亡是引起受损脑细胞死亡的主要机制之一,而海马CA1区是大脑缺血最为敏感的部位,被称为缺血易损区[5,6]。因此,本研究采用该处脑组织进行脑缺血再灌注损伤的研究。Tunel实验结果表明,模型组大鼠脑组织中凋亡细胞数较假手术组明显增多,而西洛他唑作用后脑组织中凋亡神经细胞数显著减少,并呈剂量依赖性,表明西洛他唑对大鼠脑组织中神经细胞凋亡具有保护作用。
细胞凋亡是一个复杂的过程,目前已知细胞凋亡有两条主要途径[7]:一是TNF受体家族成员参与的通过caspase-8活化途径,称为外源性凋亡途径;二是细胞色素C参与的通过caspase-9活化的途径,称为内源性凋亡途径,两条途径最后均激活下游效应因子caspase-3和caspase-7从而使细胞发生凋亡。但除外caspase依赖的细胞凋亡通路外,还存在不依赖caspase的凋亡通路,如MAPK信号通路。MAPK是细胞内丝氨酸/酪氨酸蛋白激酶家族。MAPK信号通路中的成员P38、ERK和JNK等可以被各种细胞外信号激活,引起细胞内的级联反应,从而参与细胞周期的调节、细胞增殖和细胞凋亡等一系列生理及病理过程。大量研究表明,阻断JNK通路可抑制细胞凋亡,而阻断ERK通路可促进细胞凋亡;而P38作为MAPK家族中最重要成员,P38的丝氨酸/酪氨酸残基可以被磷酸化而激活为p-P38,从而在细胞凋亡中发挥重要的作用,p-P38表达增加可促进细胞凋亡[7,8]。在本研究中,应用 Western blot法检测了MAPK家族中3种调节蛋白的变化,结果表明,模型组中p-P38、p-ERK、p-JNK以及 caspase-3的表达较假手术组明显增加,表明在缺血再灌注中,caspase通路和MAPK通路可能都参与了神经细胞凋亡过程;而经西洛他唑作用后p-P38表达水平显著降低,而p-ERK、p-JNK的表达并没有发生改变,而caspase-3的表达也经西洛他唑作用后降低。由此表明,抑制caspase-3的表达以及阻断P38 MAPK信号通路的激活可能是西洛他唑抑制神经细胞凋亡的作用机制之一。
总之,本次研究表明西洛他唑可通过抑制脑组织神经细胞凋亡,同时对大鼠缺血再灌注神经功能损伤发挥一定保护作用,其机制可能主要是通过抑制caspase-3的表达以及阻断P38 MAPK信号通路的激活而实现。本次实验结果为西洛他唑应用于临床治疗提供了更多的实验依据,但需进一步实验研究西洛他唑调节MAPK信号通路的具体机制。
1 中华医学会神经病学分会脑血管病学组急性缺血性脑卒中诊治指南撰写组.中国急性缺血性脑卒中诊治指南2010[J].中国全科医学,2011,14(35):4013-4017
2 Smith WS.Pathophysiology of focal cerebral ischemia:a therapeutic perspective[J].J Vasc Interv Radiol,2004,15(1 Pt 2):S3-12
3 Jung KI,Kim JH,Park HY,et al.Neuroprotective effects of cilostazol on retinal ganglion cell damage in diabetic rats[J].J Pharmacol Exp T-her,2013,345(3):457-463
4 Yu BC,Lee DS,Bae SM,et al.The effect of cilostazol on the expression of matrix metalloproteinase-1 and type I procollagen in ultraviolet-irradiated human dermal fibroblasts[J].Life Sci,2013,92(4-5):282-288
5 Shi SS,Yang WZ,Tu XK,et al.5-Lipoxygenase inhibitor zileuton inhibits neuronal apoptosis following focal cerebral ischemia[J].Inflammation,2013,33(2):253-257
6 Zhao J,Xu H,Tian Y,et al.Effect of electroacupuncture on brainderived neurotrophic factor mRNA expression in mouse hippocampusfollowing cerebral ischemia-reperfusion injury[J].J Tradit Chin Med,2013,33(2):253-257
7 Korhonen R,Hömmö T,Keränen T,et al.Attenuation of TNF production and experimentally induced inflammation by PDE4 inhibitor rolipram is mediated by MAPK phosphatase-1[J].Br J Pharmacol,2013,169(7):1525-1536
8 Pathak RK,Taj G,Pandey D,et al.Modeling of the MAPK machinery activation in response to various abiotic and biotic stresses in plants by a system biology approach[J].Bioinformation,2013,25:9(9):443-449
