麻杏石甘汤对哮喘大鼠气道上皮STAT6和黏蛋白表达的调控
2014-01-29朱丽君张怡静叶乐平
虞 琳 朱丽君 张怡静 叶乐平
支气管哮喘(以下简称哮喘,asthma)是一种伴有细胞因子产生异常及气道内变态反应性炎症发生的免疫失衡性疾病,即Th1/Th2失衡[1]。多种信号转导通路参与哮喘的发病机制,其中白介素13(IL-13)激活的 Janus激酶(janus kinases,JAK)/信号转导及转录激活因子(signal transduction and activator of transcription,STAT)通路是哮喘发病机制中的重要通路之一,在促进哮喘炎症、黏液高分泌中发挥重要作用,也是目前的研究热点[2]。麻杏石甘汤(maxingshigan decoction,MGD)出自我国国粹《伤寒论》,因其有辛凉宣肺、止咳平喘之功,在历史上应用已久。现代药理学研究表明其不仅有镇咳、祛痰、平喘、解热的功效,还能抗炎、抗过敏、抗病原微生物以及改善血液循环。但其在哮喘治疗中的具体机制仍未明确,为其临床应用带来一定的局限性。因此,本研究拟通过建立哮喘大鼠模型,研究IL-13、STAT6、黏蛋白表达,来探讨麻杏石甘汤抑制气道炎症、减少黏液分泌的可能机制。
材料与方法
1.药物及试剂:卵清白蛋白(ovalbumini,OVA)、焦磷酸二乙酯(diethypyrocarbonate,DEPC)购自美国 Sigma公司,大鼠IL-12、IL-13 ELISA试剂盒来自美国R&D公司,STAT6兔抗大鼠多克隆抗体购自美国Abcam公司(Lot#GR52323-3),二步法免疫组化检测试剂、DAB显色试剂盒、苏木素染液均购自北京中衫金桥,AB-PAS染色试剂盒购自上海源叶生物科技有限公司,其余试剂为市售分析纯试剂。
2.MGD 的制备:麻黄6g、杏仁6g、甘草5g、石膏 20g(购自温州医科大学附属第二医院),MGD的煎制参照中华人民共和国国家卫生和计划生育委员会国家中医药管理局发布的《医疗机构中药煎药室管理规范》。煮石膏20min,将双蒸水浸泡0.5h后的麻黄、杏仁、甘草放入同煎15min,取第1道汁后再加入双倍双蒸水,煎15min,取汁,混合第1、2道汁,浓缩至相应体积。高、中、低剂量中药组分别含生药24.6、12.3和6.15g/kg。于4℃冰箱保存备用。
3.实验动物分组及处理:SPF级幼年雄性SD大鼠55只(购自温州医科大学实验动物中心),体重120~180g,随机分为5组:对照组(A组)、哮喘组(B组)、哮喘+高剂量MGD组(C组)、哮喘+中剂量MGD组(D组)、哮喘+低剂量MGD组(E组),每组11只。哮喘模型的制作分致敏和激发两阶段。致敏阶段:B组分别于第1天和第8天注射卵含白蛋白(OVA)和氢氧化铝凝胶的无菌抗原液,A组用等量的生理盐水替代。激发阶段:第2次致敏1周后,将B~E组哮喘大鼠放入自制的密闭有机玻璃箱(40cm×30cm×20cm)中,含1%OVA的生理盐水雾化吸入,每天1次,每次30min,连续定时激发3天;A组用生理盐水代替OVA进行。C~E组在第2次致敏后第4天开始分别予高、中、低剂量MGD灌胃,每天2次,激发阶段则每次激发前后4h灌胃同等剂量MGD。
4.标本的制备:末次激发24h后腹腔注射10%水合氯醛3ml/kg,后行腹主动脉切开取血处死。即刻切开气管,切取左肺脱水、石蜡包埋,切片后行HE染色、免疫组化、AB-PAS染色。经气管插管行右肺灌洗,留取支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF),2000r/min离心15min,取上清-80℃保存备用。
5.BALF中IL-12和 IL-13浓度测定:应用 sandwich ELISA法检测BALF中IL-12、IL-13的表达水平。实验过程参照试剂说明书进行。
6.免疫组化法:石蜡切片脱蜡至水,高压修复3min,室温冷却后PBS冲洗,3%H2O2灭活内源性酶,先后予蒸馏水、PBS冲洗后,5%山羊血清封闭非特异性抗体,37℃水浴箱孵化30min,滴加 STAT6兔抗鼠多克隆抗体(1∶100),4℃过夜;复温后滴加生物素标记的二抗,37℃孵化30min;PBS冲洗后行DAB染色,镜下观察显色反应,蒸馏水中终止反应后予苏木素复染,PBS返蓝后脱水、透明,中性树胶封片。阳性结果呈棕黄色,用图像分析仪IPP6.0测定肺组织平均吸光度值(IOD)作为STAT6蛋白免疫组化检测及定量测定相对含量。
7.AB-PAS法检测气道黏蛋白表达:石蜡切片脱蜡至水,3%醋酸水溶液室温1min,1%Alcian blue染色液染色15min,蒸馏水洗后1%过碘酸氧化8min,Schiff染色12min,水洗后脱水封片。硫酸化黏液呈黑色,酸性黏液呈蓝色,中性黏液呈红色。检测方法同免疫组化。
8.统计学方法:统计分析软件为SPSS 17.0,所有数据均进行正态性检验,并以均数±标准差(±s)表示。多组样本均数比较采用方差分析(one-way ANOVA),方差齐者两两比较采用LSD检验,方差不齐者采用Tamhane's T2检验。以P<0.05为差异有统计学意义。
结 果
1.哮喘模型的生物学判断:哮喘组大鼠OVA雾化激发时多表现为烦躁不安、呼吸急促、四肢颤动、毛色失去光泽,严重者四肢瘫软,俯伏不动,呼吸节律不规则。不同剂量MGD组大鼠激发后表现均较哮喘组明显减轻。
2.大鼠 BALF中 IL-12、IL-13(图1):哮喘组BALF中IL-13浓度显著高于A组,不同剂量MGD组中该值均较B组低且呈剂量相关性,其中C、D组与B组相比有统计学意义(P<0.05)。与A组相比,IL-12在B组含量明显下降,而采用MGD干预后BALF中IL-12含量呈浓度依赖性升高。
3.大鼠肺组织病理改变(图2):A组大鼠气道、血管形态规整,未见明显炎性细胞浸润。B组气道、血管肌层明显增生,周围炎性细胞浸润明显,以嗜酸性粒细胞、淋巴细胞和中性粒细胞为主,基膜增厚,部分气道上皮脱落,管腔内可见黏液栓。C~E组肺组织炎性细胞浸润、血管平滑肌增生均较B组减轻,且随着剂量的增加,改善越显著。
4.MGD对STAT6表达的影响(图3、表1):B组肺组织STAT6蛋白在各级气管、支气管上皮呈棕黄色强阳性表达,血管和肺间质未见明显表达,而A组肺组织中STAT6蛋白呈阴性或极小部分弱阳性表达,其含量显著低于B组,有统计学意义(P<0.05)。MGD明显下调哮喘大鼠肺组织气道上皮的STAT6含量,但高于A组,且C、D组STAT6表达较B组明显下降,差异有统计学意义(P<0.05)。

图1 MGD对哮喘大鼠BALF中IL-12、IL-13的影响

图2 气道炎症病理学变化(HE染色,×400)
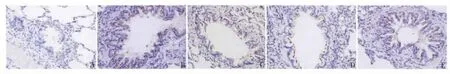
图3 大鼠气道上皮STAT6表达(免疫组化,×400)
5.MGD对黏蛋白表达的影响(图4、表1):运用AB-PAS染色法发现,B组气道上皮黏蛋白表达较A组明显增多(P<0.01),尤以大气道为著。MGD能明显减少气道黏蛋白的表达,与B组相比,各组大鼠气道上皮黏蛋白含量均显著降低(P<0.05)。

图4 哮喘大鼠气道上皮黏蛋白表达(AB-PAS法,×400)
表1 各组大鼠气道上皮STAT6、黏蛋白的吸光度(IOD)检测(±s)

表1 各组大鼠气道上皮STAT6、黏蛋白的吸光度(IOD)检测(±s)
与 A 组比较,*P <0.05,与 B 组比较,△P <0.05
组别 STAT6黏蛋白A组0.176 8 ±0.0406 0.169 2 ±0.0230 B 组 0.248 6 ±0.0409* 0.230 9 ±0.0335*C 组 0.205 5 ±0.0316△ 0.181 6 ±0.1796△D 组 0.219 6±0.0220*△ 0.184 8±0.0262*△E 组 0.229 6 ±0.0355* 0.204 3 ±0.0277*△
讨 论
随着哮喘发生率的逐年攀升,对其机制的研究也日渐深入。多种信号转导通路参与哮喘的发病,分别介导着细胞因子、炎症介质和黏附因子在哮喘发病中的作用。其中IL-13激活的JAK/STAT通路是哮喘发病机制中的重要通路之一,也是目前的研究热点,因此本研究选择该通路作为切入点[2]。而气道黏液高分泌不仅导致气流受限,还增加气道反应性,过度的黏液分泌提示哮喘控制不佳,是许多哮喘患儿的共同临床特点,与发病率和病死率的升高相关。
STAT家族成员参与许多细胞因子的信号转导,是整个JAK/STAT信号通路的核心分子,近年来发现在全身多系统中发挥重要的调节作用。哺乳动物中已发现7个STAT亚型,其中STAT6与哮喘关系最为密切。目前认为“Th2优势应答”是哮喘发病的关键环节,而笔者前期研究[3]表明,STAT6是诱导Th2细胞分化的特异性转录因子,在Th2细胞的分化中起着关键性作用。IL-13被认为是与哮喘发病最为直接相关的Th2因子之一,它参与哮喘的气道炎症和重塑,包括黏液分泌,IgE合成,EOS招募,气道成纤维细胞、气道平滑肌细胞增殖[4]。有研究认为IL-13/STAT6信号通路通过增强气道高反应、促进炎症发生而在哮喘发病中起着关键作用[5]。本研究中哮喘组气道上皮STAT6表达较对照组明显升高,其肺组织周围炎性细胞浸润显著,BALF中IL-13浓度高于对照组,提示哮喘大鼠在变应原激发下STAT6高表达,进一步诱导其下游炎症因子IL-13等Th2因子大量生成,使Th1/Th2失衡,从而在哮喘发病中发挥作用。
气道黏液是人体呼吸道的第1道防御屏障,是一种由脂质、糖结合物和蛋白质组成的溶液,起到屏障、湿润、运输、免疫的作用[6,7]。气道黏液中含有 2%的黏蛋白(mucin),由特异性的MUC所编码。在目前已知的20种人类MUC中,只有MUC5AC和MUC5B编码正常人气道分泌物中的黏蛋白[8]。MUC5B是人和小鼠小气道基底层的主要凝胶形成黏蛋白,以发挥清除功能为主,从而维持气道内环境稳定,MUC5AC则是气道炎症时被上调的主要黏蛋白。在各种原因所导致的气道炎症如慢性阻塞性肺疾病(COPD)、哮喘等中,黏蛋白分泌明显增高,且持续的黏液高分泌可导致气道阻塞、气流受损、肺功能进行性下降、细菌感染机会增加等。与COPD相比,哮喘患者的气道黏液更为黏稠,易产生凝胶状的黏液栓并可能阻塞气道[9]。Kondo等[8]发现使用 IL-13 处理后杯状细胞含量增加10倍,提示IL-13能够刺激杯状细胞化生、黏蛋白形成。Tyner等[10]发现,当用IL-13干预气-液交界面的小鼠气道上皮细胞时,能诱导纤毛细胞向杯状细胞化生。另有研究发现肺组织STAT6是黏膜分泌的关键性调控因子,气道黏膜分泌功能与STAT6的表达与激活有关。江德鹏等[11]用IL-13刺激HBE16细胞后发现MUC5AC和p-JNK1/2表达升高,使用SP600125阻断JNK通路后,MUC5AC表达减弱,认为IL-13通过JNK-STAT6-FOXA2通路调控黏液分泌。本实验发现哮喘组气道上皮黏蛋白(主要是大气道)、STAT6表达均较对照组明显增多,提示STAT6可能通过诱导大量IL-13产生,进而促进气道杯状细胞化生和黏液分泌,引起一系列病理生理改变,从而参与哮喘气道黏液高分泌的发生。但本实验仅能说明哮喘时IL-13、STAT6、黏蛋白均升高,其具体信号通路的分子机制有待进一步的研究。
近年来中西医联合治疗儿童哮喘受到越来越多学者的重视。支气管哮喘属中医“哮证”范畴,为冷哮、热哮。MGD出自汉代医圣张仲景的《伤寒论》,由麻黄、杏仁、炙甘草、石膏4味药组成,具有辛凉宣肺、清热平喘的功效,是治疗热哮的良方。麻黄和石膏共为君药,杏仁降利肺气而平喘,为臣药;炙甘草益气和中,为使药。作为国粹的经典偏方,其在临床中的应用由来已久。现代药理研究证实MGD中麻黄所含的麻黄碱为 β2受体激动剂,可活化腺苷酸环化酶(cAMP),舒张支气管平滑肌痉挛;杏仁所含的苦杏仁苷经酶水解后产生氢氰酸,可使呼吸运动趋于安静而奏止咳平喘作用,并能促进动脉壁前列腺I2(PGI2)样物质生成,扩张微血管,改善微循环;生石膏的成分主要为含水硫酸钙对支气管神经肌肉有抑制及镇静作用,加上钙质能降低支气管通透性,故有解除支气管痉挛的作用[12]。但其对哮喘气道黏液高分泌的影响及其通过哪种信号通路其作用国内外尚无报道。
本研究结果证明MGD能减少哮喘大鼠EOS浸润,减轻变态反应。而运用AB-PAS染色法发现,MGD组大鼠气道上皮黏蛋白分泌明显少于哮喘组,且呈浓度依赖性,提示MGD能减轻哮喘的黏液高分泌。进一步研究发现,哮喘大鼠在不同浓度MGD灌胃后,气道上皮STAT6、BALF中IL-13含量均呈剂量相关性下降,实验结果与Lee等[2]相符。因此笔者推测哮喘黏液高分泌与IL-13/STAT6通路密切相关,MGD可能通过减少炎症介质IL-13、下调STAT6的表达,进而减少EOS的浸润,减轻气道炎症反应,降低了哮喘的气道黏液高分泌。但也有研究认为,哮喘大鼠黏液高分泌是通过独立的ERK/PKC通路起作用[13]。因此其具体信号通路及相关炎症因子,MGD的具体制剂、浓度等还有待更进一步的研究。
总之,本实验证实MGD能减少哮喘大鼠IL-13、STAT6、黏蛋白的表达,可能通过 IL-13/STAT6/黏蛋白通路减轻炎症反应,减少黏液分泌,为其现代临床应用提供了依据。相信随着哮喘机制的进一步深入研究,临床MGD片剂、STAT6抑制剂等的研发,将为哮喘的中西医结合治疗开辟新的途径。
1 Wild JS,Sigounas A,Sur N,et al.IFN-gamma-inducing factor(IL-18)increases allergic sensitization,serum IgE,Th2 cytokines,and airway eosinophilia in a mouse model of allergic asthma[J].J Immunol,2000,164(5):2701-2710
2 Lee JH,Kaminski N,Dolganov G,et al.Interleukin-13 induces dramatically different transcriptional programs in three human airway cell types[J].Am J Respir Cell Mol Biol,2001,25(4):474-485
3 李昌崇,叶乐平,陈小芳,等.哮喘大鼠信息传递与转录活化因子6的表达和地塞米松对其表达的影响[J].中华儿科杂志,2005,43(7):521-525
4 Gallelli L,Busceti MT,Vatrella A,et al.Update on anticytokine treatment for asthma[J].Biomed Res Int,2013,2013:104315
5 Oh CK,Geba GP,Molfino N.Investigational therapeutics targeting the IL-4/IL-13/STAT-6 pathway for the treatment of asthma[J].Eur Respir Rev,2010,19(115):46-54
6 Knowles MR,Boucher RC.Mucus clearance as a primary innate defense mechanism for mammalian airways[J].J Clin Invest,2002,109(5):571-577
7 Yu H,Li Q,Kolosov VP,et al.Interleukin-13 induces mucin 5AC production involving STAT6/SPDEF in human airway epithelial cells[J].Cell Commun Adhes,2010,17(4-6):83-92
8 Kondo M,Tamaoki J,Takeyama K,et al.Elimination of IL-13 reverses established goblet cell metaplasia into ciliated epithelia in airway epithelial cell culture[J].Allergol Int,2006,55(3):329-336
9 Tillie-Leblond I,Gosset P,Tonnel AB.Inflammatory events in severe acute asthma[J].Allergy,2005,60(1):23-29
10 Tyner JW,Kim EY,Ide K,et al.Blocking airway mucous cell metaplasia by inhibiting EGFR antiapoptosis and IL-13 transdifferentiation signals[J].J Clin Invest,2006,116(2):309-321
11 江德鹏,Victor PK,Juliy MP,等.白介素13通过FOXA2调控气道上皮细胞粘液分泌[J].中国免疫学杂志,2011,27(2):99-102
12 桑杲,陈志敏.麻杏石甘汤治疗小儿支气管哮喘的药理研究及临床应用进展[J].浙江中医杂志,2006,41(6):366-368
13 Song JS,Kang CM,Yoo MB,et al.Nitric oxide induces MUC5AC mucin in respiratory epithelial cells through PKC and ERK dependent pathways[J].Respir Res,2007,8:28
