长沙青皮竹叶中黄酮类化合物的提取工艺条件
2014-01-22贾可敬李湘洲
贾可敬,李湘洲,殷 凯
(中南林业科技大学 材料科学与工程学院,湖南 长沙 410004)
竹叶中的黄酮类化合物具有抑制脂质过氧化、抗菌[1]、免疫调节[2-3]、保护心脑血管[4]、降血脂[5]、保护肝脏[6]和清除自由基等功能[7-9]。随着人类对自身保健和养生方面的关注度越来越高,以天然黄酮为主打或者作为添加剂的产品将会倍受人们的青睐。
长沙青皮竹Bambusa textilisvar.persistens.B.M.Yang是一种生长在湖南长沙的青皮竹变种[10],目前对其的研究报道仅限于作为观赏竹种的植物学分类方面,其他方面的研究报道却极少,而有关竹叶提取物的研究却已成为当今热门的相关研究领域。因此,对长沙青皮竹叶提取物中活性成分的研究具有一定的现实意义。
目前,黄酮或竹叶黄酮的提取方法有水提法、醇提法、微波辅助提取、超声辅助提取、酶法、超临界萃取和其他新方法[11-19]。为了给长沙青皮竹叶中黄酮类化合物的进一步研究提供参考依据,文中采用正交试验设计法,就乙醇浓度、提取次数、提取时间和固液比例等提取工艺条件对黄酮得率的影响情况进行了试验研究,并采用紫外分光光度法对黄酮类化合物进行了量化分析,以期为长沙青皮竹的加工利用提供必要的技术支持。
1 材料与方法
1.1 材料与试剂
供试的长沙青皮竹、毛竹、假毛竹、斑竹、水竹和琴丝竹叶均于2012年10月采自中南林业科技大学竹园,经晾干、粉碎,过60目筛,密封以备用。对照品芦丁购自湖南省食品药品鉴定研究院。
亚硝酸钠、硝酸铝、氢氧化钠、95%乙醇、石油醚(30~60℃)等试剂均为分析纯。
1.2 仪器与设备
721N型紫外可见分光光度计,上海精密科学仪器有限公司;AUY220型电子分析天平,日本岛津;HH-S1s型恒温水浴锅,金坛市大地自动化仪器厂;SHZ-D(Ⅲ)型真空泵,巩义市予华仪器有限责任公司;旋转蒸发仪,郑州长城科工贸有限公司。
1.3 方 法
1.3.1 芦丁标准曲线
参照文献[20]中的方法并稍加改进,取10.8mg的芦丁溶于100mL的30%乙醇溶液中,得到质量浓度为108mg•L-1的芦丁标准液。分别取 0.0、1.0、2.0、4.0、6.0和8.0mL的芦丁标准液置于6个25mL的容量瓶中,用30%的乙醇溶液稀释至8mL;加入浓度为50g•L-1的NaNO2溶液1mL,静置6min,再加入浓度为100g•L-1的Al(NO3)3溶液1mL,静置6min后再加入40g•L-1的NaOH溶液10mL,最后用30%的乙醇溶液定容,静置10min,在510nm波长处测定吸光度。得到如下芦丁标准方程:

式中:A为吸光度,C为质量浓度(mg•L-1);R2为0.999 9。芦丁乙醇溶液在0.00~34.56mg•L-1的范围内其线性关系良好。
1.3.2 单因素试验方法
采用乙醇为提取剂,以竹叶黄酮得率为指标,考察了乙醇浓度、提取时间、固液比例和提取次数对黄酮得率的影响情况。提取液旋转蒸发浓缩至无醇味,以石油醚多次萃取叶绿素至石油醚无色,取下层液定容。移取一定体积溶液,按照“1.3.1”中说明的方法测定黄酮浓度,计算黄酮得率。各因素平行试验5次,取其平均值。
1.3.3 黄酮浓度及得率的计算
黄酮浓度的计算公式为:

黄酮提取率的计算公式为:

式(1)中:A为吸光度,C表示黄酮的质量浓度(mg•L-1)。式(2)中:C亦为黄酮的质量浓度(mg•L-1),M竹叶为竹叶的质量(mg),V总为粗提液的定容体积,V取为移取用于测定黄酮浓度的粗提液的体积,0.025表示25mL容量瓶的体积(单位为L)。
1.3.4 正交试验设计
在单因素试验基础上,选取乙醇浓度(A)、提取时间(B)、提取次数(C)和固液比(D)作为试验因素,按照如表1的四因素三水平的正交试验方案进行长沙青皮竹叶黄酮提取工艺的优化试验。采用统计分析软件SPSS v19.0对试验结果进行分析,以确定最佳提取工艺。

表1 试验因素与试验水平Table 1 Test factors and levels
1.3.5 6种竹叶中黄酮含量的比较分析
根据正交试验结果,采用优化工艺,对长沙青皮竹、毛竹、假毛竹、斑竹、水竹和琴丝竹这6种竹竹叶中的黄酮类化合物进行提取,测定其中的黄酮浓度,计算并比较竹叶中的黄酮含量,每种竹叶平行测定5次,取其平均值。
2 结果与分析
2.1 单因素试验结果及分析
2.1.1 乙醇浓度对黄酮得率的影响
乙醇浓度对黄酮得率的影响结果见表2。由表2可知,黄酮得率随着乙醇浓度的增加而逐渐增大。当乙醇浓度为70%时,黄酮得率达到最大值;但当乙醇浓度再增大时,黄酮类化合物的提取率反而减小。其原因可能是,乙醇溶液浓度低时,竹叶中醇溶性黄酮分子未被充分提取,故随着乙醇浓度增加所得黄酮得率上升。
2.1.2 料液比对黄酮得率的影响
料液比对黄酮得率的影响结果见表3。当料液比较低时,物料内的黄酮无法被溶剂完全提取,而料液比较高时,杂质含量也会提高,提取剂又不能得到最有效的利用,所以选择适当的料液比对节约资源具有重要意义。由表3可知,当料液比为35∶1时,黄酮得率最大(1.76%);继续增大料液比,黄酮得率却不再继续增加。
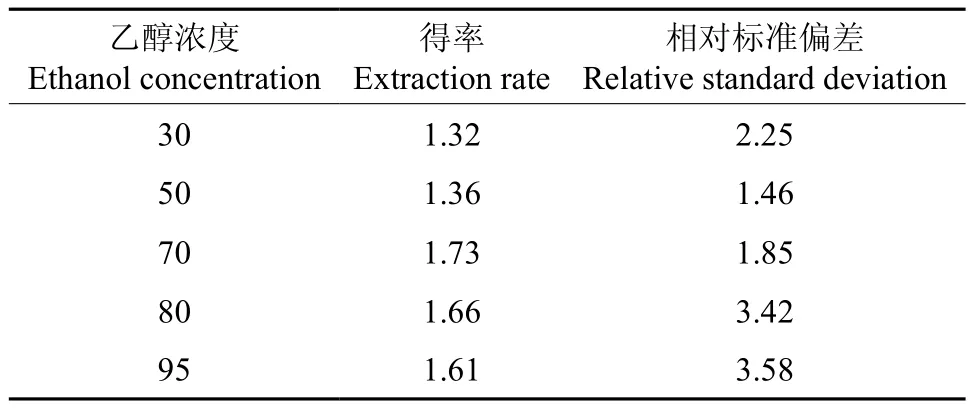
表2 乙醇浓度对黄酮提取率的影响(n=5)Table 2 Effect of ethanol concentration on extraction rate of flavonoids(n=5) %

表3 料液比对黄酮提取率的影响(n=5)Table 3 Effect of solid-liquid ratio on extraction rate of flavonoids(n=5) %
2.1.3 提取次数对黄酮得率的影响
提取次数对黄酮得率的影响结果见表4。在溶液中提取黄酮时,有时需要两次或多次提取才能达到较好的提取效果。由表4可知,提取3次和提取2次的黄酮得率基本不变,说明提取2次时已经达到较好的效果了。这是由于提取1次时,黄酮分子在提取液中基本达到饱和,此时物料与溶液中的黄酮分子达到扩散平衡,物料中的剩余黄酮分子无法被提取完全,故需要提取2次甚至多次。

表4 提取次数对黄酮提取率的影响(n=5)Table 4 Effect of extraction times on extraction rate of flavonoids(n=5)
2.1.4 提取时间对黄酮得率的影响
若提取时间不够,则黄酮可能未被完全浸出。提取时间对黄酮得率的影响结果见表5。由表5可知,提取时间对黄酮提取率的影响不大。当提取时间为1.5h时,提取率为1.54%;继续延长提取时间,黄酮得率略有下降;但总体结果显示,提取时间对黄酮得率的影响不明显。其原因可能是,当固液比较大时,固液接触面的黄酮浓度差大,根据扩散原理,黄酮分子扩散的推动力大,扩散速率快,提取时间则缩短。

表5 提取时间对黄酮提取率的影响(n=5)Table 5 Effect of extracting time on extraction rate of flavonoids(n=5)
2.2 正交试验结果与分析
表6为正交试验结果。

表6 正交试验结果†Table 6 Result of the orthogonal test
从表6中的极差分析结果可以看出:各因素对黄酮提取率的影响有差异,因素A对总黄酮提取率的影响最大,其次为因素C,因素B和D的影响程度基本相同。对试验结果进行方差分析,结果见表7。
从表7的方差分析结果中可以看出,在影响竹叶黄酮提取率的各因素中,因素A具有显著性(F>F0.05),因素B、C和D无显著意义(F<F0.05)。综合考虑单因素的试验效果、方差分析的显著性水平与实际生产时的能源优化,可以得出,提取长沙青皮竹叶中黄酮的最优工艺条件组合为A3B2C1D1,即70%乙醇,按1∶25(g∶mL)的固液比提取3次,每次提取时间为1.5h。在此工艺条件下,平行试验5次,长沙青皮竹叶黄酮的得率为1.85%。
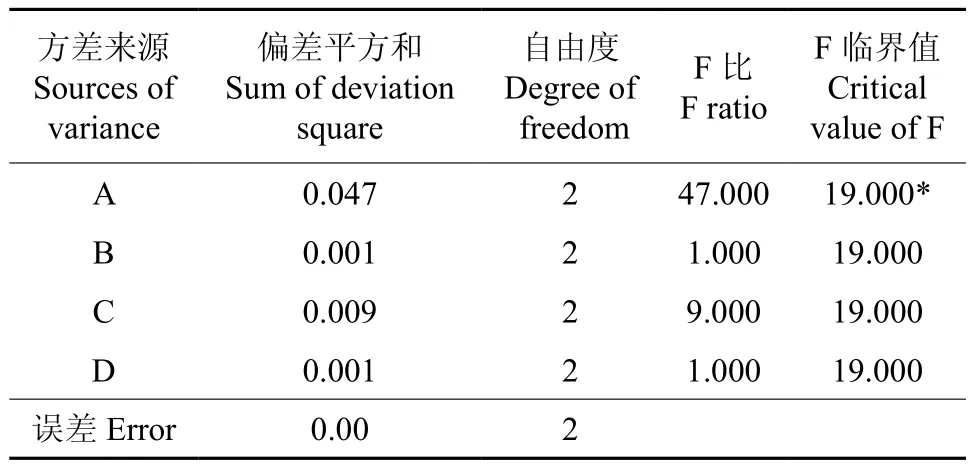
表7 方差分析结果†Table 7 Result of variance analysis
2.3 6种竹叶中黄酮含量的比较分析
根据正交优化结果,采用优化了的工艺条件,对长沙青皮竹、毛竹、假毛竹、斑竹、水竹和琴丝竹6种竹竹叶中的黄酮类化合物进行了提取,并测定了所得黄酮的浓度,计算了竹叶中的黄酮含量,并进行了比较分析。每种竹叶平行测定5次,取其平均值,测定结果见表8。由表8可知,在该工艺条件下所得长沙青皮竹叶的黄酮含量比其他5种竹叶中的黄酮含量要高,说明长沙青皮竹是一种可用以开发竹叶黄酮类产品的潜在原材料。

表8 6种竹叶中的黄酮含量(n=5)Table 8 Flavonoids content in leaves of six bamboo species(n=5)
3 结 论
文中以黄酮得率为考察指标,通过考察乙醇浓度、提取次数、提取时间和固液比例等因素对黄酮得率的影响情况,在单因素试验的基础上,设计了四因素三水平的正交优化试验,最后得到的最佳提取工艺条件为:乙醇的体积分数为70%,固液比为1∶25,提取3次,每次提取时间为1.5h,在此条件下黄酮的得率为1.85%。各因素对提取率的影响程度的大小顺序为:乙醇浓度>提取次数>提取时间≈固液比例。
在上述最佳提取工艺条件下,对6种竹叶中的黄酮进行了提取,测定了其黄酮含量。结果显示,6种竹叶中的黄酮含量为9.1~18.5mg•g-1。长沙青皮竹竹叶的黄酮含量比同时间同地点采摘的毛竹、假毛竹、斑竹、琴丝竹和水竹都要高,比文献[21]中报道的其他竹叶的黄酮含量也要高,说明长沙青皮竹叶作为竹叶黄酮的生产原料具有一定的开发价值。
本试验采用硝酸铝-亚硝酸钠显色法,利用紫外分光广度法在510nm处测定吸光度以确定黄酮含量,其含量与用高效液相色谱法测定的结果具有一定的偏差[22],偏差主要来自非黄酮类物质的显色,但对于酚酸类含量较少的竹叶提取物来说,也不失为一种简单、快捷的黄酮含量的测定方法,这种测定方法适用于工业生产之中[23]。
[1] Ni Q X,Xu G Z,Wang Z Q,et al.Seasonal variations of the antioxidant composition in ground bambooSasa argenteastriatusleaves[J].Int J Mol Sci,2012,13(2):2249-2262.
[2] 唐浩国,魏晓霞,李 叶,等.竹叶黄酮对小鼠脾细胞免疫的分子机制研究[J].食品科学,2007,28(9):523-525.
[3] Chun H,Zhang Y,David D Kitts.Evaluation of antioxidant and prooxidant activities of bambooPhyllostachys nigravar.henonisLeaf extract in vitro [J].J Agric Food Chem,2000,48(8): 3170-3176.
[4] 陆柏益,张 英,吴晓琴.竹叶黄酮的抗氧化性及其心脑血管药理活性研究进展[J].林产化学与工业,2005,25(3):120-124.
[5] 黎继烈,王 卫,曾超珍,等.金橘黄酮提取物对大鼠降血脂功能的影响[J].中南林业科技大学学报,2008,28(5): 89-92.
[6] 陈秋勇,陈炳华,黄志坚.虎尾轮根黄酮类化合物对小鼠肝脏功能的影响[J].生物灾害科学,2012,35(4):385-391.
[7] 罗宇倩,郭 辉,胡林福,等.竹叶黄酮的抗氧化活性研究[J].食品科技,2011,36(7):201-203.
[8] 江慧华,刘俊劭,陈培珍,等.竹叶中黄酮提取分离及抗氧化活性研究[J].湖北农业科学,2012,51(23):51-55.
[9] 李姣娟,周尽花,戴 瑜,等.川桂叶总黄酮清除DPPH·自由基作用的研究[J].中南林业科技大学学报,2010,30(10):125-128.
[10] 罗健夫.湖南观赏竹类植物的园林应用现状及对策[J].世界竹藤通讯,2010,8(1):27-29.
[11] 王婧杰,马凤鸣,穆立蔷.用响应面法优化超声辅助提取紫椴皮中的黄酮[J].经济林研究,2012,30(4):113-118.
[12] 魏玉凤,陈 玮,方 菊,等.纤维素酶法提取竹叶黄酮的传质动力学[J].高校化学工程学报,2013,27(5):780-783.
[13] 张珊珊,王喜平,赵晓红,等.不同浓度乙醇作为夹带剂对超临界CO2提取竹叶黄酮得率的影响[J].食品研究与开发,2011,32(1):57-60.
[14] 孙业良,姜明杉,陈 暄,等.基于响应面分析法对绿茶中黄酮提取工艺的研究[J].经济林研究,2009,27(3):33-37.
[15] 王纯荣,郑国栋,颜贤仔.表面活性剂协同微波提取大豆荚黄酮的研究[J].江西农业大学学报,2011,33(1):151-156.
[16] 龚燕飞,陈建华,吴耀辉.佛肚竹黄酮类物质提取工艺的研究[J].中南林业科技大学学报,2010,30(6):119-122.
[17] 吴耀辉,陈建华,龚燕飞.粉单竹竹叶黄酮提取工艺的初步研究[J].中南林业科技大学学报,2010,30(6):123-126.
[18] 刘巧利,王柳云,严建业,等.山楂中总黄酮和多糖的提取工艺研究[J].中南林业科技大学学报,2010,30(9):162-165.
[19] 曲芬霞,韩彦良.田口方法在竹叶黄酮提取中的应用研究[J].林产工业,2012(2):57-58.
[20] 国家药典委员会.中华人民共和国药典(一部):[M].北京:中国医药科技出版社,2010: 120.
[21] 陈文英,叶建中,王成章,等.高品质竹叶黄酮的筛选及测定方法的比较[J].现代化工, 2008,28(增刊2):355-358.
[22] 郭雪峰.毛竹(Phyllostachys pubescens)与铺地竹(Pleioblastus argenteastriatus)叶黄酮类化学成分及其生物活性的研究[D].北京:中国林业科学研究院,2007.
[23] 旷春桃,李湘洲,汪玉霞,等.大叶冬青叶中总黄酮测定方法和提取工艺[J].食品科学,2009,30(6):49-51.
