芒果总DNA提取方法比较分析
2014-01-22黄国弟唐志鹏李剑雄
张 宇,黄国弟,唐志鹏,李剑雄
(1.广西壮族自治区亚热带作物研究所,广西 南宁 530001; 2.广西大学 农学院,广西 南宁 530004;3.北京市陶然亭公园管理处,北京 100050)
芒果Mangifera indica L.为漆树科Anacardiaceae植物,该科约有70属650种常绿或落叶乔木,原产亚洲东南部的热带地区[1]。从世界范围来看,芒果栽培区域北至我国四川攀西地区和日本南部岛屿,南至非洲南部,横跨于南、北纬30度之间。在我国范围内,芒果在台湾省南部、福建的福州以南、广东(除北部山区外)、海南省、广西的百色至梧州一线以南、云南的南部和西南部以及北部的元谋至四川西昌以南的河谷地区均有分布[2]。芒果新品种的选育是推动芒果产业发展的基础,但由于芒果高度异花授粉,高度杂合,遗传背景基础复杂,常规方法如杂交和实生选种存在占地面积大、选择概率低、成本费用高等问题[2]。分子生物技术克服了传统的常规杂交、实生选种等研究方法的缺陷。而获得高质量的DNA是对芒果开展基因分析和品种鉴定等生物技术研究的基础。目前对芒果进行分子生物学研究的报道不少,如Souza利用RAPD标记技术鉴定了42份芒果资源的起源地[3],Rajwanna等也选用RAPD标记对25份芒果资源进行遗传多样性分析[4],应东山选取ISSR、AFLP组合标记分析78份芒果资源亲缘关系[5],房志超等选用ISSR标记分析了66份芒果资源的性状及遗传关系[6],黄丽芳选用微卫星SSR标记对116份芒果砧木种质资源进行了遗传多样性分析[7],但较详尽获得芒果总DNA提取方法的报道不多。本文旨在通过研究获得提取高质量芒果总DNA的方法,为分子标记辅助选择在芒果育种中得到实际应用打下基础。
1 材料与方法
1.1 材料
供试材料包括紫花芒、四川红芒、实生种、台农1号、金穗芒、金煌芒、四季蜜芒、桂热82、 凯特芒、爱文芒、红芒6号等11个芒果品种,芒果的嫩红色叶片均采自广西大学标本园。分别收集上述品种的叶片各10片,放进冰盒内送入实验室,洗净后选用双蒸水清洁叶片并滤干水分,放入-20℃低温冰箱内待用[8-9]。
1.2 方法
1.2.1 DNA提取液
提 取 液(1)SDS液:4%SDS,pH 7.8的 110mmol/L Tris-HCl,50mmol/L EDTA,0.5mol/L NaCl,3%β-巯基乙醇,4%PVP;提取液(2)氯仿/异戊醇(24∶1);提取液(3)TE高盐:0.8mol/L NaCl,10mmol/L Tris-HCl,0.1mmol/L EDTA;提取液(4)TE:10mmol/L Tris-HCl,1.0mmol/L EDTA;提取液(5)CTAB液(一):3%的CTAB,pH7.8的100mmol/L Tris-HCl,25mmol/L EDTA,1.5mol/L NaCl;提取液(6)CTAB液(二):3%的CTAB,pH7.8的100mmol/L Tris-HCl,25mmol/L EDTA,1.5mol/L NaCl,3%的β-巯基乙醇。
1.2.2 DNA提取步骤
SDS法:参考王家保等人的方法[10],选0.6g鲜样,液氮中研磨成粉末,放入10ml离心管并加入65℃预热的提取液(1)5ml混合,65℃中30min水浴;放入同体积的提取液(2)摇匀,常温11 000r/min,12min离心;在清液中兑入1/10体积5mol/L NaAc与2.5倍体积无水乙醇,-30℃冰箱中放30min,在4℃下11 000r/min 12min离心;留沉淀用75%酒精洗2遍并风干之后用提取液(3)溶解;加入 RNase使浓度为10μg/μL,37℃保持30min;加同体积的提取液(2)混合,在4℃下11 000r/min离心12min;选清液加入-30℃预冷的2倍体积无水乙醇,-30℃沉淀DNA 30min,然后4℃,11 000r/min离心12min;留沉淀75%酒精洗沉淀2遍并风干,然后选100μLTE试剂放入提取液(4)溶解,-30℃保存备用。
CTAB法:参考朱炳耀等人的方法[11-12],选0.6g鲜样,液氮中研磨成粉末,放入10ml离心管;加入65℃预热提取液(5)4ml摇匀,65℃中30min水浴;放入同体积的提取液(2)摇匀,常温下11 000r/min 12min离心;选清液,加1/10体积5mol/L NaAc与2.5倍体积无水乙醇,置冰箱-30℃下沉淀DNA 30min,4℃下11 000r/min离心12min;选沉淀,75%酒精洗沉淀2次,自然风干,用提取液(4)溶解;-30℃下保存。
改良CTAB法:参考文献[13]中的方法,并稍做了修改,取0.5g鲜样,液氮中研磨成粉末,放入10ml离心管;放入65℃预热的4mL提取液(6)摇匀,65℃水浴60min,间隔12min混动1次离心管;放入同体积的提取液(2)摇匀,常温中12 000r/min离心12min;留清液,加1/10体积5mol/L NaAc与2.5倍体积无水乙醇,沉淀DNA。4℃,12 000r/min,离心12min;留沉淀,选75%酒精净化沉淀3次,风干后用提取液(3)500μL溶解;加入 RNase使浓度为10μg/μL,37℃中恒温30min;放入同体积的氯仿/异戊醇(24∶1)摇匀,4℃,12 000r/min,离心12min;留上清加同体积的-30℃预冷的异丙醇,-25℃下沉淀DNA30min,4℃,12 000r/min离心12min;留沉淀,用75%酒精净化沉淀2遍,风干并用100μL提取液(4)溶解,-25℃保存。
1.2.3 DNA质量检测及浓度调整
通过紫外分光光度计、凝胶琼脂糖电泳和ISSR扩增检测DNA。用紫外分光光度计测定230nm、260nm及280nm的吸光值,依据OD260计算DNA浓度,1OD等于50μg/ml双链DNA,空白为TE溶液,依据260nm的吸光值分别与280nm和230nm的吸光值的比值OD260/280和OD260/230计算DNA纯度;通过凝胶琼脂糖电泳,吸取7μL稀释20倍的DNA,用1%琼脂糖凝胶,110 V恒压电泳,EB染色、紫外自动成像仪照相观察。参考胡尚力等[14]的方法进行ISSR检测,芒果ISSR反应体系为20μL,含 10×PCR Buffer 2.0μL,10mmol/L 的 dNTPs混合液0.5μL,10mmol/L的引物0.4μL。 1.25 U的含 Mg2+Taq DNA 聚合酶 0.2μL,30ng/μL ddH2O 15.9μL。扩增程序:94℃预变性5min;94℃变性1min,退火1min(不同引物的退火温度不同),72℃延长1min,39个循环;72℃再延长8min;10℃保存。用UBC-857 ISSR引物检验不同DNA模板的PCR效果,产物在1.8%凝胶琼脂糖跑带后于紫外成像仪下观察效果。
2 结果与分析
2.1 紫外分光光度计检测结果
用3种方法提取DNA的结果如表1所示。结果表明,3种方法均可有效获取芒果总DNA,但在纯度和产率上有差异。采用SDS法和改良CTAB法提取的芒果总DNA,其OD260/280比值分别在1.77~1.88和1.81~1.87区间内,表明蛋白质和RNA等大分子物质被去除的比较干净,DNA纯度较高;CTAB法的OD260/280比值在2.01~2.11的区间内,比值大于1.9,说明仍有RNA等大分子残留没有除净;改良CTAB法的OD260/230比值在2.01~2.09的区间内,SDS法OD260/230和CTAB法OD260/230比值分别在1.57~1.95和1.82~1.92区间内,表明改良CTAB法去除小分子、盐和酚类物质等杂质的能力比SDS法和CTAB法更彻底。就总DNA的得率而言,CTAB法获取总DNA得率最高,SDS法获取总DNA得率最低。虽然用改良CTAB法提取DNA的得率不是最高,但它却是从芒果嫩叶中提取到符合纯度标准的总DNA的较好方法。
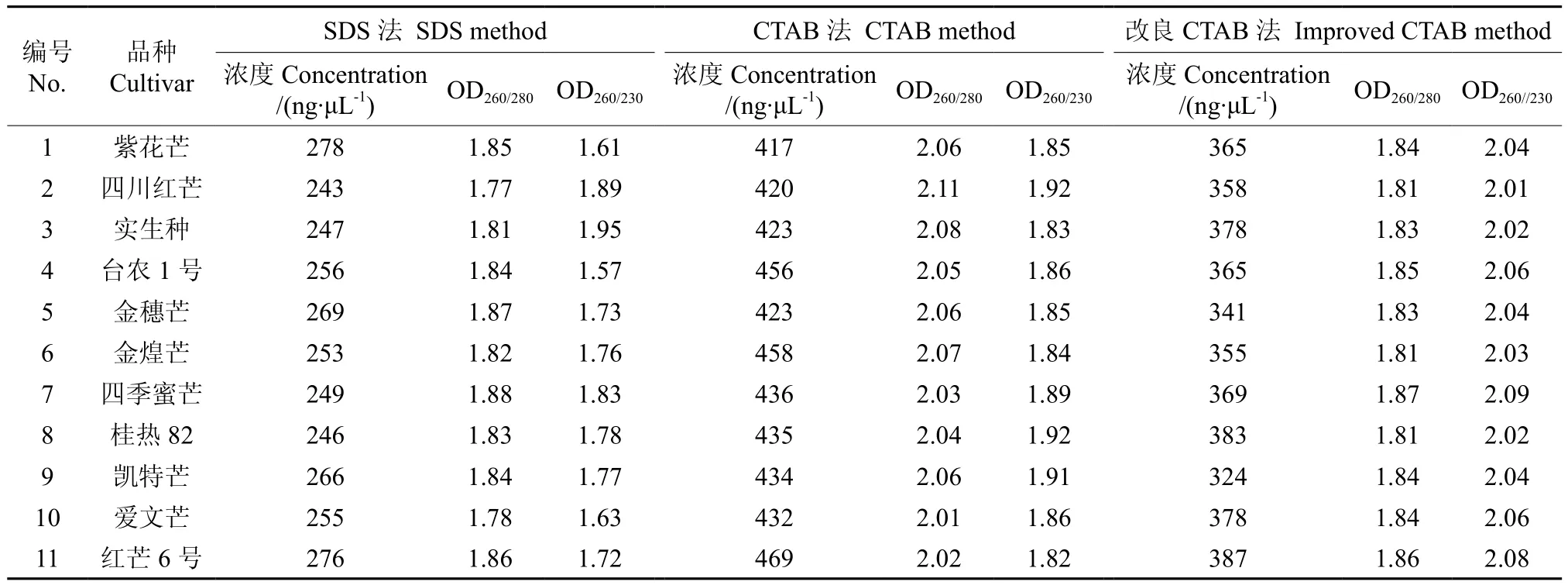
表1 3种方法提取DNA的结果比较†Table 1 Comparison of three DNA extraction methods
2.2 琼脂糖凝胶电泳检测结果
将提取的DNA稀释20倍,取7μL进行电泳,结果如图1所示。由图1可见,由CTAB法获取的DNA,点样区域带有杂样,表明有蛋白质存留,而且还存在少量的RNA,纯度还需精进;由SDS法获取的DNA,点样区域存留较多杂样;由改良CTAB法获取的DNA,条带清晰整洁,表明其质量较高,可用于开展后续的实验。
2.3 ISSR扩增反应检测结果
以分别用SDS法、CTAB法和改良CTAB法获取的总DNA为模板,用UBC-857进行ISSRPCR扩增,结果见图2。由图2可知,SDS法和CTAB法获取的总DNA进行ISSR-PCR缺带现象比较严重,尤其是SDS法扩增出的条带弥散,不能用于ISSR分析;选用改良CTAB法获取总DNA进行ISSR扩增的结果具有丰富的多态性,条带清晰,适合数理分析。对3种提取总DNA的方法进行比较分析,结果显示改良CTAB法提取总DNA的效果最好。
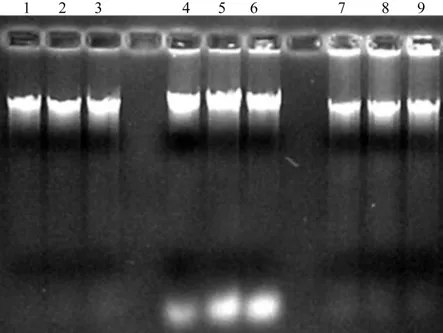
图1 三种方法提取DNA的结果比较Fig.1 Comparison of three DNA extraction methods
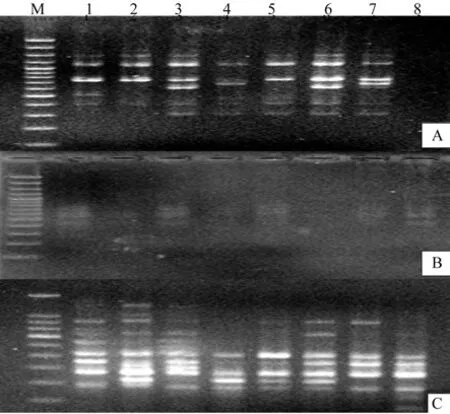
图2 三种方法获取DNA模板的ISSR-PCR电泳图Fig.2 ISSR-PCR electrophoresis results of the DNA templates extracted by three methods
3 讨论与结论
糖类、酚类、蛋白质、单宁及色素等代谢物质是影响提取高质量总DNA的关键因素。芒果为多年生漆树科热带常绿果树,其叶片中的糖类、酚类、蛋白质等物质的含量较高,采用普通的CTAB法和SDS法提取的总DNA效果不理想。在液氮研磨中放入PVP可以络合酚类物质,防止酚类物质氧化物成醌类物质,引起总DNA氧化褐变;β-巯基乙醇能够降解蛋白质,同时抑制多种氧化酶的活性;多糖常与总DNA同时沉淀呈现胶粉现象,影响总DNA纯度与后续实验进展,CTAB与氯仿/异戊醇(24∶1)提取液抽提可有效沉淀除去多糖[15]。改良CTAB法与CTAB法在液氮研磨样品过程中加入PVP充分的络合酚类物质,改良CTAB法与SDS法,加入了RNA降解酶,较好地排除了RNA干扰。SDS法点样孔残留较多的蛋白质,CTAB法极少有蛋白质残留,而改良CTAB法没有蛋白质残留,这也许是由于65℃时CTAB与蛋白质络合,进而较好的抑制了多酚氧化酶的活性。虽然结果显示总DNA产率最高的不是由改良CTAB法所获取的,但电泳图谱显示改良CTAB法所提取的总DNA电泳谱带清晰,无任何杂质残留且谱带无拖尾现象。这可能与最终采用异丙醇沉降总DNA有关,推测异丙醇比无水乙醇更能充分的沉淀芒果叶片总DNA。将三种方法提取的总DNA通过ISSR扩增显示,改良CTAB法提取的总DNA的扩增效果图谱清晰、多态性高;而CTAB法和SDS法提取总DNA的扩增结果出现模糊和缺带现象。实验所选用的3种方法都能提取出芒果总DNA,但各种方法提取的总DNA的产量和纯度存在差异。其中改良CTAB法能够较好地除去多糖、多酚及蛋白质等杂质,提取的DNA纯度最高,产量也较理想,可以获得高质量的芒果总DNA,能用于下一步开展分子生物学研究的相关工作。
[1] 马蔚红,雷新涛,臧小平.芒果无公害生产技术[M].北京:中国农业出版社,2002.
[2] 张 宇.ISSR分子标记对芒果实生苗亲本鉴别和不同颜色类群遗传多样性分析的研究[D].南宁:广西大学,2009:28.
[3] Souza I G B,Valente S E S,Britto F B,et al.RAPD analysis of the genetic diversity of mango(Mangifera indicaL)germplasm in Brazil [J].Genetics and Molecular Research,2011,10(4):3080-3089.
[4] Rajwanna I A,Tabbasam N,Malik A U,et al.Assessment of genetic diversity among mango(Mangifera indicaL)genotypes using RAPD markers[J].Scientia Horticulturae,2008,117(3):297-301.
[5] 应东山.78份芒果种质指纹图谱构建[D].海口:海南大学,2012: 1-71.
[6] 房志超.66份芒果种质性状评价及亲缘关系的ISSR分析[D].海口:海南大学,2011:1-62.
[7] 黄丽芳.芒果主产区砧木种质资源遗传多样性SSR标记研究[D].海口:海南大学,2010:51.
[8] 张丽杰,王玉霞,郜亚婷,等.平邑甜茶基因组DNA提取方法的比较[J].经济林研究.2012.30(1):114-117.
[9] 原勤勤,文亚峰,刘 儒,等.枣优良品种亲缘关系的ISSR分析[J].经济林研究,2012,30(1):56-61.
[10] 王家保,王令霞,杜中军,等.部分芒果品种亲缘关系的ISSR分析[J].园艺学报,2007,34(1):87-92.
[11] 朱炳耀,杨志敏,庄志鸿,等.不同区域小油桐种质差异与ISSR分子标记研究[J].中南林业科技大学学报,2013,33(4):13-16.
[12] 姚 宇,张含国,张 振,等.去劣疏伐对长白落叶松初级无性系种子园SSR遗传多样性的影响[J].中南林业科技大学学报,2013,33(3):40-46.
[13] 郭永泽.芒果ISSR标记及其优良单株的早期鉴定[D].南宁:广西大学,2007:29.
[14] 胡尚力,徐刚标,梁 艳,等.伯乐树cpDNA-PCR反应体系的优化与引物筛选[J].中南林业科技大学学报,2013,33(7):67-71.
[15] 李雪萍,苗昌盛,朱恩作,等.野生濒危掌叶木SRAP-PCR体系的建立与优化[J].中南林业科技大学学报,2013,33(9):18-21.
