西藏牦牛mtDNA ND6遗传多样性及系统进化分析
2014-01-20柴志欣张成福信金伟姬秋梅曾贤彬钟金城
海 汀,柴志欣,张成福,信金伟,姬秋梅,曾贤彬,钟金城*
(1.西南民族大学动物遗传育种学国家民委/教育部重点实验室,四川成都610041;2.西藏自治区农牧科学院畜牧兽医研究所,西藏拉萨850000)
牦牛(Bos grunniens)享有“高原之舟”和“全能家畜”的美誉,是西藏高山草原的主体畜种,主要分布于喜马拉雅山脉和青藏高原。牦牛是经长期自然选择和人工选择形成的特有牛种,在遗传上是一个宝贵的基因库[1-2]。西藏自治区是牦牛的主产地之一,现有牦牛500余万头,占全国牦牛总数的29%以上。生态环境和地理条件的差异使西藏牦牛形成了多个特有的地方品种或类群,遗传资源极其丰富[3]。我国针对牦牛的科学研究始于20世纪60年代,学者们利用形态遗传标记、细胞遗传标记、生化遗传标记和分子遗传标记等技术对牦牛品种的遗传多样性及分类进行了广泛深入的研究,取得了阶段性的成果[4]。
动物线粒体DNA(mitochondrial DNA,mtDNA)是核外遗传物质,没有经过基因重组,分子各部分共享同一祖先相同历史模式[5-6],在研究物种起源、演化和分类中是理想的分子遗传标记[7]。近年来,对西藏牦牛线粒体DNA 的研究多集中于Dloop区、细胞色素c氧化酶基因(cox)、细胞色素b基因(cytb)等,利用NADH 脱氢酶基因研究西藏牦牛相对较少。在NADH 脱氢酶中,mtDNA ND6基因片段短、进化速度适中、序列变异丰富,适合研究物种的系统进化关系[8]。目前,利用ND6基因对西藏牦牛的遗传多样性和系统进化的研究尚未见报道。本研究通过对西藏15 个牦牛类群mtDNA ND6基因序列多态性研究,分析西藏牦牛遗传多样性及其类群间的亲缘关系,以期为西藏牦牛类群的界定提供一定的分子遗传标记依据。
1 材料与方法
1.1 试验动物
从15个西藏牦牛类群中,各选取成年健康牦牛10头,共150头(表1),采集耳组织,75%乙醇保存带回实验室,于-80 ℃保存备用。
1.2 基因组DNA 的提取及检测
用动物组织基因组DNA 提取试剂盒(TianGen生物技术公司)提取基因组DNA,1%的琼脂糖凝胶电泳和紫外分光光度计双重检测DNA 的纯度和浓度,-20 ℃保存备用。
1.3 引物设计与PCR 扩增
根据GenBank中公布的牦牛线粒体全基因组序列(NC_006380.3)中的mtDNA ND6基因核苷酸序列,用Primer Premier5.0 设计引物:F:5′-CCCCTCAAACGCCTTCAAA-3′,R:5′-GCGACCGAAGTTTCACCA-3′(引物由上海英俊生物技术公司合成)。PCR 总反应体系为25μL,其中,上、下游引物各1μL(10pmol·μL-1),DNA 模板1μL(200~600ng·μL-1),Ex Taq DNA 预混酶12.50 μL(0.625U),灭菌ddH2O 9.50μL。PCR 扩增的反应条件:94℃预变性4min;94℃变性45s、56.3℃退火30s、72℃延伸1min 30s,共30个循环;72℃延伸10min,4 ℃保存。
1.4 目的基因测序
PCR 扩增后,其产物在1.3%的琼脂糖凝胶(含GlodView 核酸染料)电泳分离,PCR 产物经胶回收试剂盒(OMEGA)回收、纯化后,进行正反双向测序。
1.5 分析方法和软件
用DNAMAN 软件对150头西藏牦牛的mtDNA ND6基因全序列进行校对,用ClustalX1.83软件进行比对,用MEGA5.0软件统计mtDNA ND6基因全序列的碱基组成,计算类群间遗传距离并以非加权平均值法(Unweighted Pair Group Method with Arithmetic means,UPGMA)构建品种间聚类关系;用DnaSP5.0软件分析多态位点、核苷酸多样性以及单倍型多样性。
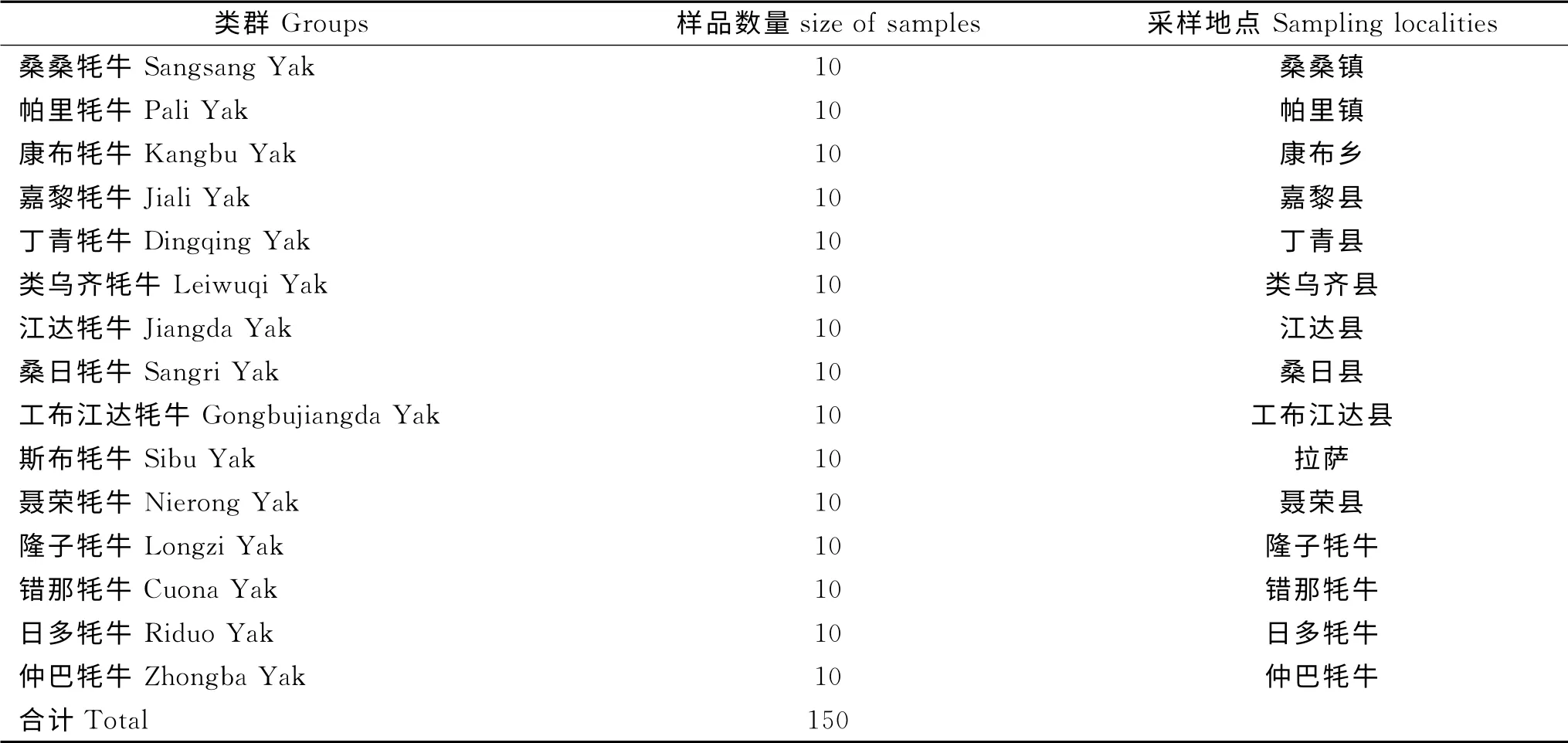
表1 供试牦牛类群、数量及采样地点Table 1 Tibetan yak sampling details
2 结果与分析
2.1 西藏牦牛mtDNA ND6基因的序列多态性
本研究中,西藏牦牛15个类群的150个个体的mtDNA ND6 基因全序列经对位排列,长度均为528bp,起始密码子为AUG(ATG),终止密码子为UAA(TAA),基因间没有内含子,编码175个氨基酸。T、C、A 和G 4 种碱基的平均比例分别为42.2%(40.9%~42.4%)、7.6%(7.4%~8.7%)、20.9% (20.6% ~22.2%)、29.3% (28.2% ~29.5%),A+T 含量(63.1%)显著高于G+C 含量(36.1%),表明西藏牦牛富含碱基A 和T。
西藏15个牦牛类群的序列多态性见表2,从西藏15个牦牛类群内分析,类乌齐牦牛的多态位点最多为38个,其中单态突变位点36个,简约信息位点2个,类乌齐牦牛的多态性较其他牦牛类群丰富。从西藏15个牦牛类群间分析,在全序列中共发现41 个多态位点,多态位点百分率(percentage of polymorphic sites)为7.76%,其中单态突变位点37个(位于25、30、36、39、45、54、93、120、132、135、147、150、154、159、162、168、186、198、228、237、243、249、280、303、312、321、333、336、339、343、378、390、405、414、432、453、486位碱基处),约占多态位点总数的90.24%,简约信息位点4个(位于51、69、297、327位碱基处),约占多态位点总数的9.76%,群体间多态性较为贫乏。序列变异中存在转换、颠换2种核苷酸变异类型,其中转换37 次,颠换2 次,转换/颠换(Ts/Tv)比为18.5:1,表明西藏牦牛核苷酸多态位点的变异主要是以转换为主。在转换变异类型中,A→G 转换次数最多为23次,约占转换总次数的58.97%,C→T 转换次数最少为6次,约占转换总次数的16.22%。

表2 西藏15个牦牛类群mtDNA ND6的序列多态性位点Table 2 MtDNA ND6gene sequence polymorphisms sites of 15breeds of Tibetan yaks
本研究中根据西藏15个牦牛类群的150个个体的序列,共定义出7种单倍型(表3),其中Hap_1为共享单倍型,在西藏15个牦牛类群中均有发现,Hap_1 为西藏牦牛类群的主流单倍型。其余6 种单倍型为部分类群所特有,其中Hap_2 共出现19次,分布于丁青牦牛、工布江达牦牛、江达牦牛、类乌齐牦牛、隆子牦牛、聂荣牦牛、帕里牦牛、桑日牦牛,Hap_4共出现5次,分布于聂荣牦牛、帕里牦牛、康布牦牛、错那牦牛,Hap_3、Hap_5、Hap_6、Hap_7均只出现1次,分布于康布牦牛、丁青牦牛、工布江达牦牛、类乌齐牦牛,各类群间单倍型的类型和数目存在一定差异。
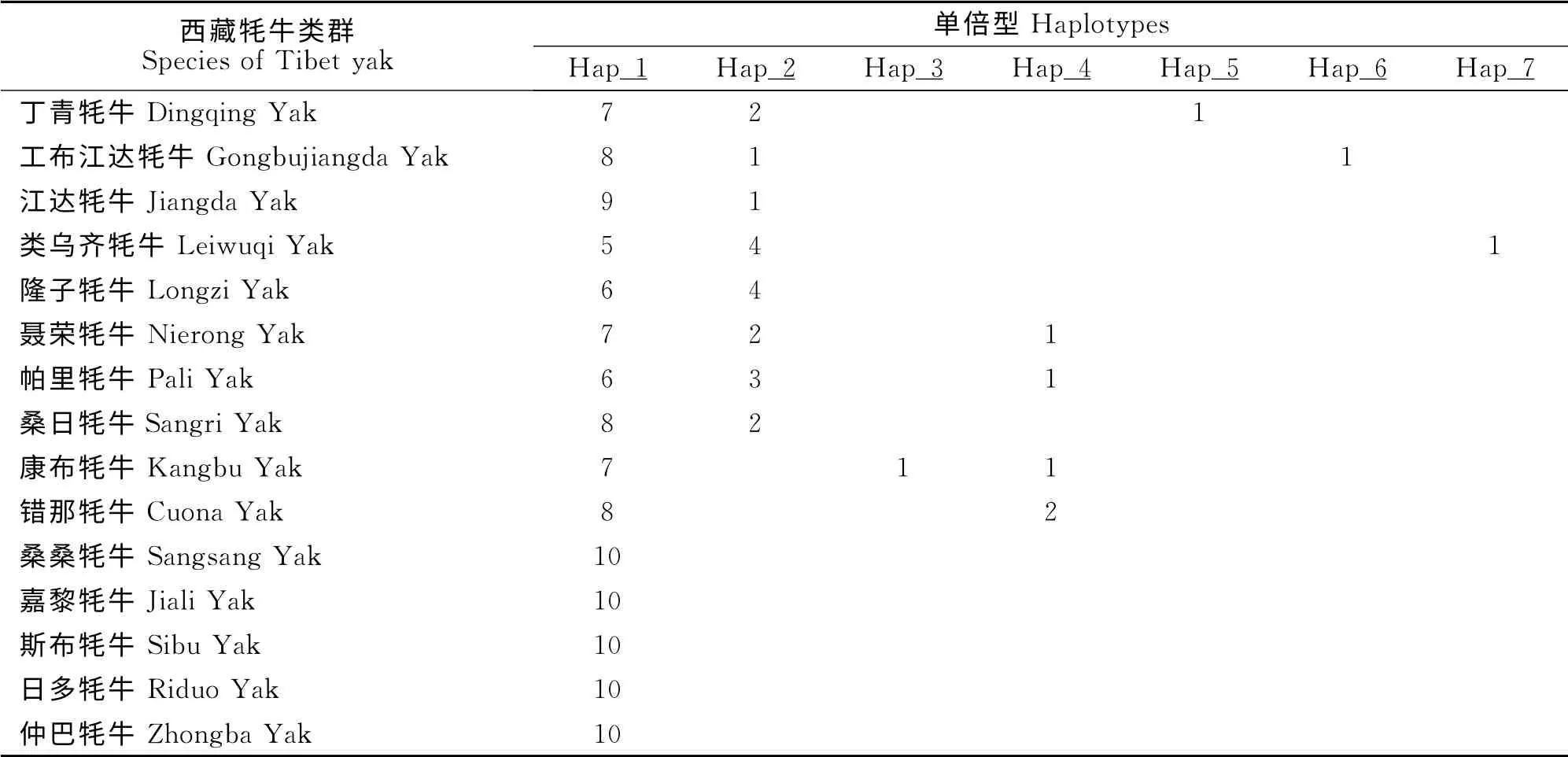
表3 西藏15个牦牛类群mtDNA ND6的单倍型Table 3 MtDNA ND6gene haplotypes of 15breeds of Tibetan yaks
2.2 西藏牦牛mtDNA ND6基因的遗传多态性
对西藏15个牦牛类群的150个个体的单倍型多样性和核苷酸多样性进行分析(表4),结果表明,平均单倍型数(H)、平均单倍型多样性(Hd)和平均核苷酸多样性(Pi)分别为2.0667、0.2978、0.00191。西藏15个牦牛类群的单倍型多样性的变化范围在0~0.644之间,核苷酸多样性的变化范围在0~0.01566之间,单倍型多样性和核苷酸多样性的结果变化有较强相关性。类乌齐牦牛的单倍型多样性和核苷酸多样性均最高,分别为0.644、0.01566,嘉里牦牛、斯布牦牛、桑桑牦牛、仲巴牦牛、日多牦牛的单倍型多样性和核苷酸多样性最低,均为0,结果表明,除类乌齐牦牛外,西藏其他牦牛类群的单倍型多样性和核苷酸多样性较贫乏。
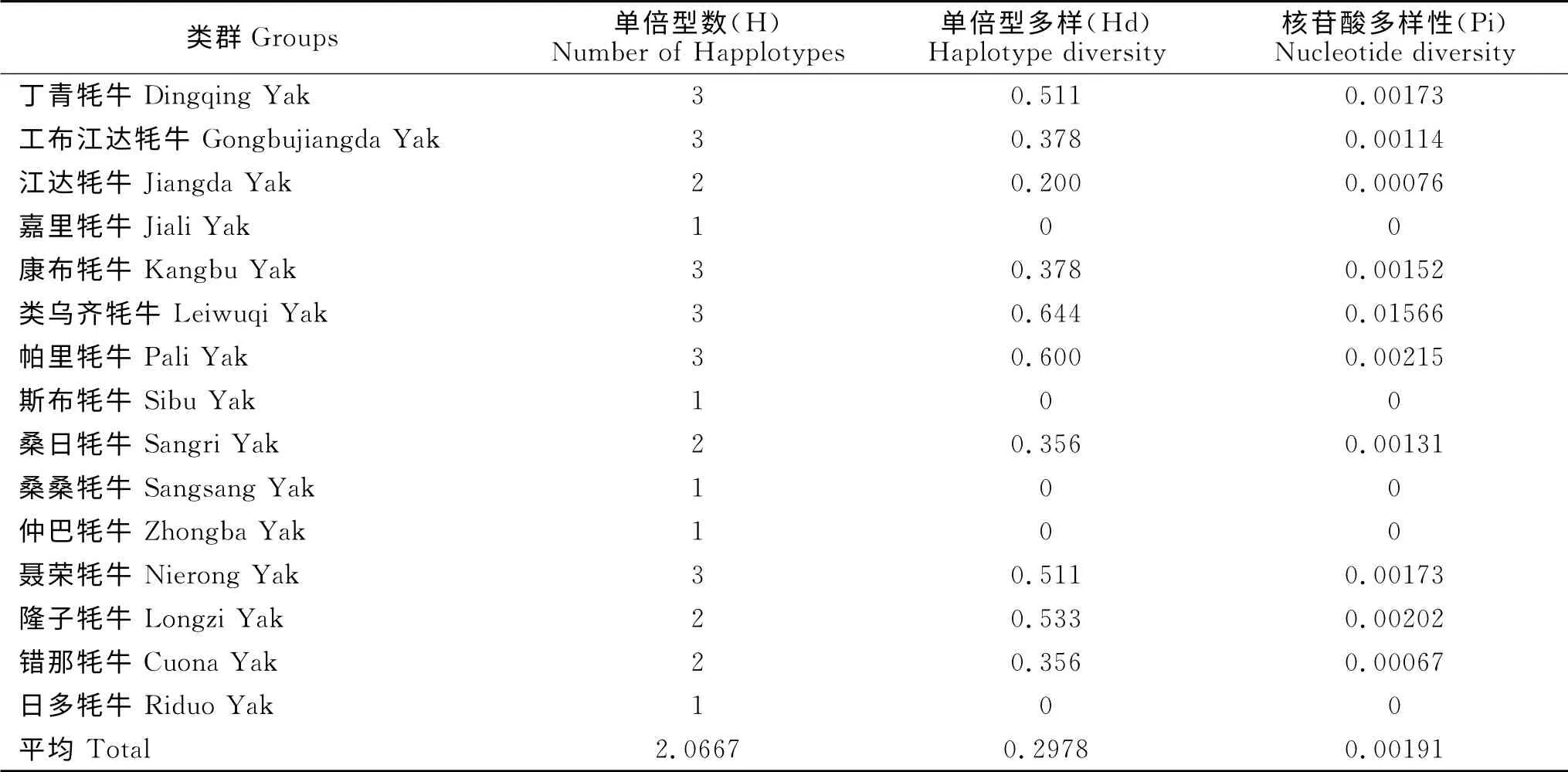
表4 西藏牦牛mtDNA ND6的单倍型多样性、核苷酸多样性和个体间的遗传距离Table 4 Haplotype diversity,nucleotide diversity and genetic distance of Tibet yaks
2.3 西藏牦牛类群间的遗传距离和聚类分析
用Mega5.0软件对西藏15个牦牛类群的分子遗传距离进行计算(表5),结果表明,西藏15个牦牛类群间的遗传距离的变化范围在0~0.009247之间,其中仲巴(ZB)牦牛、桑桑(SS)牦牛、斯布(SB)牦牛、日多(RD)牦牛、嘉里(JL)牦牛之间任意两个的遗传距离均为0,类乌齐(LWQ)牦牛与帕里(PL)牦牛的遗传距离最大为0.009247,类乌齐牦牛与其他牦牛类群的遗传距离的差异显著高于其他牦牛类群间的差异。

表5 基于mtDNA ND6基因的西藏牦牛类群间的Kimura 2-parameterTable 5 Kimura-caculated genetic distance between Tibetan yaks based on mtDNA ND6gene (10-3)
根据mtDNAND6基因的遗传距离,用非加权平均值法(UPGMA)对西藏牦牛15个牦牛类群进行聚类分析(图1),结果表明日多牦牛、嘉里牦牛、斯布牦牛、桑桑牦牛、仲巴牦牛、错那牦牛先聚为一类,然后再依次与江达牦牛、桑日牦牛、康布牦牛、工布江达牦牛、聂荣牦牛、丁青牦牛、帕里牦牛、隆子牦牛相聚,最后才与类乌齐牦牛相聚。
2.4 西藏牦牛类群的单倍型系统进化分析
根据西藏15个牦牛类群的7种单倍型序列,用非加权平均值法(UPGMA)构建单倍型系统发育树(图2)。结果表明,系统发育树分为两支,其中Hap_7单独聚为一类,仅包括类乌齐牦牛;其余单倍型序列聚为一类,包括西藏15个牦牛类群,可以看出西藏牦牛有两个母系起源。

图1 西藏15个牦牛类群间的UPGMA 分子聚类关系图Fig.1 UPGMA dendrogram of 15Tibetan yak populations
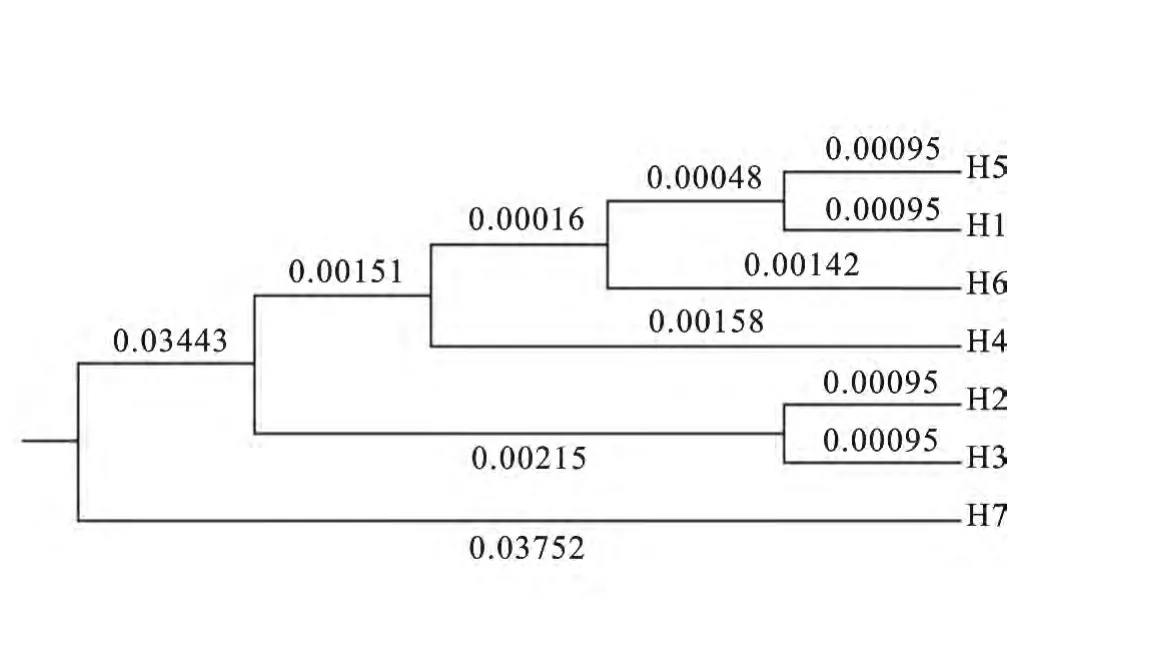
图2 西藏牦牛类群的单倍型系统发育UPGMA 树Fig.2 UPGMA tree of haplotypes phylogenetic of Tibetan yaks
3 讨论
3.1 西藏牦牛类群的序列多态性
本试验对西藏牦牛mtDNAND6 基因进行了研究,发现基因全序列长度均为528bp,个体间无序列长度差别,这与童晓梅[10]、陈晓芳[11]对藏鸡和鸟类的mtDNAND6基因研究结果有一定差异,可能是不同物种间线粒体基因的一级结构并不完全相同[6]。通过对西藏15个牦牛类群的150个个体的mtDNAND6基因序列进行分析比较,共发现了7种单倍型,41 个变异位点,其中单态突变位点37个,简约信息位点4个,群体间多态性较贫乏。这与张成福等[12]对西藏11 个牦牛类群114 个个体的mtDNAD-loop区的研究结果差异较大,而与赵上娟[13]等对西藏11 个牦牛类群的mtDNACOⅢ基因的测序分析结果相近,这可能是因为mtDNADLoop区是mtDNA 基因组中进化速率最高、最具多态的区域[14],而mtDNAND6基因与mtDNACOⅢ基因的进化速率相当。本试验中,存在转换、颠换2种核苷酸变异类型,其中转换37次,颠换2次,转换(Ts)和颠换(Tv)的比值R 为18.5,表明西藏牦牛具有较强的转换偏倚性。黄原[15]认为如果R 大于2,说明序列替换远未达到饱和。因此推测,随着分歧时间的增加,西藏牦牛mtDNAND6基因序列中颠换数会增加,转换偏倚会下降。
3.2 西藏牦牛类群的遗传多态性
生物多样性是人类社会赖以生存和发展的基础,遗传多样性是生物多样性的重要组成部分,因此对动物遗传多样性的合理开发和可持续利用显得尤为重要[16]。西藏牦牛养殖数量占全国牦牛总数的三分之一,西藏牦牛遗传多样性的研究对藏区人民的生产、生活影响深远。通常认为,群体中的单倍型多样性(Hd)和核苷酸多样性(Pi)是衡量一个群体线粒体DNA 变异程度的两个重要指标,Hd值和Pi值与遗传多样性呈正相关[17]。本研究中,西藏15个牦牛类群平均单倍型多样性(Hd)和平均核苷酸多样性(Pi)分别为0.2978、0.00191,说明总体上西藏牦牛mtDNAND6基因遗传多样性较低。这可能是因为mtDNAND6基因编码蛋白,受到选择压力大,进化速度慢,变异性小[18]。但在西藏15个牦牛类群中,类乌齐牦牛无论是单倍型多样性(Hd)还是核苷酸多样性(Pi)均显著高于其他牦牛类群,遗传多样性最丰富,同时类乌齐牦牛也是本研究中多态位点最多的类群。这可能是因为类乌齐位于西藏东部,交通便利,与周边地区交流频繁,随着各民族的迁移、融合,导致类乌齐牦牛与各牦牛类群间基因交流增多。此外,本研究中根据西藏15个牦牛类群的150个个体的序列,共定义出7种单倍型。从单倍型分布情况来看,6种单倍型类型为部分牦牛类群所特有,因此在商品生产或者育种工作中,应防止盲目杂交,避免某些优良基因的丢失,同时各级职能部门应加大投入,建立合理的育种制度,以保持西藏牦牛的遗传多样性[19]。
3.3 西藏牦牛类群的遗传分化和系统进化
对西藏牦牛正确的分类一直是学者们在牦牛研究中的重点和热点。李铎等[3]利用微卫星标记将西藏11个牦牛类群分为3类,即嘉黎牦牛、帕里牦牛、桑桑牦牛、巴青牦牛、类乌齐牦牛、康布牦牛聚为一类,斯布牦牛、工布江达牦牛、桑日额牛、江达牦牛聚为一类,丁青牦牛单独成为一类。柴志欣等[4]利用RAPD 标记将西藏11个牦牛类群分为2类,即帕里牦牛(PL)为一类,其余10 个牦牛类群为另一类。本研究根据西藏牦牛mtDNAND6基因的遗传距离,用非加权平均值法将西藏15个牦牛类群分为两类,即类乌齐牦牛聚为一类,其他牦牛类群聚为一类。这种分类结果不一致可能是因为样本数多少和研究手段不同造成。
近年来,多位学者对西藏牦牛的母系起源进行了研究。钟金城等[20]通过RAPD 标记分析得西藏牦牛可能有2个母系起源,张成福等[12]也支持这一观点。本研究中,从单倍型的系统发育分析表明,西藏牦牛类群可能有2个母系来源,支持钟金城的观点。但这还不能完全证明西藏牦牛的起源问题,要彻底弄清楚西藏牦牛的起源演化,尚需借助其他分子标记技术以及进一步扩大样本进行研究。
[1]Wiener G,Han J L,Long R J.The yak[M].2nd ed.Bangkok:The Regional Office for Asia and the Pacific,Food and Agricul-ture Organization of the United Nations,2003.
[2]Cai L,Wiener G.The yak[M].Bangkok:The Regional Office for Asia and The Pacific Food and Agriculture Organization of the United Nations,1995.
[3]李 铎,柴志欣,姬秋梅,等.西藏牦牛微卫星DNA 的遗传多样性[J].遗传,2013,35(2):175-184.
[4]柴志欣,赵上娟,姬秋梅,等.西藏牦牛的RAPD 遗传多样性及其分类研究[J].畜牧兽医学报,2011,42(10):1 380-1 386.
[5]Xia De-Quan,Wang Wen-Jun.The study of animal mitochondrial DNA and its application on fish population genetic structure[J].Journal of Fisheries China,1998,22(4):364-369.
[6]涂正超.动物线粒体DNA 多态性及其在畜牧科学中的应用[J].黑龙江畜牧兽医,1994,12:38-40.
[7]Bruford M W,Bradley D G,Luikart G.DNA markers reveal the complexity of livestock domestication[J].Nature Reviews Genetics,2003,4(11):900-910.
[8]Moum T,Willassen N P,Johansen S.Intragenic rearrangements in the mitochondrial NADH dehydrogenase subunit 6 gene of vertebrates[J].Curr Genet.1994,25(6):554-557.
[9]Moum T,Johansen S.The mitochondrial NADH dehydrogenase subunit 6(ND6)gene in Murres:relavance to phylogenetic and population studies among birds[J].Genome,1992,35:903-906.
[10]童晓梅,梁 羽,王 威,等.藏鸡线粒体全基因组序列的测定和分析[J].遗传,2006,28(7):769-777.
[11]陈晓芳,王 翔,袁晓东,等.ʂ形目15种鸟类线粒体ND6基因序列差异及其系统进化关[J].动物学报,2003,49(1):61-67.
[12]张成福,徐利娟,姬秋梅,等.西藏牦牛mtDNA D-loop区的遗传多样性及其遗传分化[J].生态学报,2012,32(5):1 387-1 395.
[13]赵上娟,陈智华,姬秋梅,等.西藏牦牛mtDNA COⅢ全序列测定及系统进化关系[J].中国农业科学,2011,44(23):4 902-4 910.
[14]姜雪鸥,杨 鹰,万 洁,等.攀西黑山羊mtDNA D-loop区的遗传多样性研究[J].东北农业大学学报,2013.44(9):23-29.[15]黄 原.分子系统学-原理、方法及应用[M].北京:中国农业出版社,1998.
[16]刘靖闻.甘南州藏猪遗传多样性及起源研究[D].甘肃兰州:甘肃农业大学,2012.
[17]江 昱,王 杰,金鑫燕.不同四川黑山羊品种mtDNA Dloop区的遗传多样性分析[J].安徽农业科学,2010,38(27):15 052-15 054.
[18]卢永芳,菜治华,李 强,等.江淮水牛线粒体D-loop 区和Cytb基因遗传多样性及系统发育分析[J].畜牧兽医学报,2012,43(5):701-707.
[19]钟金城,柴志欣,姬秋梅,等.西藏牦牛的遗传多样性及其系统进化研究[J].西南民族大学学报:自然科学版,2011,37(3):368-378.
