乳源酪蛋白糖巨肽对结肠癌HT-29细胞中COX-2、iNOS、GST-π表达的影响
2014-01-18曹江鸣陈庆森阎亚丽庞广昌
曹江鸣,陈庆森*,阎亚丽,庞广昌
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学 院,天津 300134)
乳源酪蛋白糖巨肽对结肠癌HT-29细胞中COX-2、iNOS、GST-π表达的影响
曹江鸣,陈庆森*,阎亚丽,庞广昌
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学 院,天津 300134)
目的:研究乳源酪蛋白糖巨肽(casein glycomacropeptide,CGMP)对人结肠癌HT-29细胞增殖及细胞中环氧合酶-2(cyclooxyenase-2,COX-2)、诱导性一氧化氮合酶(induc ible nitric oxide synthase,iNOS)及谷胱甘肽-S-转移酶π(glutathione-S-transferase π,GST-π)表达的影响,为探讨CGMP作为功能性食品提供可靠的依据。方法:采用噻唑蓝(methyl thiazolyl tetrazolium,MTT)实验测定不同剂量CGMP作用12、24、48 h对结肠癌HT-29细胞增殖的抑制情况;在不同剂量CGMP作用HT-29细胞24 h后,通过逆转录聚合酶链反应扩增细胞中提取的COX-2 mRNA、iNOS mRNA、 GST-π mRNA,用凝胶成像自动分析系统检测各扩增带COX-2 mRNA、iNOS mRNA、GST-π mRNA水平。结果:1)CGMP组对细胞的增殖均有抑制作用,其中10-4mg/mL抑制效果最强,且呈现时间依赖性。2)低剂量的CGMP(10-5、10-4、10-3mg/mL)可显著降低3 种基因的表达。结论:CGMP可在一定程度上抑制HT-29细胞的增殖,并呈时间依赖性,同时 CGMP能在mRNA水平上抑制COX-2、iNOS、GST-π的表达,进而降低3 种基因蛋白的表达,从而进一步改善结直肠癌。
乳源酪蛋白糖巨肽;HT-29细胞;COX-2;iNOS;GST-π
结直肠癌(colorectal carcinoma,CRC)是人类常见的消化道恶性肿瘤之一,全球范围内,其在男性的发病率位于恶性肿瘤的第三位,女性的发病率位于第二位[1]。在我国结直肠癌的发病率和死亡率在癌症中均列为第3~5位,并有逐年增加的趋势[2],已严重威胁着人们的健康。近年来,大量的流行病学和研究结果证实了环氧合酶-2(cyclooxyenase-2,COX-2)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)及胱甘肽-S-转移酶π(glutathione-S-transferase π,GST-π)与结直肠癌的发生、发展有密切的关系,这3 个基因在绝大多数结直肠癌患者中呈现高表达[3-5],COX-2和iNOS在组织分布、作用机制等方面共同参与许多生理病理过程,协同发挥作用,COX-2及iNOS诱导的NO参与了肿瘤的增殖、转移及侵袭[6-8],而GST-π是CRC的一种多药耐药基因,与肿瘤细胞的耐药性有关[5]。
酪蛋白糖巨肽(caseinoglycomacropeptide,CGMP)是由Delfour等[9]于1965年发现的一种含有唾液酸的生物活性肽,经凝乳酶水解κ-酪蛋白的105苯丙氨酸106甲硫氨酸之间的肽键而生成的不溶性副酪蛋白(肽链的1~105部分)和12%的三氯乙酸(trichloroacetic acid,TCA)可溶性的亲水多肽(肽链的106~169部分)两部分通常此可溶性多肽含有较多的糖链,被称为“糖巨肽”,而由酪蛋白来源的此类肽都统称为“酪蛋白糖巨肽(CGMP)”。研究表明,其具有诸多的生物学活性,如抑制细菌和病毒的黏附、抑制流感病毒红细胞凝集素、促进双歧杆菌增殖、调节免疫系统、抗炎等[10-12]。本实验室也通过其 改善、缓解炎症性肠病证实了它的抗炎活性[13]。但目前还未见有其对结肠癌细胞中的肿瘤标志物的COX-2、iNOS、GST-π基因表达影响的研究。本研究就从这3 种高表达基因入手,探讨CGMP在结肠癌细胞中的抗炎作用。
1 材料与方法
1.1 材料与试剂
HT-29细胞 江苏齐氏生物科技有限公司;血清(fetal bovine serum,FBS) 美国Gibco公司;DMEM高糖培养基 美国Hyclone公司;CGMP 新西兰Tatua公司;Tri zol 美国Invitrogen公司;反转录试剂盒#K1622 美国Thermo公司。
1.2 仪器与设备
HERAcell 240iCO2培养箱 美国Thermo公司;DS-5MC倒置显微镜 日本Nikon公司;SpectraMax M5多功能读板机美国 Molecular Devices公司;UV2550紫外-可见分光光度计 日本岛津公司;TC-96/G/H(b)APCR仪 杭州博日公司;Gel doc XR凝胶成像系统美国Bio-Rad公司;DYCP-31B水平电泳槽、电泳仪 北京六一仪器厂。
1.3 方法
1.3.1 HT-29细胞培养及分组
人结直肠癌细胞系HT-29于10%胎牛血清、青霉素(100 U/mL)和链霉素(100 U/mL)的DMEM培养基中,置于37 ℃、5% CO2培养箱内进行培养。待细胞对数期时进行实验。
CGMP溶液的配制:分析天平准确称取10 mg CGMP,用10 øL的DMSO溶解,然后用10 mL的完全培养基溶解,最后进行稀释得到相应的质量浓度。
实验分组:正常对照组(C)、CGMP样品组(M1:10-6mg/mL、M2:10-5mg/mL、M3:10-4mg/mL、M4:10-3mg/mL、M5:10-2mg/mL)。
1.3.2 MTT法检测CGMP对HT-29细胞增殖的影响
取对数生长期细胞,以1×105个/mL的细胞密度,均匀接种于96 孔板,100 øL/孔,常规培养24 h后,弃去原培养液,加入CGMP样品组各100 øL,对照组加相同体积的完全培养基,空白组不加细胞但加相同体积的培养基,每组设6 个复孔,分别培养12、24、48 h后,弃去培养基。根据Mosmann[14]的噻唑蓝(methyl thiazolyl tetrazolium,MTT)方法并略作改动,用DMSO替代酸性异丙醇,通过空白组调零。在490 nm波长处测定吸光度A,实验重复3 次,按式(1)计算细胞生长抑制率。
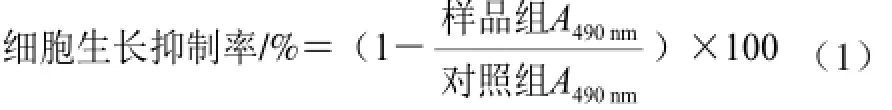
1.3.3 RNA提取
取对数生长期细胞,以1×105个/mL的细胞密度均匀接种于6 孔板内,2 mL/孔,于37 ℃、5% CO2培养箱内培养24 h,细胞进入对数期后弃去原培养液,加入CGMP样品组2 mL,对照组加相同体积的完全培养基,培养箱内培养24 h。采用Trizol裂解细胞、提取总RNA。用1%的琼脂糖凝胶电泳检测RNA的提取的完整性通过A260nm/A280nm检测RNA的纯度并根据式(2)计算出质量浓度。

1.3.4 逆转录聚合酶链反应(reverse transcriptionpolymerase chain reaction,RT-PCR)法检测COX-2、iNOS、GST-π mRNA表达水平
采用反转录试剂盒反转录形成cDNA。在50 øL的PCR反应体系中用正向和反向引物扩增目的基因。反应体系:5 øL 10×PCR buffer、36.75 øL DEPC处理水、4 øL dNTP混合物、正反向引物各1.5 øL、1 øL cDNA及0.25 øL Taq酶。
各基因的引物:COX-2[15](187 bp):正向引物5’-TGAAACCCACTCCAAACACA-3’,反向引物5′-GAGAAGGCTTCCCAGCTTTT-3’;i N O S[16](2 2 1 b p):正向引物5’-AC AG G AG G G G T T A A A G C T G C-3’,反向引物5’-TTGTCTCCAAGGGACCAGG-3’;GST-π[17](169 bp):正向引物5’-CGGAGACCTCACCCTGTA-3’,反向引物5’-CGCCTCATAGTTGGTGTAGA-3’;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)[15](185 bp):正向引物5’-GAGTCAACGGATTTGGTCGT-3’,反向引物5’-GACAAGCTTCCCGTTCTCAG-3’。
PCR扩增程序:94 ℃预变性1 min,94 ℃变性30 s,COX-2、GAPDH:60 ℃退火30 s;iNOS:65 ℃退火45 s;GST-π:58 ℃退火20 s,72 ℃延伸30 s,72 ℃终止延伸5 min。取5 øL PCR扩增产物,经1.5%琼脂糖凝胶电泳,90 V恒压,时间70 min,采用凝胶图像分析软件分析各条带的综合光密度值,以相应的GAPDH的表达量为内参,计算并比较COX-2、iNOS、GST-π mRNA的相对表达量。
1.4 统计学分析
使用SPSS19.0统计软件对实验数据进行分析处理,进行单因素方差分析,处理结果以±s表示,定义P< 0.05为差异显著,有统计学意义。
2 结果与分析
2.1 CGMP对HT-29细胞增殖的影响
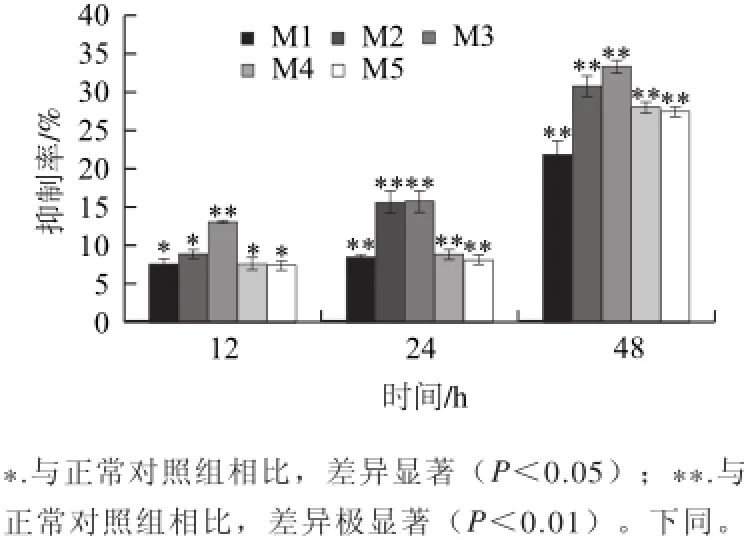
图1 CGMP对HT-29细胞增殖的抑制率Fig.1 Inhibition of different doses of CGMP on HT-29 cell proliferation
由图1可知,正常对照组(C)的抑制率为0。随着作用时间的延长,对细胞增殖的抑制情况显著增强,呈时间依赖性;各剂量对细胞的增殖均有抑制,但在质量浓度10-6~10-4mg/mL范围内,对细胞的增殖抑制加强,在10-4~10-2mg/mL范围内,对细胞的抑制开始降低。
2.2 CGMP对COX-2、iNOS、GST-π的mRNA表达的影响
2.2.1 RNA提取的质量分析

图2 经不同剂量CGMP处理的HT-29细胞总RNA琼脂糖凝胶电泳图谱Fig.2 Agarose gel electrophoresis of total RNA with different doses of CGMP
按照方法1.3.3节提取总RNA,提取质量的鉴定见图2。电泳图显示,除M4无5S RNA,其他各组的28S RNA、18S RNA和5S RNA谱带清晰,且28S RNA条带明显亮于18S RNA,无明显的拖尾现象。说明提取的总RNA完整度较好。
2.2.2 CGMP对COX-2、iNOS、GST-π的mRNA表达水平的影响

图3 不同剂量CGMP对HT-29细胞COX-2(a)、iNOS(b)、GGSSTT--π(c) mRNA表达的影响及其电泳图Fig.3 Electrophoresis and effect of different doses of CGMP on mRNA expression levels of COX-2 (a), iNOS (b) and GST-π (c) in HT-29 cells
不同剂量的CGMP作用于HT-29细胞24 h后,COX-2、iNOS、GST-π mRNA的表达水平如图3所示,与正常对照组比,各剂量的CGMP组均可以降低COX-2、iNOS、GST-π mRNA的表达,且均是先降低后升高。其中CGMP的M4组对COX-2 mRNA的抑制极为显著(P<0.01),CGMP的M2和M3组极显著地降低iNOS mRNA的表达(P<0.01),M2、M3和M4的CGMP组明显的下调了GST-π mRNA表达(P<0.01)。
3 讨 论
CRC是临床常见的消化道肿瘤,具有发病率高、根治性差的特点。它的潜伏期很长,早期的CRC没有明显的症状,通常不易被发现,当诊断病人为CRC时已接近中晚期。由于CRC的发生发展过程伴随了蛋白质和酶等分子的异常代谢,通过检测粪便中DNA甲基化、COX-2等这些标志物可有助于CRC的早期诊断。导致结直肠发生的原因至今仍不明确,由报道可知是多因素、多阶段及内外的相互作用而引起的,其可能的发生机制包括染色体不稳定、微卫星不稳定、CpG岛甲基化表型及癌症干细胞因素[18-19]。现今对其治疗主要是以手术为主、化疗药物为辅的方法,但由于化疗药物的毒副作用很大,所以治疗的效果也有限。近年发现饮食与CRC的发生有关,而作为可提供氨基酸的生物活性肽成为人们研究的热点并发现了抗肿瘤肽和免疫调节肽[20]。
CGMP是一种具有诸多生物学功能的乳源生物活性肽,它独特的生理活性和营养特性使其被广泛的应用于食品保健和生物医药领域。Keogh等[21]对人进行了双盲随机平行对照研究,发现食用CGMP浓缩蛋白的受试者在体质量减轻的同时,还改善了心血管疾病的多项指标。Ney等[22]发现在CGMP不仅可以作为苯丙酮尿症(phenylketonuria,PKU)患者的饮食,还能减少血浆和大脑中苯丙氨酸的浓度,预防神经损害。CGMP作为功能性食品的可能机制是通过调节细胞因子网络而调控免疫和代谢网络[23]。目前人们对于CGMP的研究大多是建立动物的肠道炎症模型而证实它的活性,很少有研究其对结直肠癌的影响。Rhoades等[24]证实了CGMP可以抑制3株肠致病性大肠杆菌对结直肠癌HT-29细胞株的黏附能力从而缓解结直肠癌的发展。因此,本实验用CGMP作用于HT-29细胞,通过观察COX-2、iNOS及GST-π的表达进一步解释CGMP改善炎症性肠病的作用机理。
研究采用CGMP作用于HT-29细胞,通过MTT法测定细胞增殖抑制率,结果发现CGMP可抑制细胞的增长,呈时间依赖性,10-4mg/mL的CGMP对细胞的抑制效果最好,与它的抗炎活性相符,但仍远不及化学药物对结肠癌细胞的抑制率[25-26],这也进一步证实了它作为功能性食品的属性,表现为安全性高、副作用小。其可能的机制是通过调控细胞周期的调控蛋白,从而影响肿瘤细胞生长、增殖或阻止肿瘤细胞周期G1/S的进程[27-28]。相关研究指出牛乳中的一些多肽可以通过诱导细胞凋亡、影响癌症细胞的活性而起到抗肿瘤的作用[29]。
COX-2是环氧合酶的一种亚型,而COX是前列腺素(prostaglandin,PG)合成的关键酶,催化花生四烯酸(arachidonicacid,AA)而生成一系列内源性前列腺素,后者参与维持机体的各种生理功能和病理过程[30]。COX-2可增加PG、抑制肿瘤细胞凋亡、促进细胞增生、促进肿瘤血管形成[31]。iNOS是非依赖于钙离子、钙调素和还原型辅酶Ⅱ的NOS,它能催化合成大量的NO且持续的时间很长,NO是一种重要的生物活性物质和信号传递分子,参与调节如扩张血管、宿主防御等体内一系列生理活动,还与肿瘤血管的形成有密切关系[32]。在静息状态下,COX-2和iNOS不表达,当细胞接受如细胞因子TNF-α、IL-1β等刺激后,其表达量就会大量增加,因此被认为是结肠炎的促炎因子[33]。COX-2和iNOS被特异性的捆绑在一起,COX-2可促进iNOS的表达,而iNOS产生的NO可能激活了可溶性鸟苷酸环化酶(solubleguanylatecyclase,sGC)导致cGMP发出某种信号,进而上调COX-2的表达,这也侧面反映COX-2表达的降低会促使iNOS表达的下降进而抑制细胞的增殖[34]。Tasnaka等[35]研究发现通过阻断NO的产生或抑制iNOS和COX-2的表达,可有效阻断结肠肿瘤的发生。COX-2、iNOS还是核转录因子NF-κB调控的下游靶基因,具有转录活性的NF-κB可以调节COX-2 mRNA、iNOS mRNA的转录和表达[36-37]。本研究发现通过CGMP(10-4、10-3mg/mL)的干预,可有效地降低二者的表达水平,科学地鉴定了CGMP可能通过抑制NF-κB的信号通路而下调COX-2 mRNA、iNOS mRNA的表达。
GST-π属于GSTs基因家族成员,是人体内一种Ⅱ相代谢解毒酶,具有保护、储存、结合和转运等多种生理功能并介导肿瘤多药耐药机制。GST-π可催化机体中谷胱甘肽与化疗药物结合,增加药物的水溶性,使药物易于排出体外;自身通过直接与药物结合的形式降低药物活性[38]。在多种癌症组织中存在高度表达的现象,它在细胞的抗损伤、抗癌变过程中起重要作用,因此GST-π的水平不仅可作为肿瘤转化的生化标志,而且表达水平的变化也会影响肿瘤化疗耐药。检测肿瘤细胞中GST-π的含量,可以深刻了解肿瘤细胞生理和病理状态中GST-π的变化,进而探讨相关机制。李乐平等[39]的研究发现结直肠癌组织中GST-π的表达高于正常结直肠黏膜。Moffat等[40]认为在转录和转录后水平的调节影响了GST-π的表达,同时细胞特异性的GST-π mRNA降解率的不同决定了GST-π基因表达的水平。研究表明,Jun和fos蛋白、转录因子SP1、GST-π转录阻遏物均可参与GST-π基因转录的调节[41]。本研究的结果表明,CGMP(10-5、10-4、10-3、10-2mg/mL)均可显著的降低GST-π mRNA的表达。提示其可能的机制与转录因子SP1在GST-π基因转录水平的调控方面有关。
4 结 论
乳源CGMP具有抑制HT-29结肠癌细胞增殖的作用,并降低炎症因子COX-2、iNOS和多药耐药基因GST-π的mRNA的表达,说明HT-29结肠癌细胞的增殖与基因的低表达存在相关性。尽管CGMP抑制结肠癌细胞活性作用机制还有待于进一步的探究,但本研究结果将为CGMP作为功能性保健品提供理论支撑,同时也为CRC的营养治疗提供科学的参考。
[1] FERLAY J, SHIN H R, BRAY F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. International Journal of Cancer, 2010, 127(12): 2893-2917.
[2] 王磊, 宋顺心, 汪建平. 结直肠癌实验研究现状及展望[J]. 中华实验外科杂志, 2013, 30(3): 429-430.
[3] TURKTEKIN M, KONAC E, ONEN H I, et al. Evaluation of the effects of the flavonoid apigenin on apoptotic pathway gene expression on the colon cancer cell line (HT29)[J]. Journal of Medicinal Food, 2011, 14(10): 1107-1117.
[4] JENKINS D C, CHARLES I G, BAYLIS S A, et al. Human colon cancer cell lines show a diverse pattern of nitric oxide synthase gene expression and nitric oxide generation[J]. British Journal of Cancer, 1994, 70(5): 847-849.
[5] 孔易, 郑纪宁. GST-π和P-gp在大肠癌中的表达及意义[J]. 承德医学院学报, 2013, 30(6): 453-455.
[6] 杨径, 王继华, 王兰田, 等. COX-2 和iNOS在喉鳞癌中的表达及其与血管生成的相关研究[J]. 中国耳鼻咽喉颅底外科杂志, 2009(2): 97-102.
[7] MASUNAGA R, KOHNO H, DHAR D K, et al. Cyclooxygenase-2 expression correlates with tumor neovascularization and prognosis in human colorectal carcinoma patients[J]. Clinical Cancer Research, 2000, 6(10): 4064-4068.
[8] KLOTZ T, BLOCH W, JACOBS G, et al. Immunolocalization of inducible and constitutive nitric oxide synthases in human bladder cancer[J]. Urology, 1999, 54(3): 416-419.
[9] DELFOUR A, JOLLES J, ALAIS C, et al. Caseinoglycopeptides:characterizationof a methionin residue and of the N-terminal sequence[J]. Biochemical and Biophysical Research Communications, 1965, 19: 452-455.
[10] 吴疆, 庞广昌, 凌雪萍. 酪蛋白糖巨肽的生物学活性[J]. 食品科技, 2003, 25(9): 19-21.
[11] OH S, WOROBO R W, KIM B, et al. Detection of cholera toxinbindingactivity of κ-casein macropeptide and optimization of its production bythe response surface methodology[J]. Bioscience, Biotechnology and Biochemistry, 2000, 64(3): 516-522.
[12] 周伟. 糖巨肽的生物学作用及研究进展[J]. 国际儿科学杂志, 2010, 37(2): 215-217.
[13] 朱晨晨, 陈庆森. 乳源酪蛋白糖巨肽改善炎症性肠病的研究进展[J].食品科学, 2012, 33(1): 262-266.
[14] MOSMANN T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays[J]. Journal of Immunological Methods, 1983, 65(1/2): 55-63.
[15] UM Y R, KONG C S, LEE J I, et al. Evaluation of chemical constituents from Glehnialittoralis for antiproliferative activity against HT-29 human colon cancer cells[J]. Process Biochemistry, 2010, 45(1): 114-119.
[16] LEE S M, KIM K, KIM Y, et al. The anti-inflammatory effect of IH-901 in HT-29 cells[J]. Molecular & Cellular Tocicology, 2007, 3: 254-261.
[17] 夏国盛, 王亚东, 张文静, 等. 结肠癌细胞中 TS, TP, GST-π, Pgp, MRP1 表达对奥沙利铂化疗敏感性的预测价值[J]. 现代消化及介入诊疗, 2010, 15(3): 147-151.
[18] HARRISON S, BENZIGER H. The molecular biology of colorectal carcinoma and its i mplications: a review[J]. The Surgeon, 2011, 9(4): 200-210.
[19] 张涛涛, 阎岩. 结直肠癌病因与发病机制最新研究进展[J]. 生命科学与医药卫生, 2009(7): 66-68.
[20] XU R J. Bioactive peptides in milk and their biological and health implications[J]. Food Reviews International, 1998, 14(1): 1-16.
[21] KEOGH J B, CLIFTON P. The effect of meal replacements high in glycomacropeptide on weight loss and markers of cardiovascular disease risk[J]. The American Journal of Clinical Nutrition, 2008, 87(6): 1602-1605.
[22] NEY D M, GLEASON S T, VAN CALCAR S C, et al. Nutritional management of PKU with glycomacropeptide from cheese whey[J]. Journal of Inherited Metabolic Disease, 2009, 32(1): 32-39.
[23] 庞广昌, 陈庆森, 胡志和. 食品是如何通过细胞因子网络控制人类健康的(Ⅱ)[J]. 食品科学, 2006, 27(6): 260-270.
[24] RHOADES J R, GIBSON G R, FORMENTIN K, et al. Caseinoglycomacropeptide inhibits adhesion of pathogenic Escherichia coli strains to human cells in culture[J]. Journal of Dairy Science, 2005, 88(10): 3455-3459.
[25] 杜伯雨, 姜丽平, 仲来福. 姜黄素与5-氟尿嘧啶联用对人结肠癌HT-29细胞增殖的影响[J]. 中国药理学与毒理学杂志, 2005, 19(1): 49-52.
[26] 张琳, 方靖, 伍小军. 三苯氧胺联合5-氟尿嘧啶对人结肠癌细胞HT-29的抑制作用[J]. 广东医学, 2011, 32(17): 2240-2242.
[27] ZHOU Yanhong, ZENG Zhangyang, ZHANG Wenling, et al. Lactotransferrin: a candidate tumor suppressor-deficient expression in human nasopharyngeal carcinoma and inhibition of NPC cell proliferation by modulating the mitogen-activated protein kinase pathway[J]. International Journal of Cancer, 2008, 123(9): 2065-2072.
[28] LI Wenye, LI Qingwang, HAN Zengsheng, et al. Growth suppression effects of recombinant adenovirus expressing human lactoferrin on cervical cancer in vitro and in vivo[J]. Cancer Biotherapy & Radiopharmaceuticals, 2011, 26(4): 477-483.
[29] O’RIORDAN N, KANE M, JOSHI L, et al. Structural and functional characteristics of bovine milk protein glycosylation[J]. Glycobiology, 2014, 24(3): 220-236.
[30] 吴江平. 环氧合酶-2及其抑制剂也结直肠肿瘤[J]. 国外医学: 外科学分册, 2004, 31(6): 344-347.
[31] 熊兵红, 程勇. 环氧合酶-2与大肠癌研究进展[J]. 消化外科, 2005, 4(6): 451-456.
[32] 崔琳, 江晨, 纪萍. 结直肠癌组织iNOS与eNOS的组织芯片技术检测及其与血管生成关系[J]. 齐鲁医学杂志, 2005, 20(3): 203-205.
[33] 徐萍, 周小江, 吕文华, 等. 溃疡性结肠炎组织中环氧合酶-2与一氧化氮合酶的表达及意义[J]. 中华消化内镜杂志, 2003, 12(6): 398-399.
[34] KIM S F, HURI D A, SNYDER S H. Inducible nitric oxide synthase binds, S-nitrosylates, and activates cyclooxygenase-2[J]. Science Signaling, 2005, 310(5756): 1966-1970.
[35] TANAKA T, KOHNO H, SHIMADA R, et al. Prevention of colonic aberrant crypt foci by dietary feeding of garcinol in male F344 rats[J]. Carcinogenesis, 2000, 21(6): 1183-1189.
[36] 方兴保. NF-κB与结直肠癌[J]. 中国肿瘤生物治疗杂志, 2013, 20(3): 356-359.
[37] GUO Zhong, SHAO Lifang, DU Qiang, et al. Identification of a classic cytokine-induced enhancer upstream in the human iNOSpromoter[J]. The FASEB Journal, 2007, 21(2): 535-542.
[38] HOLLEY S L, RAJAGOPAL R, HOBAN P R, et al. Polymorphisms in the glutathione S-transferase mu cluster are associated with tumour progression and patient outcome in colorectal cancer[J]. International Journal of Oncology, 2006, 28(1): 231-236.
[39] 李乐平, 孟丹, 靖昌庆. 结直肠癌组织谷胱甘肽-S-转移酶π的表达和其血浆水平的关系[J]. 肿瘤防治杂志, 2005, 12(2): 95-98.
[40] MOFFAT G, Mc LAREN A, WOLF C. Transcriptional and posttranscriptional mechanisms can regulate cell-specific expression of the human Pi-class glutathione S-transferasegene[J]. Biochemical Journal, 1997, 324: 91-95.
[41] 冯丹, 刘云鹏. GST-π与恶性肿瘤多药耐药的研究进展[J]. 肿瘤防治杂志, 2004, 11(6): 663-665.
Effect of Casein Glycomacropeptide (CGMP) on COX-2, iNOS and GST-π Expression in HT-29 Cells
CAO Jiang-ming, CHEN Qing-sen*, YAN Ya-li, PANG Guang-chang
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China)
Objective: The effect of casein glycomacropeptide (CGMP) on cell proli feration and on the expression of cyclooxyenase-2 (COX-2), inducib le nitrite oxide synthase (iNOS), and glutathione-S-transferase π (GST-π) in HT-29 cells was explored to provide a reliable basis for the use of CGMP as an ingredient in functional foods. Methods: HT-29 Cells were cultured with CGMP for 12, 24 and 48 h. The inhibition of HT-29 cells proliferation was measured by MTT [3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide] assay. The expression of COX-2, iNOS, and GST-π was detected by reverse transcriptionpolymerase chain reaction (RT-PCR) after the HT-29 cells were treated for 24 h. Results: 1) CGMP inhibited the proliferation of HT-29 ce lls in a time-dependent fashion, and the optimal concentration was 10-4mg/mL. 2) Low doses of CGMP (10-5, 10-4and 10-3mg/mL) significantly reduced the expression of three genes. Conclusion: To some extent, CGMP can inhibit the proliferation of HT-29 cells in a time-dependent manner. The mechanism is associated with decreasing the expression of COX-2, iNOS and GST-π by CGMP and further improving human colorectal cancer.
casein glycomacropeptide (CGMP); human colonic tumor cells HT-29; COX-2; iNOS; GST-π
R151
A
1002-6630(2014)13-0213-05
10.7506/spkx1002-6630-201413041
2014-05-11
国家自然科学基金面上项目(31071522)
曹江鸣(1988—),女,硕士研究生,研究方向为发酵生物技术、功能成分与肠道健康的关系。E-mail:caodundun@126.com
*通信作者:陈庆森(1957—),男,教授,硕士,研究方向为发酵生物技术、功能成分与肠道健康的关系。E-mail:chqsen@tjcu.edu.cn
