鲫鱼卵唾液酸糖蛋白化学结构分析及对前成骨细胞MC3T3-E1增殖分化的影响
2014-01-18夏光华詹麒平薛长湖王静凤
夏光华,贺 敏,詹麒平,薛长湖,王静凤*
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
鲫鱼卵唾液酸糖蛋白化学结构分析及对前成骨细胞MC3T3-E1增殖分化的影响
夏光华,贺 敏,詹麒平,薛长湖,王静凤*
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
目的:成熟的鲫鱼卵经提取、分离纯化得到唾液酸糖蛋白(sialyglycoproteins of Carassius auratus eggs,CA-SGP),分析其化学结构,及对前成 骨细胞MC3T3-E1增殖分化的影响。方法:采用水提法从成熟鲫鱼卵中提取水溶性蛋白,经阴离子交换色谱、凝胶过滤色谱分离纯化鲫鱼卵水溶性蛋白得到CA-SGP,测定其基本组 成,采用高效凝胶液相色谱和聚丙烯酰胺凝胶电泳测定其分子质量和纯度,PMP柱前衍生高效液相色谱法测定其单糖组成;采用噻唑蓝法测定MC3T3-E1细胞的增殖率,酶联免疫法测定Ⅰ型胶原蛋白(collagen type Ⅰ,COLⅠ)和骨钙素(osteocalcin,OCN)的分泌量及碱性磷酸酶(alkaline phosphatase,ALP)的活性,茜素红染色法测定矿化结节的数量。结果:得到单一的组分CA-SGP,在高效凝胶过滤色谱色谱图上呈现单一的糖和蛋白的检测重叠峰,在凝胶电泳图上呈现单一弥散性条带,其蛋白质含量为14.33%,己糖含量为62.81%,N-乙酰神经氨酸(N-acetylneurainic acid,Neu5Ac)含量为19.72%。单糖组成测定结果显示:CA-SGP主要由甘露糖、葡萄糖胺、半乳糖胺组成,其物质的量比为7.61∶6.70∶1.00;MC3T3-E1细胞与CA-SGP共同孵育后,其增殖率显著增加,COLⅠ和OCN的分泌量分别增加了39.28%和83.06%,ALP活性提高了285.08%,矿化结节的数量增加了96.41%,说明CA-SGP显著促进MC3T3-E1细胞增殖、分化和矿化。结论:CA-SGP为富含Neu5Ac的糖蛋白,具有显著促进MC3T3-E1细胞增殖、分化和矿化的作用,对开发抗骨质疏松功能性食品具有重要意义。
鲫鱼卵唾液酸糖蛋白;分离纯化;MC3T3-E1细胞;增殖;分化
骨内稳态由成骨细胞介导的骨形成和破骨细胞介导的骨吸收的平衡来维持,骨内稳态失衡后会导致包括骨质疏松在内的一系列疾病。骨质疏松是由于体内骨吸收强于骨形成而导致的慢性进行性疾病[1]。随着人口老龄化趋势的发展,骨质疏松已成为全人类的健康问题,全世界患病人数已超过2 亿[2],被世界卫生组织列为三大老年病之一。成骨细胞在调控骨代谢中起着关键作用,成骨细胞[3]是骨形成中最重要的功能细胞,其增殖分化是骨形成的关键,而且,成骨细胞通过分泌骨保护素(osteoprotegerin,OPG)和核因子κB受体活化因子配体(receptor activator for nuclear factor- κB ligand,RANKL)调节破骨细胞的形成和活性,从而调控骨吸收作用。因此,调控成骨细胞活性对治疗骨质疏松具有重要意义。目前,市场上用于治疗骨质疏松的药物主要包括雌激素、降钙素、双磷酸盐、他汀类药物等[4],但长期服用具有较强的毒副作用。因此,寻找安全有效防治骨质疏松的功能因子具有重要研究意义。
鱼卵是鱼类加工过程中产生的主要副产物之一,包含了胚胎发育所必需的全部营养和生物活性物质,富含多不饱和脂肪酸、卵磷脂、糖蛋白等多种功效成分。有关鱼卵高值化加工和利用的研究,主要集中在功能性脂质[5]方面,而鱼卵糖蛋白的高值化加工利用尚未引起关注。课题组前期以MC3T3-E1细胞为模型,经大量筛选发现鱼卵水溶性蛋白中的唾液酸含量与其促进成骨细胞增殖活性呈正相关,其中,鲫鱼卵水溶性蛋白中唾液酸的含量最高。
本实验以鲫鱼卵为原料提取水溶性蛋白,采用QFF阴离子交换色谱和凝胶过滤色谱分离得到唾液酸糖蛋白(sialyglycoproteins of Carassius auratus eggs,CA-SGP),鉴定其唾液酸糖蛋白特性并分析其化学结构,研究其对MC3T3-E1细胞增殖、Ⅰ型胶原蛋白(collagen type Ⅰ,COLⅠ)和骨钙素(osteocalcin,OCN)的分泌量、碱性磷酸酶(alkaline phosphatase,ALP)活性和矿化结节形成量的影响,以期为开发治疗骨质疏松安全有效的功能性食品提供理论依据,促进鱼卵高值化利用。
1 材料与方法
1.1 材料
成熟鲜活的雌性鲫鱼,购于青岛大连路水产品市场,在冰浴条件下取鱼卵并去除卵包膜,鱼卵于-80 ℃保存备用;小鼠成骨细胞株MC3T3-E1,购于美国菌种保藏中心。
1.2 试剂
α-MEM培养基、胎牛血清 Gibco公司;葡聚糖系列标准品、N-乙酰神经氨酸(N-acetylneurainic acid, Neu5Ac)、抗坏血酸、β-磷酸甘油、茜素红 美国Sigma公司;碱性磷酸酶检测试剂盒 南京建成生物工程研究所;小鼠骨钙素和Ⅰ型胶原蛋白ELISA检测试剂盒 美国R&D公司;邻苯二氨盐酸 美国BBI公司;Q Sepharose Fast Flow(QFF)填料、Sephacryl S-200(S-200)填料 美国GE公司;其他试剂均为国产分析纯。
1.3 仪器与设备
BJ5060UV型CO2培养箱 德国Heraeus公司;电泳仪、680型酶标仪 美国Bio-Rad公司;IX51倒置显微镜系统 日本Olympus公司;JS-780型全自动凝胶成像分析仪 上海培清科技有限公司;1100高效液相色谱仪美国Agilent公司;AKTA UPC 100 FPLC蛋白纯化系统美国GE公司。
1.4 方法
1.4.1 CA-SGP的分离纯化及鉴定
鲫鱼卵清洗、除杂后,匀浆研磨,加入等体积的蒸馏水浸提30 min,双层纱布过滤,浸提液于8 000 r/min条件下离心15 min,上清液加入等体积的90%苯酚溶液,搅拌2~3 h后离心,将上清液透析3 d即得粗糖蛋白。粗糖蛋白缓慢上样于QFF阴离子交换柱(缓冲液为0.02 mol/L Tris-HCl,pH 8.0),采用0~1 mol/L NaCl(溶于0.02 mol/L Tris-HCl,pH 8.0缓冲液)进行梯度洗脱,每管收集8 mL,分别测定各管多糖含量(硫酸苯酚法)及280 nm波长处的吸光度,绘制洗脱曲线,收集并合并各洗脱峰,测定各峰的Neu5Ac含量。富含Neu5Ac的组分采用S-200凝胶柱进一步分离纯化,含唾液酸组分经G-25凝胶柱脱盐后冻干,得到纯CA-SGP,并用高效凝胶液相色谱(high-performance size-exclusion chromatography,HPSEC)和十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)鉴定其糖蛋白特性。
1.4.2 CA-SGP的分子质量及纯度测定
分子质量测定采用HPSEC法[6],以葡聚糖系列物为标准品。纯度测定和糖蛋白鉴定采用SDS-PAGE[7]和HPSEC法[6]。
1.4.3 CA-SGP基本组成分析
蛋白质含量测定采用Folin-酚法[8];总糖含量测定采用硫酸苯酚法[9];Neu5Ac含量测定采用柱前衍生二极管阵列/荧光检测器串联高效液相色谱法(high performance liquid chromatography,HPLC)[10];磷含量测定采用钼蓝比色法[11];单糖组成测定采用PMP柱前衍生-HPLC法[6]。
1.4.4 MC3T3-E1细胞的培养
MC3T3-E1细胞培养于含10%(V/V)胎牛血清的α-MEM培养基(含100 U/mL青霉素、100 μg/mL链霉素)中。以0.25%的胰酶消化传代,于37 ℃、5% CO2、饱和湿度的培养箱中培养,平均每2~3 d传代1 次,取对数生长期细胞用于实验。
1.4.5 MC3T3-E1细胞增殖活性检测
调整细胞密度为1.5×104个/mL,接种于96孔板,每孔100 μL。24 h后,换含不同质量浓度CA-SGP(0、50、100、200、400 μg/mL)的完全培养基,每组4 复孔,200 μL/孔。分别培养48、72、96 h后,加入噻唑蓝溶液(终质量浓度0.5 mg/mL),200 μL/孔,孵育4 h。弃上清,加入酸化异丙醇,200 μL/孔,吹打使其充分溶解,于酶标仪570 nm波长处检测各光密度(OD)值,细胞增殖活性按照公式(1)表示。
1.4.6 MC3T3-E1细胞COLⅠ和OCN含量测定
取密度为2×104个/mL的MC3T3-E1细胞接种于24 孔板,每孔1 mL,24 h后,换含0、50、100、200、400 μg/mL CA-SGP的完全培养液,分别培养7 d或14 d后,收集培养液,参照酶联免疫吸附测定法(enzy me-linked immunosorbent assay,ELISA)试剂盒方法检测COLⅠ和OCN含量。
1.4.7 MC3T3-E1细胞碱性磷酸酶活性检测
调整细胞密度为2×104个/mL,接种于24 孔板,每孔1 mL,24 h后,分别用0、50、100、200、400 μg/mL的CA-SGP干预,培养7 d后,弃培养液,每孔加入200 μL细胞裂解液(1% TritonX-100),取上清,按ALP试剂盒说明书步骤测ALP含量,计算相对ALP活力。
1.4.8 MC3T3-E1细胞矿化结节的测定
调整细胞密度为2×104个/mL,接种于24孔板,每孔1 mL,待细胞融合后,弃培养液,换含0、50、100、200 μg/mL CA-SGP的分化完全培养液培养,分化完全培养液中含50 μg/mL的抗坏血酸和10 mmol/L的β-磷酸甘油,每2 d换液1次。于第21天将细胞用4%中性甲醛固定15 min,0.1%茜素红-Tris溶液染色30 min后,水洗,于倒置显微镜下观察并拍照。加入100 mmol/L的氯化十六烷基吡啶溶解细胞中的茜素红,于570 nm波长处测定光密度(OD)值,半定量检测细胞矿化程度。
1.5 统计学分析
数据分析采用SPSS17.0软件进行单因素方差分析,同时进行LSD法进行两两比较,P<0.05为差异显著,实验结果用±s表示。
2 结果与分析
2.1 CA-SGP的分离纯化及鉴定
如图1所示,鲫鱼卵粗蛋白经过QFF阴离子交换色谱纯化后,得到6 个组分,各组分蛋白和糖的检测峰均重叠,说明各组分均为糖蛋白。F-1~F-6组分的Neu5Ac含量分别为6.69%、16.55%、0.43%、0.19%、0.25%、0%, F-2组分的含量最高。采用S-200 凝胶过滤色谱对F-2组分进一步纯化,得到了S-1组分,其蛋白和糖的检测峰重叠,Neu5Ac含量为19.72%,说明S-1组分为鲫鱼卵唾液酸糖蛋白(CA-SGP)。

图1 CA-SGP的分离纯化色谱图Fig.1 Elution curves on QFF and Sephacryl S-200 of CA-SGP
2.2 CA-SGP的糖蛋白特性鉴定及分子质量测定

图2 CA-SGP的高效液相凝胶色谱及SDS-PAGE电泳图Fig.2 HPSEC and SDS-PAGE profiles of CA-SGP
CA-SGP在HPSEC图中呈现单一狭窄对称的蛋白和糖的检测重叠峰(图2A),且在凝胶电泳 PAS染色图中呈现单一弥散性的红色条带(图2B),表明CA-SGP为唾液酸糖蛋白,根据HPSEC峰面积计算,纯度为94.76%。采用HPSEC测得CA-SGP的分子质量为195.35 kD。
2.3 CA-SGP的基本组成分析
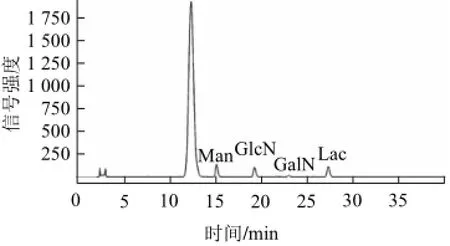
图3 CA-SGP多糖水解液PMP衍生物的高效液相色谱图Fig.3 HPLC separation of PMP derivatives of CA-SGP hydrolysate
CA-SGP中蛋白质含量为14.33%,己糖含量为62.81%,Neu5Ac含量为19.72%,不含磷。其单糖组成分析如图3所示,CA-SGP主要由甘露糖(ketodeoxynonulonsonic acid,Man)、葡萄糖胺(glucosamine,GlcN)、半乳糖胺(galactosamine,GalN)组成,其物质的量比为7.61 ∶6.70∶1.00。
2.4 CA-SGP促进MC3T3-E1细胞增殖

图4 CA-SGP对MC3T3-E1细胞增殖的影响Fig.4 Effect of CA-SGP on proliferation of MC3T3-E1 cells
如图4所示,CA-SGP显著提高MC3T3-E1细胞的增殖活性,并且剂量-效应和时间-效应关系显著。当培养96 h、CA-SGP的质量浓度为400 μg/mL时,MC3T3-E1细胞增殖率达到153.57%。说明CA-SGP具有显著促进MC3T3-E1增殖的作用。
2.5 CA-SGP促进MC3T3-E1细胞分泌COLⅠ
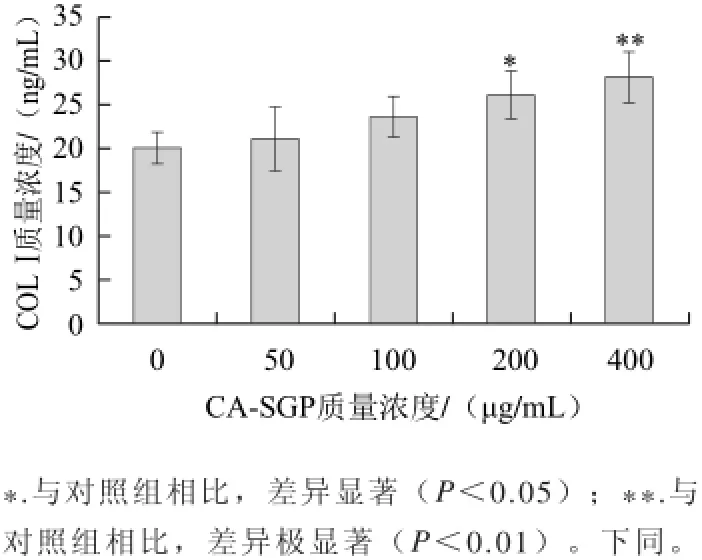
图5 CA-SGP对MC3T3-E1细胞分泌COLⅠ的影响Fig.5 Effect of CA-SGP on COLⅠ secretion of MC3T3-E1 cells
COLⅠ是骨组织形成的先决条件和成骨细胞分化最早的标志[12]。如图5所示,CA-SGP显著促进MC3T3-E1细胞分泌COLⅠ,并具有剂量-效应,当质量浓度为400 μg/mL时,COLⅠ分泌量为对照组的1.39 倍。表明CA-SGP显著促进MC3T3-E1细胞分泌COLⅠ。
2.6 CA-SGP提高MC3T3-E1细胞ALP活性

图6 CA-SGP对MC3T3-E1细胞ALP活性的影响Fig.6 Effect of CA-SGP on ALP activity of MC3T3-E1 cells
ALP是一种同 源二聚体糖蛋白,其主要作用是促进成骨细胞成熟和矿化,是成骨细胞分化和细胞外基质成熟的早期标志[13]。由图6可知,CA-SGP显著提高MC3T3-E1细胞ALP活力,并且剂量-效应关系显著,当质量浓度为400 μg/mL时,ALP活力较对照组提高了285.08%(P<0.01)。说明CA-SGP显著提高MC3T3-E1细胞ALP活力。
2.7 CA-SGP促进MC3T3-E1细胞分泌OCN
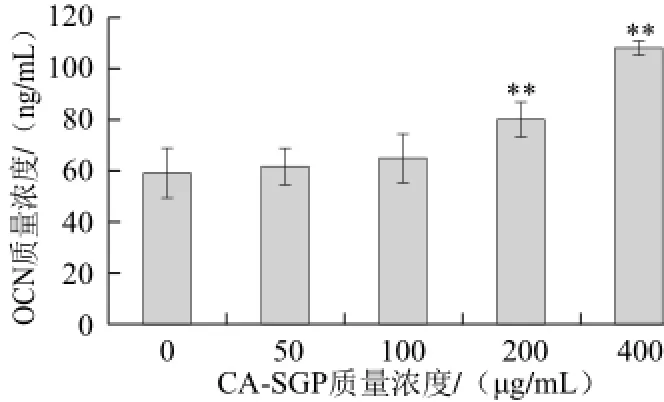
图7 CA-SGP对MC3T3-E1细胞分泌OCN的影响Fig.7 Effect of CA-SGP on OCN secretion of MC3T3-E1 cell s
OCN是成骨细胞特异合成和分泌的一种非胶原蛋白,具有维持骨组织正常矿化的作用,是成骨细胞成熟的标志物[14]。如图7所示,CA-SGP显著促进MC3T3-E1细胞分泌OCN,当质量浓度为400 μg/mL时,OCN的分泌量较对照组增加了83.06%。表明CA-SGP显著促进MC3T3-E1细胞分泌OCN。
2.8 CA-SGP促进MC3T3-E1细胞形成矿化结节
成骨细胞在分化成熟后进入基质矿化期,矿化结节的形成能力是成骨功能的直观表现[15]。与正常对照组相比,CA-SGP组矿化结节量明显增多,且剂量效应-关系显著(图8A)。当CA-SGP质量浓度为200 μg/mL时,矿化结节量较对照组增加了96.41%(P<0.01)(图8B)。表明CA-SGP具有显著促进骨形成作用。

图8 CA-SGP对MC3T3-E1细胞形成矿化结节的影响Fig.8 Effect of CA-SGP on mineralization of MC3T3-E1 cells
5 讨 论
鲫鱼卵水溶性蛋白经分离纯化得到CA-SGP,鉴定了其唾液酸糖蛋白特性并分析其化学结构,探讨其对MC3T3-E1细胞增殖、COLⅠ和OCN分泌量、ALP活性和矿化结节形成量的影响。结果表明:CA-SGP为唾液酸糖蛋白,分子质量为195.35 kD,Neu5Ac含量为19.72%。活性实验结果显示:CA-SGP显著促进MC3T3-E1细胞增殖,增加COLⅠ和OCN的分泌量,提高ALP的活性,促进矿化结节的产生。表明鲫鱼卵唾液酸糖蛋白具有显著促进骨形成作用。
鱼卵唾液酸糖蛋白由Inoue等[16]首次发现从虹鳟鱼卵中提取水溶性 蛋白,经苯酚除杂蛋白、DEAESephadex A-25阴离子交换色谱、S-200凝胶过滤色谱分离纯化得到唾液酸糖蛋白,其唾液酸含量为50%,蛋白含量为分子质量200 kD。采用以上方法陆续从青鳉[17]、鲱鱼[18]、大马哈鱼[19]等中提取鱼卵唾液酸糖蛋白,并发现鱼卵唾液酸糖蛋白总糖含量为80%~90%。本实验从鲫鱼卵中提取CA-SGP,其己糖含量为62.81%,Neu5Ac含量为19.72%,分子质量为195.35 kD,与Inoue等[16]结果相似,说明CA-SGP为鲫鱼卵唾液酸糖蛋白,有关CA-SGP的精细结构尚在研究中。
成骨细胞在调控骨形成/骨吸收平衡中起着极其重要的作用。在骨形成过程中,成骨细胞要经历了增殖、分化、矿化等阶段[20]。COLⅠ、ALP和OCN是成骨细胞不同分化时期标志物,矿化结节是成骨细胞矿化的直观表现。Ji等[21]发现鸡蛋卵黄水溶性蛋白显著促进MC3T3-E1细胞增殖、分化和矿化,具有促进骨形成作用。Koketsu[22]、Kim[23]等研究结果表明 鸡蛋卵黄水溶性蛋白及其水解物中促进骨形成作用的主要成分与唾液酸糖蛋白有关。本实验从鲫鱼卵中提取的CA-SGP显著提高MC3T3-E1细胞增殖,提高ALP的活性,增加COLⅠ和OCN的分泌量,并促进矿化结节的产生,说明CA-SGP具有显著促进MC3T3-E1细胞增殖、分化和矿化的作用。有关CA-SGP对破骨细胞的作用及体内验证实验尚在研究中。
综上所述,CA-SGP为富含Neu5Ac的糖蛋白,具有显著促进MC3T3-E1细胞增 殖、分化和矿化的作用。
[1] ALCANTARA E H, SHIN M Y, SOHN H Y, et al. Diosgenin stimulates osteogenic activity by increasing bone matrix protein synthesis and bone-specific transcription factor Runx2 in osteoblastic MC3T3-E1 cells[J]. The Journal of Nutritional Biochemistry, 2011, 22(11): 1055-1063.
[2] WIRRIES A, SCHUBERT A K, ZIMMERMANN R, et al. Thymoquinone accelerates osteoblast differentiation and activates bone morphogenetic protein-2 and ERK pathway[J]. International Immunopharmacology, 2013, 15(2): 381-386.
[3] LO Y C, CHANG Yuhan, WEI Bailu, et al. Betulinic acid stimulates the differentiation and mineralization of osteoblastic MC3T3-E1 cells: involvement of BMP/Runx2 and β-catenin signals[J]. Journal of Agricultural and Food Chemistry, 2010, 58(11): 6643-6649.
[4] 王寅. 仙茅苷抗骨质疏松作用及其机制的实验研究[D]. 北 京: 北京协和医院, 2011: 33-35.
[5] 陈文娟, 陈丽娇. 大黄鱼鱼卵磷脂提取及磷脂成分分析[J]. 福建农林大学学报: 自然科学版, 2012, 41(4): 498-502.
[6] 李国云, 杜磊, 常耀光, 等. 鲍鱼腹足肌酸性多糖的分离纯化、组成分析及其体外抗肿瘤活性研究[J/OL]. 中国科技论文在线, http:// www.pap er.edu.cn/releasepaper/content/201201-690.
[7] 段宙位, 申铉日, 陈秀明, 等. 罗非鱼尾胶原蛋白的提取与鉴定[J].食品科学, 2012, 33(6): 59-64.
[8] 宿玮, 常耀光, 薛长湖, 等. 海地瓜多糖中蛋白含量测定方法比较[J].食品科学, 2011, 32(2): 201-204.
[9] 刘秋凤, 苏永昌, 吴成业. 龙须菜中硫琼脂的分离纯化及其成分分析[J]. 食 品科学, 2013, 34(23): 160-164.
[10] 冯婷玉, 薛长湖, 孙通, 等. 燕窝中唾液酸的 DAD/FLD 串联 HPLC测定方法研究[J]. 食品科学, 2010, 31(8): 233-236.
[11] 孙炜, 赵效国. 钼蓝比色法测定骨质疏松模型大鼠的骨磷含量[J].疾病监测与控制杂志, 2010(3): 132-133.
[12] LI Fei, YANG Yanan, ZHU Panpan, et al. Echinacoside promotes bone regeneration by increasing OPG/RANKL ratio in MC3T3-E1 cells[J]. Fitoterapia, 2012, 83(8): 1443-1450.
[13] SONG Lige, ZHAO Jiashen, ZHANG Xiuzhen, et al. Icariin induces osteoblast proliferation, differentiation and mineralization through estrogen receptor-mediated ERK and JNK signal activation[J]. European Journal of Pharmacology, 2013, 714(1/3): 15-22.
[14] KONO R, OLCUNO Y, INADA K, et al. A Prunus mume extract stimulated the proliferation and differentiation of osteoblastic MC3T3-E1 cells[J]. Bioscience, Biotechnology, and Biochemistry, 2011, 75(10): 1907-1911.
[15] WANG Weizhuo, OLSON D, CHENG Bin, et al. Sanguis Draconis resin stimulates osteoblast alkaline phosphatase activity and mineralization in MC3T3-E1 cells[J]. Journal of Ethnopharmacology, 2012, 142(1): 168-174.
[16] INOUE S, IWASAKI M. Isolatio n of a novel glycoprotein from the eggs of rainbow trout: occurrence of disialosyl groups on all carbohydrate chains[J]. Biochemical and Biophysical Research Communications, 1978, 83(3): 1018-1023.
[17] KITAJIMA K, INOUE S, INOUE Y. Isolation and characterization of a novel type of sialoglycoproteins (hyosophorin) from the eggs of medaka, Oryzias latipes: nonapeptide with a large N-linked glycan chain as a tandem repeat unit[J]. Developmental Biology, 1989, 132(2): 544-553.
[18] INOUE S, IWASAKI M. Sialoglycoproteins from the eggs of Pacific herring. Isolation and characterization[J]. European Journal of Biochemistry, 1980, 111(1): 131-135.
[19] INOUE S, INOUE Y. Fertilization (activation)-induced 200-to 9-kDa depolymerization of polysialoglycoprotein, a distinct component of cortical alveoli of rainbow trout eggs[J]. Journal of Biological Chemistry, 1986, 261(12): 5256-5261.
[20] 高毅. 淫羊藿苷对成骨细胞增殖分化的影响及机制探讨[D]. 石家庄: 河北医科大学, 2013: 104-110.
[21] JI M Y, LEEM K H, KIM M, et al. Egg yolk soluble protein stimulates the proliferation and differentiation of osteoblastic MC3T3-E1 cells[J]. Bioscience, Biotechnology, and Biochemistry, 2007, 71(5): 1327-1329.
[22] KOKETSU M, JUNEJA L R, KAWANAMI H, et al. Preparation of N-acetylneuraminic acid from delipidated egg yolk[J]. Glycoconjugate Journal, 1992, 9(2): 70-74.
[23] KIM H K, KIM M G, LEEM K H. Inhibitory effects of egg yolk soluble protein on bone resorption[J]. Bioscience, Biotechnology, and Biochemistry, 2008, 72(7): 1929-1931.
Chemical Structure Analysis of Sialyglycoproteins of Crucian Carp Carassius auratus Eggs and the Effect of the Sialyglycoproteins on Proliferation and Differentiation of MC3T3-E1 Cells
XIA Guang-hua, HE Min, ZHAN Qi-ping, XUE Chang-hu, WANG Jing-feng*
(College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China)
This study was designed to investigate the chemical structure of sialyglycoproteins from crucian carp Carassius auratus eggs (CA-SGP) and the effects of CA-SGP on the proliferation, differentiation and mineralization of MC3T3-E1 cells. CA-SGP was isolated from the water soluble protein of crucian carp eggs using anion exchange chromatography and gel exclusion chromatography, and its composition was determined. The proliferation of MC3T3-E1 cells was determined by MTT assay, the secretion of collagen type (COLⅠ), alkaline phosphatase (ALP), and osteocalcin (OCN) were detected by enzyme-linked immunosorbent assay (ELI SA) and the mineralized nodule of MC3T3-E1 cells was evaluated by staining with Ali zarin red S dye. The analysis of chemical structure showed that the CA-SGP was composed of 14.33% protein and 62.81% carbohydrates in which the content of N-acetylneurainic acid (Neu5Ac) was 19.72%, and the monosaccharide composition of CA-SGP was Man, GlcN, GalN, and Neu5Ac. The activity assays indicated that the CA-SGP effectively promoted the proliferation of MC3T3-E1 cells, significantly increased the secretion of ALP, OCN and COLⅠand enhanced the mineralization ability. In conclusion, CA-SGP significantly promotes the proliferation, differentiation and mineralization of MC3T3-E1 cells and can be used as an active ingredient in a safe and effective anti-osteoporosis functional food.
sialyglycoproteins; isolation and purification; MC3T3-E1 cell; proliferation; differentiation
TS254.4
A
1002-6630(2014)13-0203-05
10.7506/spkx1002-6630-201413039
2014-05-25
国家自然科学基金面上项目(31371876);山东省自主创新专项(2012CX80201);
教育部“长江学者和创新团队发展计划”项目(IRT1188)
夏光华(1987—),男,博士研究生,研究方向为海洋生物活性物质。E-mail:xiaguanghua2011@126.com
*通信作者:王静凤(1964—),女,教授,博士,研究方向为海洋生物活性物质和分子营养。E-mail:jfwang@ouc. edu.cn
