海藻酸钠-培养基-刃天青-硅藻土微球法快速检测细菌总数
2014-01-18李正国程婵娟杨德芳
韦 伟,李正国,程婵娟,杨德芳
(1.重庆师范大学生命科学学院,重庆 401331;2.重庆大学生命科学学院 基因工程研究中心,重庆 400045;3.重庆市第95中学,重庆 400084;4.重庆市巴蜀中学,重庆 400013)
海藻酸钠-培养基-刃天青-硅藻土微球法快速检测细菌总数
韦 伟1,2,李正国2,程婵娟3,杨德芳4
(1.重庆师范大学生命科学学院,重庆 401331;2.重庆大学生命科学学院 基因工程研究中心,重庆 400045;3.重庆市第95中学,重庆 400084;4.重庆市巴蜀中学,重庆 400013)
通过制备海藻酸钠-培养基-刃天青-硅藻土(alginate-medium-resazurin-diatomaceous silica,AMRD)微球,建立一种快速检测细菌总数的新方法。结果表明:单倍培养基浓度下,海藻酸钠∶硅藻土为1∶1.4(m/m)时,AMRD微球变色时间与细菌数量呈最佳线性关系,检测限为2.02×102CFU/mL,检测时间为2~16.5 h。AMRD微球对大肠杆菌和金黄色葡萄球菌的检测灵敏度分别为1.62×103、2.03×103CFU/mL。微球对细菌的吸附符合Freundlich等温吸附方程,参数1/n在0.5~1.0之间,属于中等吸附,低浓度条件下受温度影响不大,吸附饱和需要30~45 min。AMRD微球细菌计数法是一种快速而经济的细菌计数新方法,有望用于食品、饮用水以及环境检测等领域细菌总数的定量检测。
海藻酸钠;硅藻土;刃天青;细菌计数;细菌吸附
细菌总数检测(total bacterial number)是反映食品、饮用水等卫生状况的重要指标。目前普遍采用的细菌总数检测方法主要为传统的平板菌落计数法、显微镜直接计数法和比浊法等[1]。平板菌落计数法耗时长、培养基消耗大且步骤繁琐;而显微镜直接计数法和比浊法虽然简便、耗时短,但往往无法区分死、活细胞。近年一些新的细菌计数方法研究时有报道,如ATP生物发光法[2]、NADH荧光法[3]、流式细胞计数[4-5]、硅壳包被荧光纳米颗粒计数[6]、酶联免疫法[7]和实时荧光定量PCR[8-9]法等。这些方法相比传统方法而言精确度以及检测速率方面有较大的提高,但是往往需要昂贵的设备或者试剂,使其应用受到限制。因此,建立一种快速、节约、准确的细菌检测方法在实验室研究与实际应用中都是非常必要的。
刃天青(resazurin)是一种传统的氧化还原染料,对细胞无毒。它可以被微生物的氧化还原酶作用,从蓝色的刃天青被还原成粉红色的试卤灵,还可以进一步被还原为无色的二氢试卤灵。当加入含细菌样品时,其颜色变化表现为青蓝色-紫色-粉红色-无色[10-11]。目前有一些研究通过检测刃天青颜色变化进行细菌的半定量分析,如肉类变质检测[12]、口腔中变形链球菌的数量检测[13]等。多将刃天青制成比色纸,加样品培养后与标准比色板对照,采用0、1、2、3度的方式报告结果,难以进行比较准确的细菌计数。田波等[14]针对牛奶中细菌数量的检测设计了实验方案、尝试进行准确计数,但结果表明计数结果受到氧气浓度以及样品中其他成分等的影响非常大。在后期的实验中,向液体样品中通入氮气、去除氧气,并通过图像采集和图像比对软件对加入刃天青的样品颜色变化进行分析,可计算样品中的细菌数,但是对于样品中其他成分的干扰缺乏排除机制,该法也主要只能使用在原料乳中细菌数量的检测。
本实验提出利用海藻酸钠包埋、固定含刃天青的培养基以形成微球,通过添加不同含量的硅藻土以调节微球的吸附性能,使检测体系中的细菌在微球表面以及周围聚集、生长,通过观察微球的颜色变化时间对细菌进行计数。该方法相对平板计数法而言,可以缩短检测时间、降低培养基消耗,避免样品中其他成分对颜色变化观察的影响,同时可最大程度降低氧气对刃天青变色的影响。对微球制备条件、微球变色时间与细菌数量的关系等方面进行了摸索研究,并对微球的吸附性能作了深入分析,据此提出了提高本方法灵敏度与准确度的研究方向。
1 材料与方法
1.1 材料与试剂
供试细菌菌株大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)由重庆师范大学微生物研究所提供。
刃天青(分析纯) 美国Sigma公司;海藻酸钠(化学纯,黏度1%) 浙江东升化工试剂公司;硅藻土(化学纯) 国药集团化学试剂有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
CR-21G型高速冷冻离心机 日本日立公司;HZP-150型全温振荡培养器 上海精宏实验设备有限公司;PB-10型酸度计 德国Sartorius公司;BT100-2J型精密蠕动泵 保定兰格恒流泵有限公司。
1.3 方法
1.3.1 菌种的保藏、活化及菌悬液配制
4 ℃保藏的菌株于100 mL牛肉膏蛋白胨液体培养基中、37 ℃、180 r/min条件下,恒温振荡培养12 h至对数生长期。吸取活化的菌液2 mL于200 mL牛肉膏蛋白胨液体培养基中,同样条件下培养12 h。菌悬液配制以及平板菌落计数参照GB 4789.2—2010《食品卫生微生物学检验:菌落总数测定》[1]。
1.3.2 微球的制备
海藻酸钠-培养基-刃天青(alginate-mediumresazurin,AMR)微球:称取2 g海藻酸钠,加少量甘油润湿分散均匀,以100 mL单倍牛肉膏蛋白胨液体培养基(1 000 mL培养基中含牛肉膏3.0 g、蛋白胨10.0 g、NaCl 5.0 g,pH 7.2)溶解,搅拌均匀,105 ℃灭菌15 min。待完全冷却后,加入2 mL已经过滤灭菌的0.05%(m/m)刃天青溶液,充分搅拌后,静置5 min,无菌条件下用蠕动泵以24 r/min将该溶液通过注射器针头逐滴加入到100 mL 0.05 mol/L无菌CaCl2溶液(含2 mL刃天青溶液)中,固化45 min,用无菌水洗涤3次,无菌抽滤去掉水分,得到含有牛肉膏蛋白胨培养基和刃天青的青色微球,直径约为2 mm,4 ℃贮藏备用。
海藻酸钠-培养基-刃天青-硅藻土(alginate-mediumresazurin-diatomaceous,AMRD)微球:在海藻酸钠-单倍牛肉膏蛋白胨培养基溶液中加入2 g硅藻土后搅拌均匀,灭菌、制备微球方法同上。
海藻酸钠-双倍培养基-刃天青-硅藻土(alginatedouble-medium-resazurin-diatomaceous,ADMRD)微球:按照AMRD微球的制备方法,将单倍牛肉膏蛋白胨培养基替换为双倍浓度培养基(1 000 mL培养基中含牛肉膏6.0 g、蛋白胨20.0 g、NaCl 10.0 g,pH 7.2)。
海藻酸钠-三倍培养基-刃天青-硅藻土(alginatetriple-medium-resazurin-diatomaceous,ATMRD)微球:按照AMRD微球的制备方法,将单倍牛肉膏蛋白胨培养基替换为3倍浓度(1 000 mL培养基中含牛肉膏9.0 g、蛋白胨30.0 g、NaCl 15.0 g,pH 7.2)。
海藻酸钠-刃天青-硅藻土(alginate-resazurindiatomaceous,ARD)微球:按照AMRD微球的制备方法,用pH 7.2的无菌水替代培养基。
1.3.3 微球变色时间与细菌数量的关系
分别取0.5 mL用无菌水10倍梯度稀释的8个不同浓度的E.coli与S.aureus菌悬液(10-8~10-1),加入含50粒AMR微球的无菌离心管中,37 ℃培养,每隔30 min观察微球颜色变化,以50粒微球全部变成粉红色为终点。以无菌水代替菌悬液作为空白对照,每个浓度做3个重复。菌悬液以平板菌落计数法计数。
1.3.4 微球中硅藻土含量对微球变色时间的影响
制作海藻酸钠∶硅藻土(m/m)分别为1∶0.4、1∶0.6、1∶0.8、1∶1.0、1∶1.2、1∶1.4、1∶1.6、1∶1.8、1∶2.0的AMRD微球,各取50粒分别装于1支无菌离心管中,同1.3.3节的方法进行实验,每种微球做3个重复,并与AMR微球进行比较,研究微球中硅藻土含量对微球变色时间的影响。
1.3.5 微球中培养基浓度对微球变色时间的影响
制作AMRD、ADMRD与ATMRD 3种分别含单倍、双倍和3倍培养基的微球,各取50粒分别装于1支无菌离心管中,同1.3.3节的方法进行实验,研究微球中培养基浓度对微球变色时间的影响。每种微球做3个重复。
1.3.6 检测灵敏度
分别取0.5 mL 10种不同浓度的E.coli与S.aureus菌悬液(无菌水单倍梯度稀释,1×10-7~1×10-6),加入含50粒AMRD微球(海藻酸钠∶硅藻土为1∶1.4)的无菌离心管中。同1.3.3节的方法进行实验,每个浓度做3个重复,检测实验方法的灵敏度。
1.3.7 微球的吸附平衡
考虑到排除吸附过程中细菌繁殖带来的影响,以无培养基的ARD微球替代AMRD微球进行实验。
参考朱晨华等[15]的设计方法,分别取5 mL 8个不同浓度的的E.coli与S.aureus菌悬液(无菌水10倍梯度稀释,10-1~10-8),加入含100粒ARD微球的20 mL无菌离心管中,37 ℃、200 r/min振荡吸附2 h后,取0.5 mL上清液稀释到适当浓度后进行平板计数,每个浓度做2个重复。以相同浓度不加微球的菌悬液作为空白对照组,根据吸附残液中菌体的浓度变化计算平衡吸附量。
取5 m L浓度分别为2.0 2×1 04C F U/m L与4.05×104CFU/mL的E.coli与S.aureus菌悬液,加入含100粒ARD微球的离心管中,分别于5、10、20、30 ℃和40 ℃条件下,200 r/min振荡吸附2 h后,取0.5 mL上清液稀释到适当浓度后进行平板计数,每个温度做3个重复。以相同浓度不加微球的菌悬液作为空白对照组。根据吸附残液中菌体的浓度变化计算吸附量,考察温度对微球吸附的影响。
1.3.8 吸附动力学
取5 mL浓度分别为2.02×104CFU/mL与4.05×104CFU/mL的E.coli与S.aureus菌悬液,分别加入含100粒ARD微球的20 mL离心管中,37 ℃、200 r/min振荡吸附,在15、30、45、60、120 min和240 min时各取1支,分别检测上清液与微球中所含菌体的数量,每个时间点做3个重复。以相同浓度不加微球的菌悬液作为空白对照组,计算不同时刻的吸附量。
2 结果与分析
2.1 微球的制备与物理特征
制得的AMR、AMRD、ARD等系列微球为青色球体,球形比较规整,直径约1~2 mm,无黏连(图1A)。加入细菌样品培养后微球变为粉红色(图1B显示为褐色)。制作的微球直接于锥形瓶中密封,4 ℃可至少保藏5周不变色。冷冻干燥的微球可在4 ℃长期贮藏不变色。
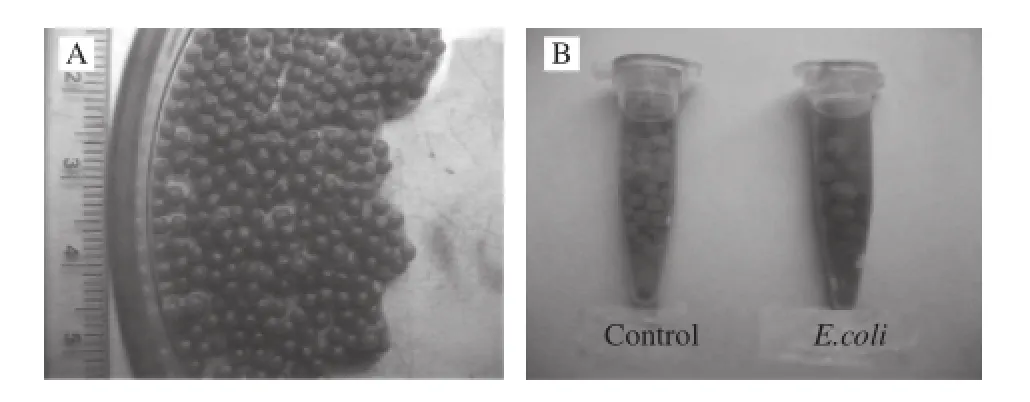
图1 由海藻酸钠、培养基、刃天青和硅藻土制备的微球(A)及加入细菌前后颜色变化(BB)Fig.1 Microspheres prepared with sodium alginate, medium, resazurin and diatomaceous silica (A) and distinct color change before and after addition of bacteria (B)
2.2 微球变色时间与细菌数量的关系
分别以不同浓度的革兰氏阳性菌S.aureus与革兰氏阴性菌E.coli菌悬液为样品,以其所含细菌数量的对数作为纵坐标,变色时间为横坐标,对实验数据进行线性回归分析(图2)。
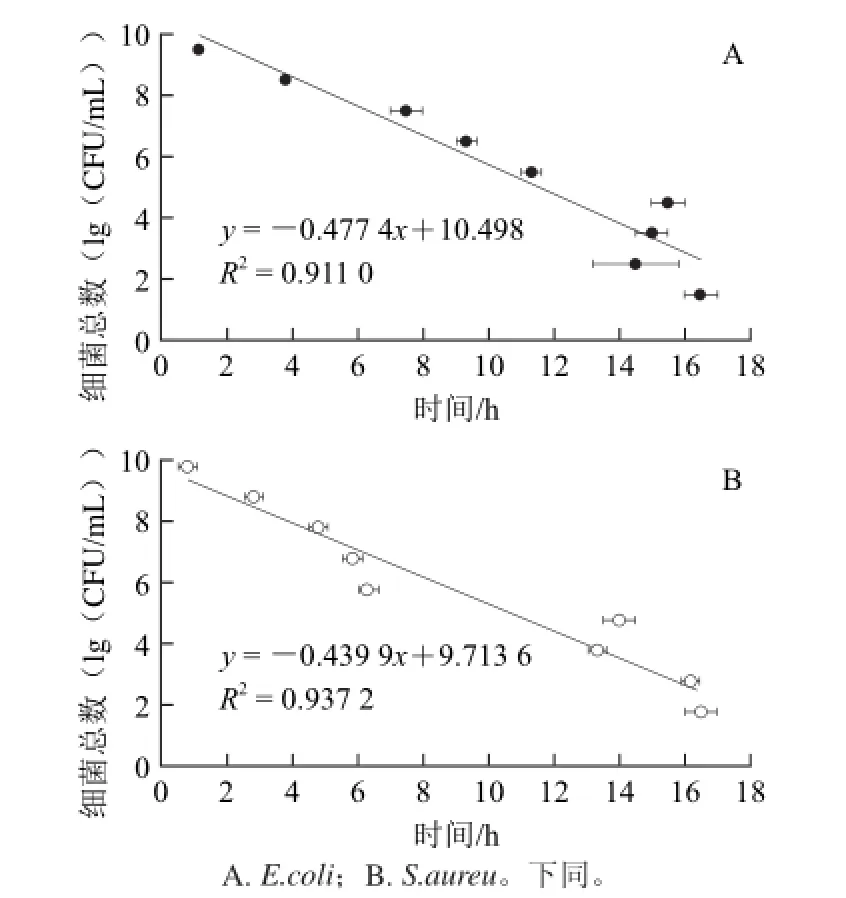
图2 微球变色时间细菌数量的关系Fig.2 Correlation between the discoloration time of microcapsules and bacterial number
由图2可知,对于测试的2种细菌而言,AMR微球的变色时间与样品所含细菌数量之间均表现出很好的线性关系(E.coli:R2=0.911 0,S.aureu:R2=0.937 2)。使用海藻酸钠多糖固化培养基与刃天青染料,直接观察微球颜色变化,可以基本排除样品中其他成分对颜色变化的干扰并减弱氧气浓度对结果的影响,使得检测结果相关系数与直接使用刃天青还原法(R2=0.79)[10]相比有了较大的提高。
对于高菌浓度(≥105CFU/mL)样品,AMR微球的变色时间与样品所含细菌数量之间的线性关系非常好,检测时间分别只需要2~11 h(E.coli)与1~7 h(S.aureu)。这一检测时间比平板菌落计数法所需的24~48 h有较大的提高。但是对于细菌浓度低于105CFU/mL的样品,AMR微球的变色时间则主要集中在13~16 h,且各浓度的变色时间无明显的差异。这可能是由于当样品中细菌数量少时,需要在整个体系中经过较长的生长时间才能使微球变色,同时由于细菌二分裂的繁殖方式以及迅速的繁殖速率使初始细菌基数间的差别在一定程度上被弱化。
2.3 微球中硅藻土含量对微球变色时间的影响
由于微球变色的原理是通过其周围微生物的代谢使微球中刃天青被还原变成粉红色,微球对细菌的吸附能力必然会极大的影响其变色速率与检测效果。因此,考察在微球中添加硅藻土以提高其吸附能力对低菌浓度的检测效果。
表1显示了加入不同比例硅藻土后2种菌数量与变色时间的线性回归方程(Y=kX+b)参数以及相关系数R2。
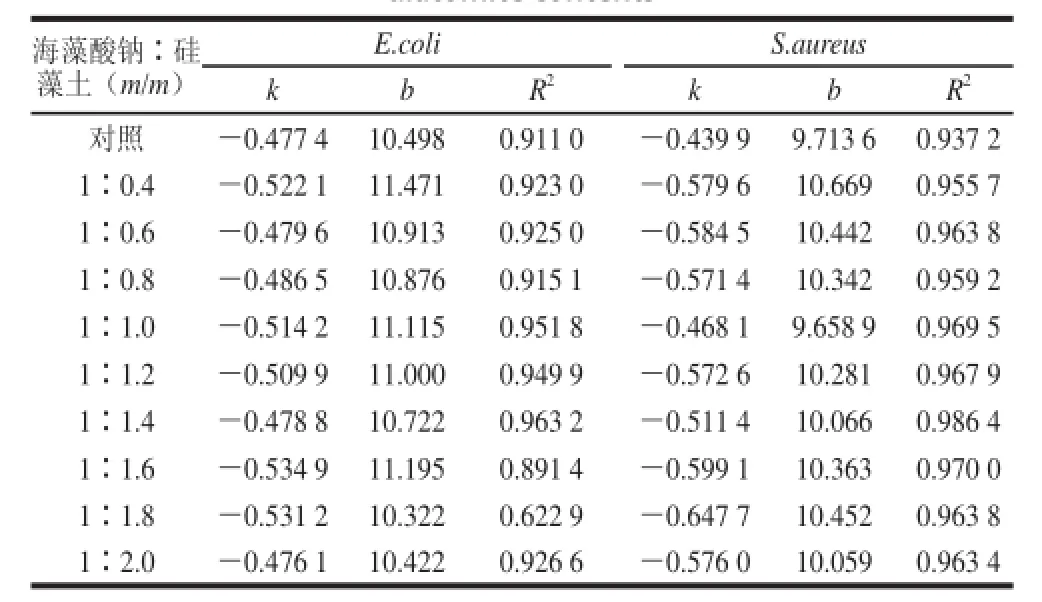
表1 不同硅藻土含量条件下细菌数量与微球变色时间的线性回归参数Table 1 Linear regression parameters for discoloration time of microcapsules against the numbers of E. coli and S. aureus with different diatomite content
由表1可知,与未添加硅藻土的AMR微球相比,AMRD微球变色时间与细菌数量表现出更高的相关性。随着硅藻土比例的上升,相关系数呈现增大的趋势。当硅藻土添加比例达到1.4时,AMRD微球变色时间与2种菌都表现出最高的相关系数(E.coli:R2=0.963 2,S.aureu:R2=0.986 4),随后出现较明显的降低。因此选择相关系数最高的海藻酸钠∶硅藻土(m/m)为1∶1.4的AMRD微球与未添加硅藻土的AMR微球的线性回归结果进行比较(图3)。
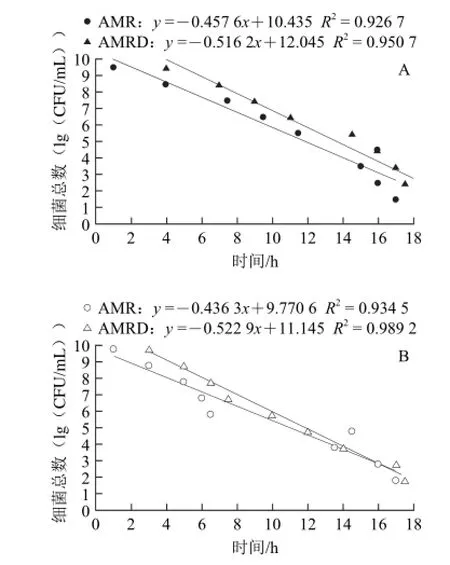
图3 AMR、AMRD微球对检测时间与细菌数量的线性回归模型比较Fig.3 Comparison of the linear regression models of total bacterial number against detection time for AMR and AMRD microspheres
从图3可以看出,在高菌浓度条件下(≥105CFU/mL),AMRD与AMR 2种微球仍然保持最佳的线性关系(R2>0.95)。然而在低浓度样品(101~104CFU/mL)的检测结果中二者表现出明显的区别。在使用AMR微球检测E.coli菌悬液细菌数量时,低浓度样品(101~104CFU/mL)使微球的变色时间均在16 h左右,难以区分;而在AMRD微球的实验结果中,变色时间分布于14.5~17 h之间,每个浓度之间约有45 min的时间差,相邻浓度之间的变色时间得以较明显的区分(图3A)。对于S.aureu,添加硅藻土同样使低浓度样品的检测时间与细菌数量的相关系数增加(图3B)。结果也表明,在低浓度样品的检测方面,添加硅藻土的AMRD微球比AMR对照微球有了明显的提升,与预期相符。可能是由于AMRD微球中硅藻土的吸附作用,使得低浓度菌悬液中的一部分细菌更加集中在微球表面或者周围,其代谢活动对微球的影响更加直接与集中。同时,加入硅藻土后微球本身的孔径以及内部结构可能更为疏松,使微球内所含的培养基更容易通过直接接触或渗透作用提供给细菌,而刃天青与细菌之间的相互作用也同样更加容易。
2.4 微球中培养基浓度对微球变色时间的影响
考虑微生物生长与营养之间的密切关系,考察了海藻酸钠∶硅藻土为1∶1.4的AMRD微球中不同培养基浓度对其变色时间的影响,结果见表2及图4。
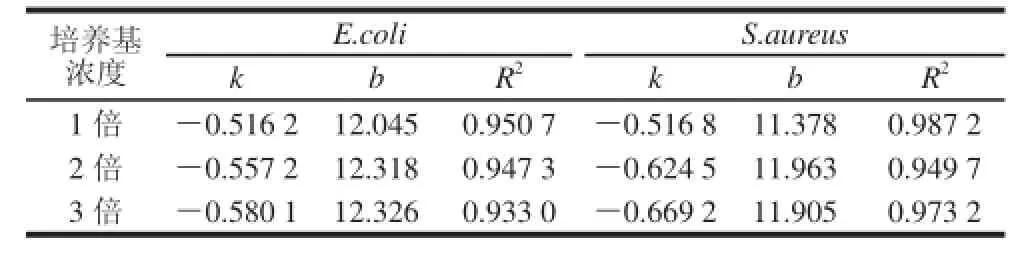
表2 不同培养基浓度条件下细菌数量与微球变色时间的线性回归参数Table 2 Linear regression parameters for microcapsule discoloration time against the numbers ofE. coollii aanndd S. aurreeuuss with different medium concentrations
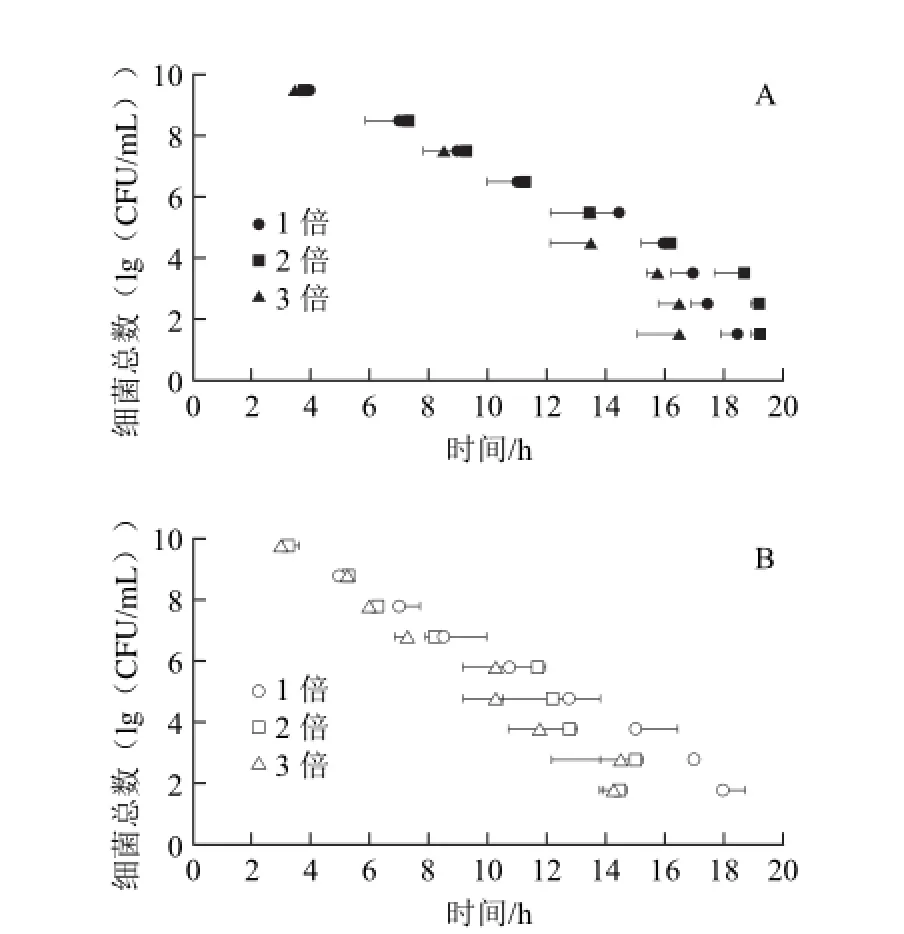
图4 培养基浓度对微球变色时间的影响Fig.4 Influence of medium concentration on the discoloration time of microcapsules
由表2可知,随着培养基浓度的增加,微球变色时间与菌数之间的相关系数略有降低。同时,由图4可以看出,培养基浓度对于高菌浓度样品(>105CFU/mL)使微球的变色时间影响不大。而对低菌浓度样品(<105CFU/mL)有较明显的影响,表现为培养基浓度越高,其变色时间越短。含3倍培养基的ATMRD微球的变色时间比单倍培养基的AMRD微球要快约1~3 h,而2倍培养基的ADMRD微球比AMRD微球要快约0.5~2 h。
虽然高浓度培养基的微球可以缩短检测时间,但是从相邻菌浓度之间变色时间差的角度来看,2倍与3倍浓度培养基微球所测的各个相邻菌浓度样品之间的变色时间相隔很短,往往小于15 min。尤其在E.coli检测中,菌浓度为101~104CFU/mL的样品变色时间集中在14~15 h之间,几乎同时变色,难以准确的判断并计数。根据细菌生长规律,在培养基浓度较低时,微生物的生长随培养基浓度的增加而加快。在检测的过程中,微球中的培养基会向微球外的液体环境扩散,如果微球中的培养基浓度高,则会导致球外的培养基浓度升高,细菌在球外的活动增强,使刃天青迅速变色;同时由于细菌特殊的二分裂繁殖方式,高培养基浓度高而带来的繁殖代时的缩短会使低浓度的样品也能在较短时间内通过快速的分裂达到可以使微球变色的细菌浓度水平,从而减小了不同起始菌浓度的样品对微球变色时间长短的差异,导致准确度降低。
因此,从线性回归相关系数、检测准确性以及降低培养基消耗的经济角度考虑,确定含单倍培养基浓度、海藻酸钠∶硅藻土为1∶1.4的AMRD微球作为该细菌计数法的微球(以下直接使用AMRD微球表示)。
2.5 检测灵敏度与检测限
在微球变色时间与细菌数量关系的实验中,当样品之间所含菌数差异较大(10倍梯度)时,获得了较好的检测计数结果。按1.3.6节方法继续深入研究在样品所含菌数差异更小(单倍梯度)情况下的实验效果,以细菌数量为横坐标、变色时间为纵坐标,结果如图5所示。
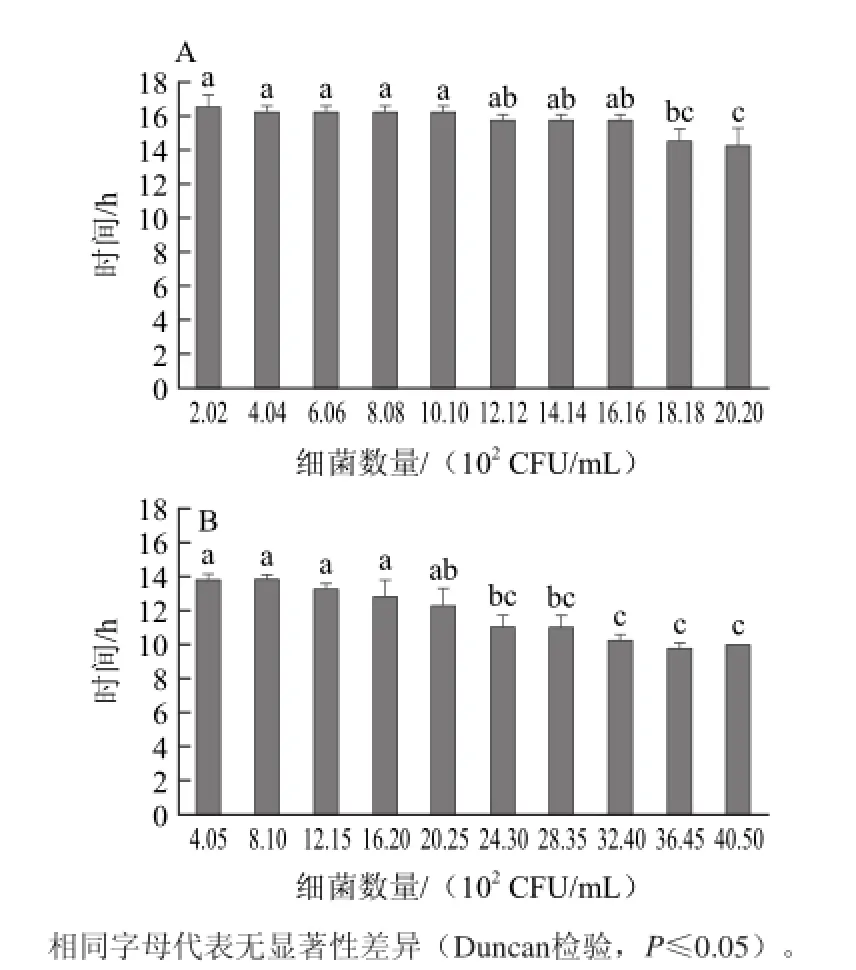
图5 不同细菌浓度下AMRD微球变色灵敏度Fig.5 Detection sensitivity for the discoloration time of microspheres at different bacterial concentrations
从图5 A可以看出,在菌悬液浓度为2.02×102~1.62×103CFU/mL(即1.0×10-7~8.0×10-7稀释度)的8个E.coli样品之间,微球变色时间没有显著差别,颜色变化时间的显著性差异出现在菌悬液浓度超过1.82×103CFU/mL(9.0×10-7稀释度)之后,相差约0.5~1h,表明只有当2个样品之间细菌数量差超过8倍稀释度时,微球在变色时间上才会出现明显差异。结合稀释度与图5A中各稀释度所对应的细菌数量可以得出,在进行E.coli计数中,测量灵敏度约为1.62×103CFU/mL。对于S.aureu(图5B),在菌悬液浓度为4.05×102~2.03×103CFU/mL(即1.0×10-7~5.0×1 0-7稀释度)的5个样品之间,微球变色时间没有显著差别,而在随后的菌悬液浓度为2.43×103~4.05×103CFU/mL(即6.0×10-7~10×10-7稀释度)的5个样品之间,微球颜色变化时间也没有显著差别。明显的时间差异出现在5.0×10-7~6.0×10-7稀释度之间,相差约1 h。由此推算,在S.aureu计数中测量灵敏度为5倍稀释度,约2.03×103CFU/mL。
另外,当菌液样品稀释梯度过大,其中细菌数量低于2.02×102CFU/mL时,微球变色时间超过19 h并且各浓度之间变色时间无明显区别,表明该方法对样品中细菌数量的最低检测限为2.02×102CFU/mL。
2.6 微球吸附平衡与吸附动力学
微球的吸附能力是影响变色时间与检测结果的关键因素,因此对微球的吸附特征做了进一步研究。
使用无培养基的ARD微球对2种细菌进行吸附平衡实验。采用考察固-液界面吸附模式常用的Langmuir等温式[15]和Freundlich等温式[16]对吸附平衡线进行分析,发现实验数据可以用Freundlich方程进行拟合,即:
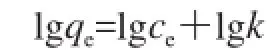
式中:qe为平衡吸附量/(CFU/100 微球);ce为平衡浓度/(CFU/mL);k和1/n为Freundlich常数。
利用Freundlich等温吸附方程对等温吸附曲线进行拟合,实验结果及拟合曲线如图6所示。
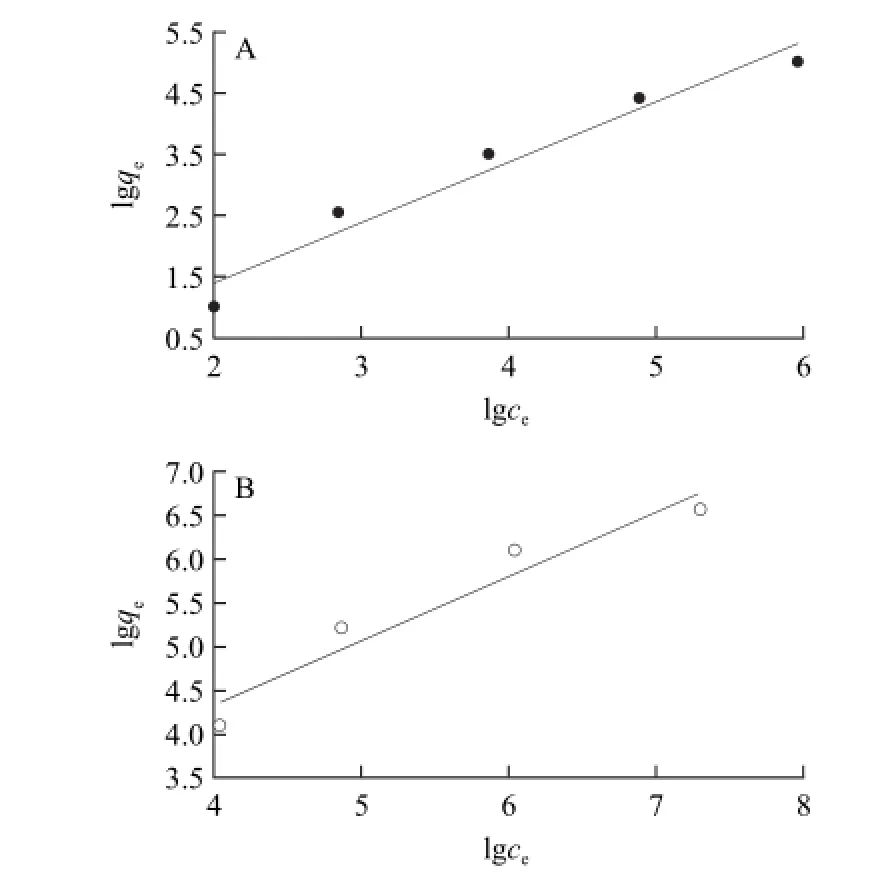
图6 ARD微球的Freundlich等温吸附线(37℃)Fig.6 Freundlich isotherms on ARD microspheres (37 ℃)
由图6可以看出,对于2种菌而言,lgqe与lgce呈线性关系(E.coli:R2=0.934 1,S.aureu:R2=0.955 4)。E.coli和S.aureu的等温吸附线可以用分别用lgqe=0.971 9 lgce-0.511 1(n=1.029,k=0.308,T=37 ℃)与lgqe=0.736 lgce+1.393 7(n=1.359,k=24.757,T=37 ℃)来表示。随着细菌浓度的增加,微球对细菌的吸附容量也随之增加。由实验数据与Freundlich等温吸附方程的拟合情况看,参数1/n在0.5~1.0之间,表示微球属于中等吸附[17]。
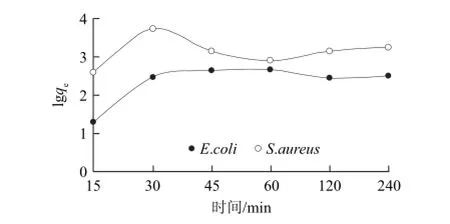
图7 微球吸附动力学Fig.7 Adsorption kinetics of E.coli and S.aureus on ARD microspheres
在反应温度为37℃时,测定不同反应时间条件下细菌的平衡浓度并计算微球对细菌的吸附量,结果如图7所示。
由图7可知,AMRD微球对E.coli与S.aureu 2种细菌在37 ℃条件下吸附时间曲线在吸附前期呈现相同的趋势,随着时间的延长吸附量逐渐增加,在30 min后吸附量均达到最高点。当E.coli与S.aureu 2种菌的起始浓度分别为2.02×104CFU/mL与4.05×104CFU/mL时,吸附30 min后其最大吸附量分别为3.0×102、2.4×103CFU/100微球。随后E.coli的吸附量保持平衡,而S.aureu的吸附量出现略微下降后在45 min时达到平衡(平衡吸附量为1.60×103CFU/100微球)。这一吸附量要低于陆爱霞等[16]采用胶原纤维固化铁吸附材料以及蒋代华等[18]采用的高岭土材料对E.coli与S.aureu 2种细菌的吸附量。从吸附速率来看,AMRD微球对E.coli与S.aureu的吸附比较迅速,在30~45 min内达到平衡。可以据此推测该微球对细菌的吸附以单层表面吸附为主[15-17,19],而实验之初假设的微球中小孔对细菌的吸附在本实验中未能得到明显的表现与证实。
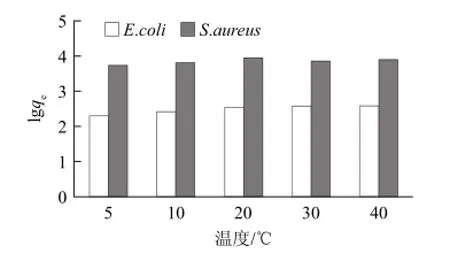
图8 温度对微球吸附的影响Fig.8 Influence of temperature on adsorption of E.coli and S.aureu on ARD microspheres
同时考察了在相同浓度下,温度对2种菌的吸附影响,结果见图8。由图8可以看出,在低菌浓度(E.coli 2.02×104CFU/mL,S.aureu 4.05×104CFU/mL)条件下,温度变化对微球的吸附量无明显影响。
微球与细菌之间的吸附受到来自与多方面因素的影响。静电吸引力、范德华力、疏水作用力、比表面积等都可能影响细菌的吸附[20-22],其中静电吸引力与比表面积都可能有很大的影响[16,23]。绝大多数细菌表面带有负电荷,而海藻酸钠本身也是荷负电的物质,虽然加入硅藻土之后能够提升吸附能力,但由于电荷的排斥作用,可能对细菌的吸附起到了一定的阻碍作用。另一方面,本研究中所制作的微球直径约为1~2 mm,其比表面积比较小,这也可能是微球对细菌的吸附能力不够强的原因。但硅藻土含量与海藻酸钠质量比超过1.4∶1之后,相关系数的降低(表1)也同时表明对于细菌计数而言并非单层表面吸附能力越强越好。这为今后提高微球计数准确性方面的研究提供了方向:1)改进微球的制作工艺,寻求使微球表面荷正电的方法并使细菌可以进入微球中的孔隙[24];2)尽量减小微球的体积,提高其比表面积。
3 结 论
利用设计组装的微球制备系统,制备了AMRD微球。该微球能够对液体样品中的细菌进行吸附,并且能够提供营养成分供细菌生长;同时细菌的活动可导致微球中刃天青颜色变化,通过微球的颜色变化情况判断样品中细菌的数量。实验结果表明,其颜色变化时间与细菌的数量存在线性关系,这一关系受到小球中硅藻土与培养基含量的影响。当海藻酸钠∶硅藻土为1∶1.4(m/m)时,微球变色时间与细菌数量之间的线性关系最佳,并且在低浓度的环境中表现出较好的检测灵敏度。当微球中培养基浓度较高时,微球变色速率加快,但是在低浓度情况下的检测灵敏度降低。
本实验的微球计数法检测限约为2.02×102CFU/mL。对E.coli与S.aureu的检测灵敏度分别为1.62×103、2.03×103CFU/mL。检出时间约为2~16.5 h,比平板菌落计数方法所需的20~48 h有较大的缩短。
微球对细菌的吸附符合Freundlich等温吸附方程,属于单层表面吸附,在低浓度下受温度影响不大,1/n在0.5~1.0之间,属于中等吸附,吸附饱和大约需要30~45 min。
AMRD微球细菌计数法采用事先制备并分装的微球小管,使用时无需对样品稀释,直接加样并培养即可,是一种简单易操作、灵敏度高且快速经济的细菌计数新方法,使用的培养基相对平板菌落计数法而言大大减少,在食品、水源、环境检测等领域有着广泛的应用前景。
[1] 卫生部. GB 4789.2—2010 食品卫生微生物学检验: 菌落总数测定[S]. 北京: 中国标准出版社, 2010.
[2] 唐倩倩, 叶尊忠, 王剑平, 等. ATP 生物发光法在微生物检验中的应用[J]. 食品科学, 2008, 29(6): 460-465.
[3] 王晶, 王静雪, 林洪, 等. NADH荧光法快速检测细菌总数[J]. 微生物学通报, 2009, 36(5): 773-779.
[4] GUNASEKERA T S, ATTFIELD P V, VEAL D A. A flow cytometry method for rapid detection and enumeration of total bacteria in milk[J]. Applied and Environmental Microbiology, 2000, 66(3): 1228-1232.
[5] FLINT S, WALKER K, WATERS B, et al. Description and validation of a rapid (1 h) flow cytometry test for enumerating thermophilic bacteria in milk powders[J]. Journal of Applied Microbiology, 2007, 102(4): 909-915.
[6] 傅昕, 张何, 黄可龙. 硅壳包被的核壳型量子点荧光纳米颗粒的制备及其细菌计数的应用[J]. 分析化学, 2012, 41(8): 1169-1174.
[7] CARUSO G, CRISAFI E, MANCUSO M. Development of an enzyme assay for rapid assessment of Escherichia coli in seawaters[J]. Journal of Applied Microbiology, 2002, 93(4): 548-556.
[8] TORIJA M J, MATEO E, GUILLAM N J M, et al. Identification and quantification of acetic acid bacteria in wine and vinegar by TaqMan-MGB probes[J]. Food Microbiology, 2010, 27(2): 257-265.
[9] YULIN S, YANKUN P, FEIFEI T, et al. Assessment of characteristic parameters of total viable count of fresh pork based on hyperspectral images[J]. Journal of Food Safety and Quality, 2012, 3(6): 595-599.
[10] 艾玉琴, 王作洲, 张丽萍. 刃天青快速检验乳粉中总菌数的研究[J].黑龙江八一农垦大学学报, 1993, 7(2): 96-99.
[11] ZHANG Haixia, DU Guanhua, ZHANG Juntian. Assay of mitochondrial functions by resazurin in vitro[J]. Acta Pharmacologica Sinica, 2004, 5(3): 385-389.
[12] 张应龙, 王立东, 战伟伟, 等. 肉品新鲜度快速检测技术研究进展[J].肉类研究, 2011, 25(8): 42-46.
[13] 李文颜, 高洪岩, 郝爱国, 等. 快速龋病活跃性检测-刃天青药片的研究[J]. 现代口腔医学杂志, 2007, 21(6): 567-569.
[14] 田波, 姜瞻梅, 任大喜. 氧含量对还原法检测原料乳细菌总数的影响[J]. 中国乳品工业, 2005, 33(11): 21-22.
[15] 朱晨华, 沈鹤柏, 徐瑞云. 磁性壳聚糖微球对牛血清白蛋白的吸附性能[J]. 物理化学学报, 2007, 23(10): 1583-1588.
[16] 陆爱霞, 焦丽敏, 廖学品. 胶原纤维固化铁(Ⅲ)吸附材料的制备及其吸附细菌[J]. 化工学报, 2006, 57(4): 886-891.
[17] 高强, 徐耀, 吴东. 氨基酸在固体表面的吸附[J]. 化学进展, 2007, 19(6): 1016-1025.
[18] 蒋代华, 黄巧云, 蔡鹏, 等. 粘粒矿物对细菌吸附的测定方法[J]. 土壤学报, 2007, 44(4): 656-662.
[19] 殷钢, 詹劲, 刘铮, 等. 羟基磷灰石对牛血清白蛋白的吸附特性研究[J].高等学校化学学报, 2001, 22(5): 771-775.
[20] 施小茹, 冷赢, 韩丽娜, 等. 人工晶体细菌粘附实验研究[J]. 白求恩医科大学学报, 2001, 27(4): 369-370
[21] 陈益清, 孙多先, 刘静怡, 等. 微囊化海藻酸离子移变凝胶的制备、结构与性能[J]. 高等学校化学学报, 2003, 24(1): 117-120.
[22] 康春莉, 高红杰, 郭平, 等. 吸附铅、镉固定化细菌胞壁多糖小球包埋条件的优化选择[J]. 生态环境, 2007, 16(3): 825-829.
[23] 朱孟府, 龚承元, 苏建勇, 等. 荷正电滤板的吸附分离性能评价[J].水处理技术, 2006, 32(1): 80-82.
[24] 邱海霞, 于九皋, 林通. 羧甲基纤维素钠/蒙脱土纳米复合膜的制备及性能[J]. 高分子学报, 2004(3): 419-423.
Rapid Detection of Total Bacterial Number Using Alginate-Medium-Resazurin-Diatomaceous Silica Microspheres Method
WEI Wei1,2, LI Zheng-guo2, CHENG Chan-juan3, YANG De-fang4
(1. College of Life Science, Chongqing Normal University, Chongqing 400047, China; 2. Genetic Engineering Research Center, College of Bio-Engineering, Chongqing University, Chongqing 400045, China; 3. Chongqing No. 95 Middle School, Chongqing 400084, China; 4. Chongqing Bashu Middle School, Chongqing 400013, China)
Alginate-medium-resazurin-diatomaceous silica microspheres (AMRD microspheres) were prepared to establish a rapid method for counting the number of bacterial cells. The results suggested that the positive optimum linear correlation between the concentration of bacterial cells and discoloration time of AMRD microcapsules was achieved at a ratio of alginate to diatomaceous silica of 1:1.4 with single medium concentration. The limit of detection (LOD) of the method was 2.02×102CFU/mL. The detection time was 2–16.5 h. The detection sensitivities for Escherichia coli and Staphylococcus aureus were 1.62 × 103CFU/mL and 2.03 × 103CFU/mL, respectively. The adsorption isotherms could be described by the Freundlich equation and the coefficient of adsorption (1/n) was 0.5–1.0, which was thus considered as moderate adsorption. No significant change in the adsorption capacity was observed at varying temperatures at a low bacterial cell concentration and the time needed to reach the maximum bacterial adsorption balance was 30–45 min. In conclusion, AMRD microcapsules is a new rapid and economical bacterial cell counting method, which can be applied in the fields of food, water source and environmental monitoring.
alginate; diatomaceous silica; resazurin; bacterial cell counting; adsorption for bacteria
Q93.332
A
1002-6630(2014)04-0179-07
10.7506/spkx1002-6630-201404037
2013-05-08
重庆师范大学精品课程项目(重师教发[2010]No.138);重庆师范大学校级青年基金项目(12XWQ15);重庆师范大学“活性物质生物技术教育部工程研究中心”建设项目(GCZX2012-4)
韦伟(1980—),男,讲师,博士研究生,研究方向为微生物学。E-mail:weiwei_cqnu@163.com
