响应面法优化碱性蛋白酶酶解草鱼蛋白质
2014-01-18袁美兰陈丽丽温慧芳
石 岭,赵 利*,袁美兰,苏 伟,刘 华,陈丽丽,温慧芳
(江西科技师范大学生命科学学院,国家淡水鱼加工技术研发分中心(南昌),江西 南昌 330013)
响应面法优化碱性蛋白酶酶解草鱼蛋白质
石 岭,赵 利*,袁美兰,苏 伟,刘 华,陈丽丽,温慧芳
(江西科技师范大学生命科学学院,国家淡水鱼加工技术研发分中心(南昌),江西 南昌 330013)
用Alcalase碱性蛋白酶对草鱼蛋白质进行酶解,比较酶的添加量、pH值、温度、料液比以及酶解时间对草鱼蛋白水解进程的影响,通过响应面法优化Alcalase碱性蛋白酶酶解反应的工艺条件。结果表明:Alcalase碱性蛋白酶酶解草鱼蛋白质的最优工艺条件为:加酶量1.8%、酶解温度55 ℃、酶解pH 9.0、料液比1∶15、酶解时间180 min,此条件下蛋白质水解度达到23.46%。
草鱼蛋白;酶解;响应面
我国是世界渔业大国,淡水鱼产量已经连续20年居世界第一。近年来随着我国淡水鱼产品出口量逐年增加,淡水养殖的发展空间更加广阔。但同时淡水鱼产品中还存在着加工利用率低,低附加值产品多,深加工产品少等现象。鱼蛋白质经酶解后得到的水解物,其溶解性、乳化性、起泡性和流变性等物理特性得到明显改善[1-2],且水解液中氨基酸种类齐全[3],矿物质含量丰富,其中不同长度的肽段具有促进氨基酸、矿物质元素的吸收[4-5]、调节脂肪代谢[6-7]、降血压[8-12]、抗疲劳[13-14]和抗氧化[15-20]等生理功能。本研究采用Alcalase碱性蛋白酶水解草鱼蛋白,通过Box-Behnken试验以及响应面分析,优化Alcalase碱性蛋白酶酶解草鱼蛋白的条件,为淡水鱼资源的精深加工利用提供参考。
1 材料与方法
1.1 材料与试剂
草鱼 乐买佳超市;Alcalase碱性蛋白酶(200000U/mL)诺维信生物技术有限公司。
1.2 仪器与设备
微波耦合酶反应器 江南大学;JJ-2高速组织捣碎机 上海标本模型厂;TDL-5A离心机 上海菲恰尔分析仪器有限公司;DELTA-320 pH计 美国梅特勒-托利多公司。
1.3 方法
1.3.1 草鱼鱼肉成分的测定
水分含量:GB 5009.3—2010《食品中水分的测定》;蛋白质含量:GB 5009.5—2010《食品中蛋白质的测定》;灰分:GB 5009.4—2010《食品中灰分的测定》;脂肪含量:GB/T 5009.6—2003《食品中脂肪的测定》。
1.3.2 草鱼蛋白的酶解工艺流程
新鲜鱼→宰杀→清洗→采肉→绞碎→取肉→调节温度和pH值→加酶水解→灭酶→离心取上清液→喷雾干燥
1.3.3 草鱼蛋白质酶解
1.3.3.1 料液比对蛋白质水解进程的影响
称取鱼肉180、225、300、450、900 g,分别加入4 500 mL水于酶反应器中,即固液比为1∶25、1∶20、1∶15、1∶10、1∶5,搅拌混匀,调节水浴温度为55 ℃,用1 mol/L氢氧化钠溶液调节pH 8.5,待底物温度上升至设定温度,加入鱼肉蛋白质质量3%的Alcalase碱性蛋白酶进行反应,反应过程中用1 mol/L氢氧化钠溶液恒定体系pH值。酶解3 h后95 ℃灭酶5 min,离心取上清液,每个水平分别重复3次。
1.3.3.2 pH值对蛋白质水解进程的影响
称取鱼肉300 g,加入4 500 mL水于酶反应器中。调节水浴温度为55 ℃,同时调节体系pH值,分别使底物在pH值为7.5、8.0、8.5、9.0、9.5条件下酶解,其余条件同1.3.3.1节。
1.3.3.3 温度对蛋白质水解进程的影响
称取鱼肉300 g,加入4 500 mL水于酶反应器中。调节体系pH值为8.5,调节水浴温度分别为45、50、55、60、65 ℃;其余条件同1.3.3.1节。
1.3.3.4 加酶量对蛋白质水解进程的影响
分别称取鱼肉300 g,加入4 500 mL水于酶反应器中。调节体系pH值为8.5,调节水浴温度为55 ℃;向底物中分别加入质量分数0.5%、1%、1.5%、2%、3%、6%的Alcalase碱性蛋白酶,其余条件同1.3.3.1节。
1.3.3.5 酶解时间对蛋白质水解进程的影响
称取鱼肉300 g,加入4 500 mL水于酶反应器中。调节体系pH值为8.5,调节水浴温度为55 ℃;向底物中加入蛋白质质量1% Alcalase碱性蛋白酶,反应过程中用1 mol/L氢氧化钠溶液恒定体系pH值。当反应体系的pH值几乎不再改变时,停止反应,95 ℃灭酶5 min,离心取上清液。
1.3.4 响应面试验设计
应用Box-Behnken试验设计原理,在单因素试验确定的最佳试验因素水平的基础上进行响应面试验,采用Design Expert v7.1.6软件对试验结果进行优化以及结果分析。
1.3.5 水解度的测定
水解度(degree of hydrolysis,DH)的计算采用pH-state 法并参照袁斌等[21]的方法。

式中:h为每克蛋白质水解肽键的物质的量/mmol;V为所消耗的NaOH体积/mL;Nb为NaOH的浓度/(mmol/mL);mp为底物中蛋白质质量/g;htot为每克蛋白质中肽键的物质的量/mmol,对草鱼蛋白而言,该值取8.6 mmol[22];α为氨基的平均解离度。
2 结果与分析
2.1 草鱼鱼肉基础成分

表1 草鱼鱼肉的化学成分Table 1 Chemical composition of grass carp meat
草鱼鱼肉的基础成分如表1所示,以干质量计,草鱼鱼肉蛋白质含量为86.86%、脂肪含量为5.22%,草鱼鱼肉蛋白质含量高脂肪含量低,是一种优质的蛋白质资源。
2.2 Alcalase碱性蛋白酶水解单因素试验
2.2.1 料液比对水解度的影响
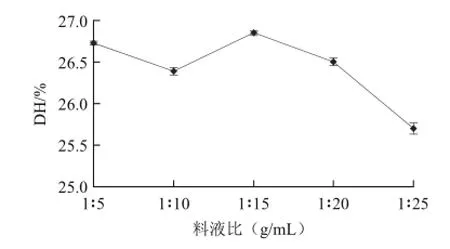
图1 料液比对水解度的影响Fig.1 Effect of liquid-to-material ratio on degree of hydrolysis
由图1可知,随着底物添加量的减小,水解度总体呈下降趋势。因为底物添加量较低时酶与底物结合的几率较小,故水解度会降低。增大底物添加量时水解度会相应的提高;但当底物添加量过大时蛋白溶液的黏度又会增大,使得流动性变差,不利于操作。因此最终选择料液比为1∶15较为适宜。
2.2.2 pH值对水解度的影响
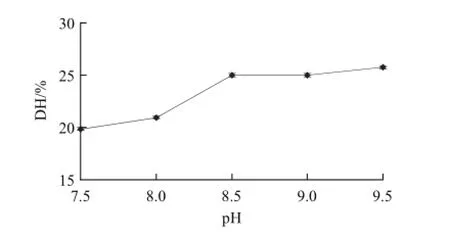
图2 pH值对水解度的影响Fig.2 Effect of pH on degree of hydrolysis
由图2可知,随着pH值的增加,水解度呈上升趋势;当pH值超过8.5时,水解度上升比较缓慢,这是因为Alcalase碱性蛋白酶对碱性环境有较强的适应性,所以溶液的pH值升高,水解度也会相应的提高。但是由于溶液碱性越大,反应后中和水解液时产生的盐就越多,这将给后续的处理带来不便,所以选pH 8.5作为最优条件。

图3 温度对水解度的影响Fig.3 Effect of temperature on degree of hydrolysis
2.2.3 温度对水解度的影响由图3可以看出,当温度在45~55 ℃时,水解度随着温度的升高而增加;当温度达到55 ℃时,水解度达到最大值25.02%;当温度超过55 ℃时,水解度开始下降。温度升高可以提高酶的活性,且有利于底物折叠结构的展开;当温度继续升高,超过了酶的最适宜温度时,酶逐渐失活,导致蛋白质水解度下降[23]。
2.2.4 蛋白酶添加量对水解度的影响
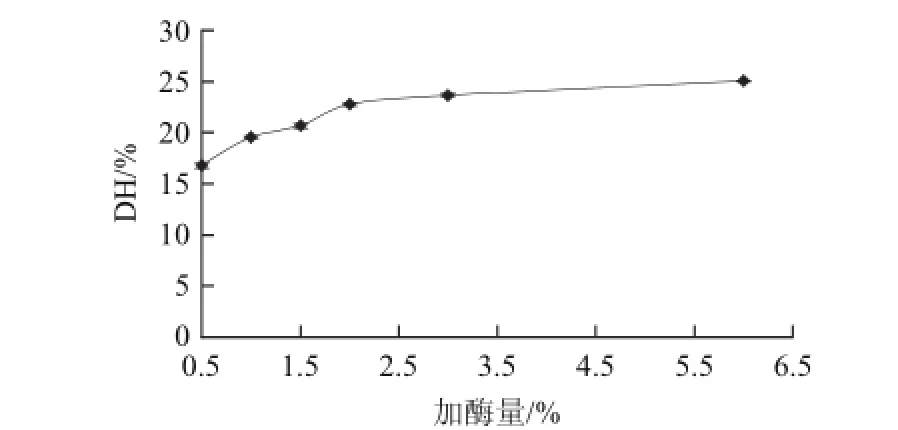
图4 加酶量对水解度的影响Fig.4 Effect of enzyme/substrate ratio on degree of hydrolysis
由图4可知,蛋白质的水解度会随着Alcalase碱性蛋白酶添加量(质量分数)的增多而增大,但当Alcalase碱性蛋白酶的添加量超过蛋白质质量的2%时,水解度的增加曲线趋于平缓,所以选择2%为最优条件。又由于在工业生产中出于成本核算的考虑,酶用量一般不超过2%,故后续实验中碱性蛋白酶添加量以2%为上限。
2.2.5 酶解时间对水解度的影响
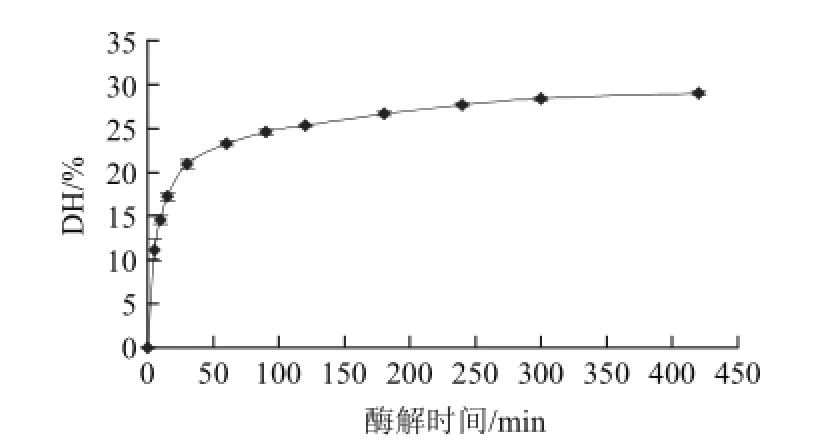
图5 酶解时间酶解对水解度的影响Fig.5 Effect of hydrolysis time on degree of hydrolysis
由图5可知,水解度会随着酶解时间的延长而增大,水解曲线呈先快速上升后缓慢上升的的趋势,当时间达到180 min时,蛋白酶基本和蛋白质完全作用,继续水解底物浓度会继续减小,随着水解的进行酶的特异性催化位点减少,即水解过程中酶逐渐失活[24]。同时产生的多肽会与草鱼蛋白竞争作为Alcalase碱性蛋白酶的反应底物,从而进一步抑制蛋白酶的水解作用[25]。考虑到随着酶解时间的延长成本会增加,所以选择180 min作为最佳条件。
2.3 Alcalase碱性蛋白酶酶解反应的响应面试验
根据单因素试验结果,选择对草鱼蛋白水解度影响较大的3个因素:pH值(A)、温度(B)、加酶量(C)为考察对象,以水解度DH(Y)为指标,采用Design Expert v 7.1.6软件进行响应面试验。试验的因素水平如表2所示。
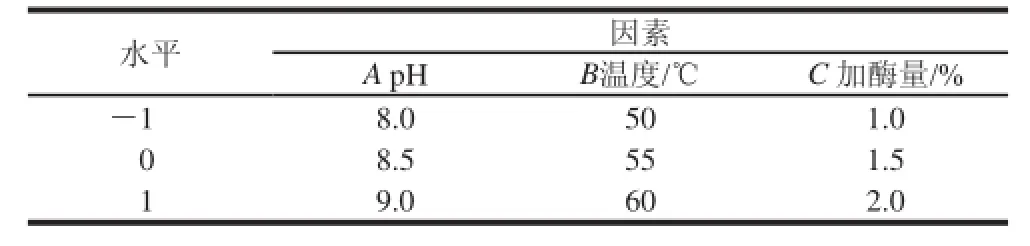
表2 Alcalase碱性蛋白酶酶解草鱼蛋白响应面试验因素水平表Table 2 Factors and their coded levels tested in response surface analysis

表3 Alcalase碱性蛋白酶酶解草鱼蛋白响应面试验设计及结果Table 3 Experimental design and results for response surface analysis

表4 响应面二次模型方差分析Table 4 Analysis of variance for the developed regression model
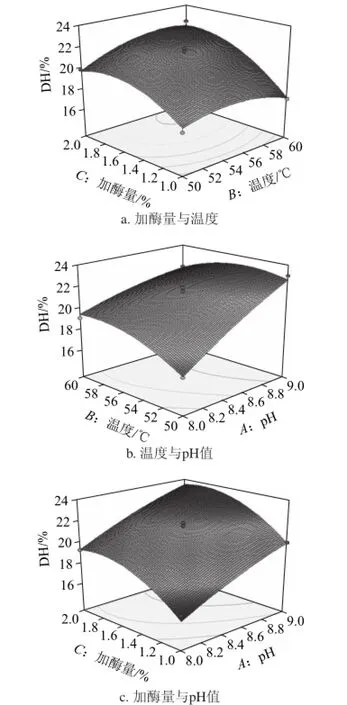
图6 各因素及交汇作用对水解度的影响Fig.6 Response surface plots for the effects of factors and their interactions on degree of hydrolysis
通过统计分析软件Design Expert v 7.1.6进行数据分析,建立二次响应面回归模型为:DH=21.38+2.02A+0.43B+1.67C-0.87AB+0.027AC+0.66BC-0.31A2-0.91B2-1.34C2,回归分析与方差分析结果见表3,交互作用的响应面分析见图6。由表4可知,方程因变量与自变量之间的线性关系明显,该模型回归显著(P<0.000 1),失拟项不显著,且该模型说明该模型与实验拟合良好,自变量与响应值之间线性关系显著,可用于该反应的理论推测。在此基础上优化Alcalase碱性蛋白酶最佳酶解条件参数为:加酶量1.8%、酶解温度55 ℃、酶解pH 9.0,预测水解度为23.62%,在此条件下酶解180 min,蛋白水解度为23.46%。所以说明响应面的实验值与回归方程预测值基本吻合,建立的模型可以对实际工艺进行预测。
3 结 论
以水解度为指标,通过单因素试验确定Alcalase碱性蛋白酶酶解草鱼蛋白的料液比、pH值、温度、加酶量的最适范围。采用Design Expert v7.1.6软件,通过Box-Behnken试验得到水解度与p H值(A)、温度(B)、加酶量(C)关系的回归模型,回归方程为:DH=21.38+2.02A+0.43B+1.67C-0.87AB+0.027AC+0.66BC-0.31A2-0.91B2-1.34C2。Alcalase碱性蛋白酶酶解草鱼蛋白的最佳酶解工艺为:加酶量1.8%、酶解温度55 ℃、酶解pH 9.0、料液比1∶15、酶解时间180 min,蛋白质水解度达到23.46%。本实验采用Alcalase碱性蛋白酶酶解草鱼蛋白,研究了响应面优化酶解工艺,而酶解产生的多肽的分离纯化以及结构功能仍有待进一步的研究。
[1] KLOMPONG V, BENJAKUL S, KANTACHOTE D, et al. Antioxidative activity and functional properties of protein hydrolysate of yellow stripe trevally (Selaroides leptolepis) as influenced by the degree of hydrolysis and enzyme type[J]. Food Chemistry, 2007, 102: 1317-1327.
[2] RAHALI V, CHOBERT J M, HTERTLE T, et al. Emusification of chemical and enzymatic hydrolysates of β-lactogobulin: characterization of the peptides adsorbed at the interface[J]. Nahrung, 2000, 44(2): 89-95.
[3] 王新星, 孔凡华, 许团辉, 等. 水解鱼蛋白营养组成及评价[J]. 渔业科学进展, 2011, 32(3): 104-110.
[4] NESSE K O, NAGALAKSHMI A P, MARIMUTHU P, et al. Efficacy of a fish protein hydrolysate in malnourished children[J]. Indian Journal of Clinical Bio-chemistry, 2011, 26(4): 360-365.
[5] ZAMBONINO INFANTE J L, CAHU C L, PERES A, et al. Partial substitution of di-and tripeptides for native proteins in sea bass diets improves Dicentrarchus labrax larval development[J]. The Journal of Nutrition, 1997, 127: 608-614.
[6] 夏松养, 邓尚贵, 谢超, 等. 鳀鱼(Engraulis japonicus)蛋白水解物的营养成分及抗高血脂作用的研究[J]. 海洋与湖沼, 2008, 39(4): 368-373.
[7] SAITO M, KIYOSE C, HIGUCHI T, et al. Effect of collagen hydrolysates from salmon and trout skins on the lipid profile in rats[J]. Journal of Agricultural and Food Chemistry, 2009, 57: 10477-10482.
[8] CMOELLY V D V, HARRY G, DRIES B A, el al. Optimisation of the angiotensin converting enzyme inhibition by whey protein hydrolysates using response surface methodology[J]. International Dairy Journal, 2002, 12: 813-820.
[9] 陶以嘉, 徐大立, 王燎, 等. 高血压研究进展[J]. 心血管病学进展, 2004(增刊1): 118-123.
[10] 封梅. 酶解草鱼制备降血压肽的研究[D]. 武汉: 武汉工业学院, 2008.
[11] SUETSUNA K, OSAJIMA K. The inhibitory activities against angiotensin Ⅰ-converting enzyme of basic peptides originating from sardine and hair tail meat[J]. Bulletin of the Japanese Society of Scientific Fisheries, 1986, 52: 1981-1984.
[12] BYUN H G, KIM S K. Purification and characterization of angiotensinⅠconverting enzyme (ACE) inhibitory peptides from Alaska Pollack (Theragra chalcogramma) skin[J]. Process Biochemistry, 2001, 36: 1155-1162.
[13] 赵玉红, 孔保华, 张立钢. 鱼肽的抗疲劳功能研究[J]. 东北农业大学学报, 2005, 36(4): 490-493.
[14] ADLER N J. Enzymic hydrolysis of food protein[M]. London: Elsevier, 1986: 10-11.
[15] 任娇艳. 草鱼蛋白源抗疲劳生物活性肽的制备分离及鉴定技术研究[D]. 广州: 华南理工大学, 2008.
[16] LI Li, WANG Jinshui, ZHAO Mouming, et al. Artificial neural networks for production of antioxidant peptides derived from big head carp with Alcalase[J]. Food Technology Biotechnology, 2006, 44(3): 441-448.
[17] 李琳. 鳙鱼蛋白控制酶解及酶解物抗氧化研究[D]. 广州: 华南理工大学, 2006.
[18] SHIMONOSEK I. Separation and identification of antioxidant peptide from proteolytre digest of dried bonito[J]. Bulletin of the Japanese Society of Scientific Fisheries, 65(1): 92-96.
[19] KIM S, JE J, KIM S. Purification and characterization of antioxidant peptide from hoki (Johnius belengerii) frame protein by gastrointestinal digestion[J]. The Journal of Nutritional Biochemistry, 2006, 18(1): 31-38.
[20] JEON Y J, BYUN H G, KIM S K. Improvement of functional properties of cod frame protein hydrolysates using ultrafiltration membranes[J]. Process Biochemistry, 1999, 35: 471-478.
[21] 袁斌, 吕桂善, 刘小玲. 蛋白质水解度的简易测定方法[J]. 广西农业生物科学, 2002, 21(2): 113-115.
[22] 李雪, 罗永康, 尤娟. 草鱼鱼肉蛋白酶解物抗氧化性及功能特性研究[J]. 中国农业大学学报, 2011, 16(1): 94-99
[23] 左继红. 微波辅助蛋白酶水解反应工艺和反应器的研究[D]. 无锡:江南大学, 2008.
[24] MULLALLY M M, O’CALLAGHAN D M, FITZGERALD R J, et al. Zymogen activation in pancreatic endoproteolytic preparations and influence on some whey protein hydro lysate characteristics[J]. Journal of Food Science, 1995, 60(2): 227-233.
[25] 林伟锋. 可控酶解从海洋鱼蛋白中制备生物活性肽的研究[D]. 广州: 华南理工大学, 2003.
Optimizing Conditions for Alcalase-Catalyzed Hydrolysis of Grass Carp Protein by Response Surface Methodology
SHI Ling, ZHAO Li*, YUAN Mei-lan, SU Wei, LIU Hua, CHEN Li-li, WEN Hui-fang
(National R&D Branch Center for Freshwater Fish Processing, College of Life Science, Jiangxi Science and Technology Normal University, Nanchang 330013, China)
This study aimed to optimize the conditions for enzymatic hydrolysis of grass carp proteins. Alcalase was used to hydrolyze grass carp proteins. The effects of enzyme/substrate ratio, pH value, temperature, material/liquid ratio and hydrolysis time on the degree of hydrolysis were analyzed. Box-Behnken design (BBD) and response surface methodology (RSM) were adopted to obtain the optimum hydrolysis conditions on the basis of results of single-factor experiments. The degree of hydrolysis of 23.46% was obtained under the optimum hydrolysis conditions of 1.8%, 55 ℃, 1:15, 180 min and 9.0 for enzyme/substrate ratio, temperature, material/liquid ratio, hydrolysis time, and pH, respectively.
grass carp protein; enzymatic hydrolysis; response surface methodology
TS254.4
A
1002-6630(2014)04-0026-04
10.7506/spkx1002-6630-201404006
2013-04-25
江西省高等学校科技落地计划项目(KJLD12009)
石岭(1989—),男,硕士研究生,研究方向为食品化学。E-mail:839066518@qq.com
*通信作者:赵利(1967—),女,教授,博士,研究方向为食品化学。E-mail:lizhao618@hotmail.com
