响应面法优化兰州百合干无硫护色剂配方
2014-01-18李永才马彦青
李 霞,李永才*,毕 阳,马彦青
(甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
响应面法优化兰州百合干无硫护色剂配方
李 霞,李永才*,毕 阳,马彦青
(甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
为有效解决兰州百合干制过程的褐变问题,开发兰州百合干无硫护色技术,选取护色剂抗坏血酸、柠檬酸、L-半胱氨酸、氯化钠为影响因子,以百合干色泽(L*值)为响应值。在单因素试验的基础上,采用Box-Behnken试验设计构建二次多项式回归方程的模型,进行响应面分析。结果表明:护色剂复合作用对百合干色泽的影响程度依次为:L-半胱氨酸>抗坏血酸>氯化钠>柠檬酸,复合护色剂的最优配方(质量分数)为:0.65%氯化钠、0.3%抗坏血酸、0.3% L-半胱氨酸、0.8%柠檬酸,在此条件下,加工的百合干色泽L*值为78.69,护色效果好。
兰州百合;干制;护色剂;褐变;响应曲面
我国以食用为目的百合主要有宜兴百合、龙牙百合以及兰州百合3个品系[1]。各品系不仅营养成分的含量有明显差异,品质和风味也各不一样。兰州百合(Lanzhou Lily)是百合科(Liliaccae)百合属(Lilium)川百合的一个变种,是一种多年生鳞茎类草本植物,其色泽洁白如玉、肉质肥厚香甜[2-4],且以含糖量高、粗纤维甚低而著称[5],其品质闻名于天下,故有“兰州百合甲天下”美誉。
由于鲜百合含水量高,不便于贮藏和长途运输。因此百合干便成为兰州百合的主要加工产品之一。但百合在干燥过程极易发生褐变,严重影响其外观品质。褐变现象的机理可分为酶促褐变与非酶促褐变[6]。目前兰州百合干生产中多用含二氧化硫的护色剂(如焦亚硫酸钠等)[7-8]。亚硫酸盐由于不仅能有效抑制酶促褐变,还能抑制非酶褐变(包括羰氨反应、焦糖化和抗坏血酸的自动氧化),从而延缓或抑制褐变发生[9-10]。虽然含二氧化硫的护色剂护色效果较好,但产品中会存在二氧化硫的残留,不仅严重影响百合干出口,还易导致二氧化硫超标、百合干清香丧失和口味酸化,对人体健康也有一定危害[11-12]。因此,研究开发代替二氧化硫的兰州百合干护色技术对保障该产品的食品安全性具有重要意义。
本实验以兰州百合为原料,选择不同的无硫护色剂及其质量分数,采用响应面优化法,以百合干制过程色泽的变化为检验指标,确定最佳的无硫复合护色剂配方,为无硫脱水百合干的加工提供理论依据。
1 材料与方法
1.1 材料与试剂
鲜百合购自兰州市西果园百合种植基地,要求新鲜、个大色白、鳞片肥厚、无病虫害及机械损伤,贮藏于冷库中(0~2 ℃)备用;抗坏血酸、柠檬酸、L-半胱氨酸、氯化钠均为国产分析纯。
1.2 仪器与设备
AL-24电子分析天平 梅特勒-托利多仪器(上海)有限公司;恒温干燥箱 上海一恒科学仪器有限公司;SP62-色度测试仪 美国爱色丽股份有限公司。
1.3 方法
1.3.1 工艺流程
百合→剥片→清洗→烫漂→护色→干燥→成品→测定百合干色泽
1.3.2 护色处理
取新鲜的百合,剥片、清洗,在100 ℃热水中烫漂2 min后,浸泡于备好的护色液中,浸泡时间5 min。然后取出漂洗,沥干水分,放入恒温干燥箱中干燥,干燥温度60 ℃,干至水分含量约为8%。
1.3.3 无硫百合干色泽测定
取干燥后的百合片,用色度测试仪测定百合干的色泽。在预实验中测量百合色泽时发现a*值多为负值,而b*值也偏小,百合颜色呈现出的是白色,所以L*值作为标准更适合百合色泽的测定。色度仪中的L*值表示表面色泽的明暗度,主要取决于产品表面的反射率。L*值越大表明颜色越白,褐变程度越低;反之则暗、褐变程度高[13]。采用色度仪对百合干的褐变程度进行评价,能够客观地反映色泽的差异,且便于统计和比较。
1.3.4 单因素试验
分别以0.15%、0.20%、0.25%、0.30%、0.35%、0.40%的抗坏血酸,0.2%、0.4%、0.6%、0.8%、1.0%、1.2%的柠檬酸,0.05%、0.10%、0.15%、0.20%、0.25%、0.30%的L-半胱氨酸,0.2%、0.4%、0.6%、0.8%、1.0%、1.2%的氯化钠为单因素进行试验,研究各单因素对百合干制后的色泽(L*值)的影响,确定各护色剂的最佳作用范围。
1.3.5 响应面法对护色剂配方的优化
在单因素试验的基础上,根据Box-Behnken的试验设计原理[14-15],以百合干制后的色泽(L*值)为响应值,设计四因素三水平响应面分析试验。
2 结果与分析
2.1 单因素试验
2.1.1 氯化钠对百合干色泽(L*值)的影响
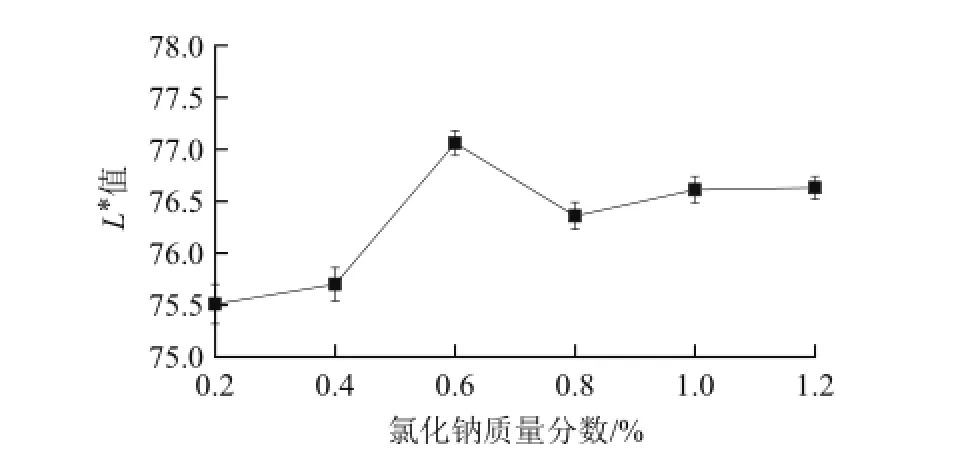
图1 氯化钠对百合干色泽(L*值)的影响Fig.1 Effect of sodium chloride treatment on L* value of dried lily
由图1可知,在低质量分数时随着氯化钠质量分数的增大,百合干色泽(L*值)逐渐升高,当质量分数达到0.6%时,L*值最大,但随着质量分数进一步提高,百合L*值减小,并逐渐趋于平缓。
氯化钠之所以能起到一定的护色效果,是由于其溶于水后,能减少水中的溶解氧,从而使酚类氧化酶难与氧直接接触[16]。且钠离子与多酚氧化酶中的铜离子竞争,降低多酚氧化酶的活性。此外氯化钠溶液质量分数大时具有高的渗透压,也可以使酶脱水失活,起到抑制酶促褐变的作用[17]。
2.1.2 抗坏血酸对百合干色泽(L*值)的影响
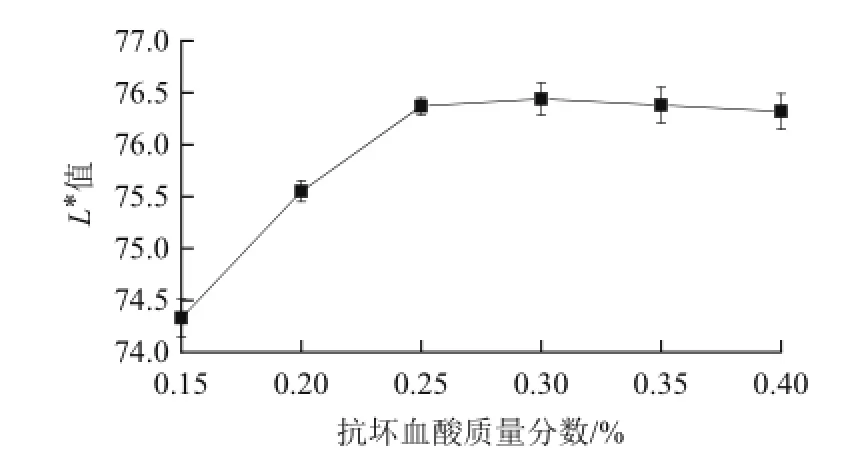
图2 抗坏血酸对百合干色泽(L*值)的影响Fig.2 Effect of ascorbic acid treatment on L* value of dried lily
由图2可知,抗坏血酸处理能有效地抑制百合干加工过程中的褐变,且随着抗坏血酸质量分数的增加,低质量分数时L*值逐渐增大,当抗坏血酸质量分数超过0.25%时,L*值增加趋于平缓。
抗坏血酸本身不是一种酶抑制剂,其主要通过将O-醌还原成二羟基酚而间接地抑制酶活性[18]。如果有足够的抗坏血酸存在,氧化形成的产物就能被抗坏血酸迅速地还原,从而达到抑制酶促褐变的目的。抗坏血酸的作用主要是保护色素以及风味物质和一些营养物质,避免与其氧气作用发生变化,从而起到护色的效果[19]。
2.1.3 L-半胱氨酸对百合干色泽(L*值)的影响
由图3可知,随着L-半胱氨酸质量分数的逐渐增加,L*值逐渐增大,当L-半胱氨酸质量分数达到0.25%时,L*值达到最大值,护色效果最好,之后随着L-半胱氨酸质量分数的增加,L*值迅速减小。
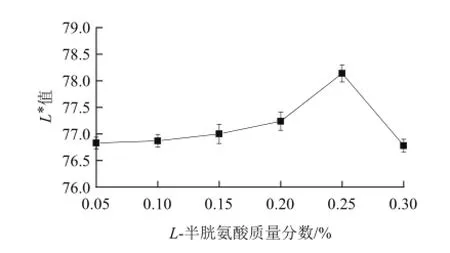
图3 3 L-半胱氨酸对百合干色泽(L*值)的影响Fig.3 Effect of L-cysteine treatment on L* value of dried lily
L-半胱氨酸抑制褐变的机理有两种解释:第一种是作为硫醇类化合物可以结合酶活性中心的铜离子,从而抑制酶的活力;第二种是硫醇类化合物可以在酶促反应过程中与生成的产物醌发生快速的非酶催化反应,而结合形成一种稳定的无色化合物[20-21],通常认为起主要作用的是第二种机理。
2.1.4 柠檬酸对百合干色泽(L*值)的影响

图4 柠檬酸对百合干色泽(L*值)的影响Fig.4 Effect of citric acid treatment on L*value of dried lily
柠檬酸对百合干色泽的影响呈现先增加后降低的趋势(图4),低质量分数下随着柠檬酸质量分数的逐渐增加,L*值显著增加,当质量分数达到0.6%时,L*值最大,之后趋于平稳,但当质量分数超过1%时,L*值迅速减小。
柠檬酸可降低pH值,使氧气溶解度降低,且柠檬酸中的羰基可与多酚氧化酶中的铜离子产生比较强的螯合作用,对多酚氧化酶的活性有一定地抑制作用,即主要抑制酶促褐变。但当柠檬酸质量分数过高时,pH值太低,对金属离子的螯合作用较弱[22-23]。且柠檬酸添加过多口感偏酸。
2.2 百合干无硫护色剂最佳配方的确定
根据单因素试验所确定的各护色剂的最佳作用范围,以百合干色泽(L*值)为响应值,采用Disign-Expert软件中的Box-Behnken Design(BBD)试验设计方法,设计了四因素三水平共29个试验点的响应面试验。试验因素水平选取见表1,试验方案及结果见表2。

表1 响应面因素水平表Table 1 Factors and levels used in response surface analysis

表2 响应面分析试验设计方案及结果Table 2 Experimental design and corresponding results for response surface analysis

表3 回归方程模型方差分析及其系数的显著性检验Table 3 Analysis of variance for the fitted quadratic model and significance test of its regression coefficients
2.2.1 因素与百合干色泽(L*值)模型的建立
应用Design Expert 8.0.6软件对表2中的数据进行分析,获得回归模型为:

由表3可知,经显著性检验可以看出,回归模型高度显著,相关系数R2为0.993 6,调整相关系数R2Adj为0.867 1,说明模型的拟合度好,响应值的86.71%是由于所选变量引起,表明百合干色泽(L*值)实际值与预测值之间具有较好的拟合相关性。模型失拟项表示模型预测值与实际值不拟合的概率[24],本实验的模型失拟项的P值为0.642 3>0.1,模型失拟项不显著,进一步说明此模型的拟合度良好。变异系数(coeff cient of variance,CV)反映模型的置信度,CV值越低模型的置信度越高[25],本实验的CV值为0.58,说明模型方程能够较好地反映真实值。综合分析该模型拟合程度良好,故可使用该模型来分析和预测最佳护色剂配方。
对模型中的回归系数进行显著性检验可以看出,一次项中抗坏血酸、L-半胱氨酸以及交互项中氯化钠和柠檬酸、抗坏血酸和柠檬酸、L-半胱氨酸和柠檬酸对百合干色泽(L*值)有极显著影响(P<0.01);氯化钠和抗坏血酸对百合干色泽(L*值)有较显著影响(P<0.1)。对回归方程中一次项系数的绝对值进行比较,由表3可知各试验因素对百合干色泽(L*值)的影响顺序为:L-半胱氨酸>抗坏血酸>氯化钠>柠檬酸。
剔除不显著项(P>0.1),得优化回归模型为:

2.2.2 交互作用分析
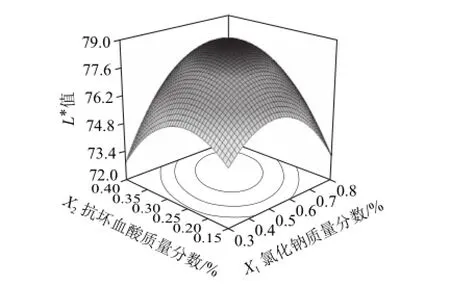
图5 抗坏血酸和氯化钠对百合干色泽(L*值)的影响Fig.5 Effects of ascorbic acid and sodium chloride on L* value of dried lily
从图5可以看出,抗坏血酸和氯化钠质量分数存在着协同作用,即在一定质量分数区域内,只有两者同时升高或同时降低,才能提高百合干色泽。当氯化钠质量分数为0.58%~0.63%,且抗坏血酸质量分数为0.28%~0.3%时,百合干色泽(L*值)取得最大值78.2。两者之间等高线的形状呈椭圆形,表明交互影响作用显著。

图6 氯化钠和L-半胱氨酸对百合干色泽(L*值)的影响Fig.6 Effects of sodium chloride and L-cysteine on L* value of dried lily
从图6可以看出,随着L-半胱氨酸质量分数的增加,氯化钠质量分数需相应增加,当L-半胱氨酸质量分数大于0.3%,并且氯化钠质量分数在0.55%~0.58%之间时,百合干色泽(L*值)取得最大值78.5,当L-半胱氨酸质量分数小于0.3%或氯化钠质量分数过高或过低时,都将导致百合干色泽(L*值)的降低。

图7 氯化钠和柠檬酸对百合干色泽(L*值)的影响Fig.7 Effects of sodium chloride and citric acid on L* value of dried lily
从图7可以看出,当氯化钠质量分数为0.55%~0.58%,柠檬酸质量分数为0.55%~0.58%时,百合干色泽(L*值)取得最大值78。当氯化钠和柠檬酸质量分数过高或者过低时都将导致百合干色泽(L*值)的降低。
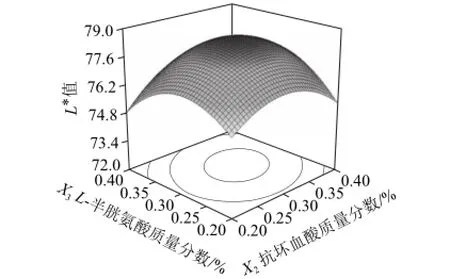
图8 抗坏血酸和L-半胱氨酸对百合干色泽(L*值)的影响Fig.8 Effects of ascorbic acid and L-cysteine on L* value of dried lily
从图8可以看出,当抗坏血酸质量分数为0.28%~0.32%,L-半胱氨酸质量分数为0.29%~0.32%时,百合干色泽(L*值)取得最大值78.8。当抗坏血酸质量分数大于0.32%或小于0.28%,L-半胱氨酸质量分数大于0.32%或小于0.29时,百合干色泽(L*值)下降。
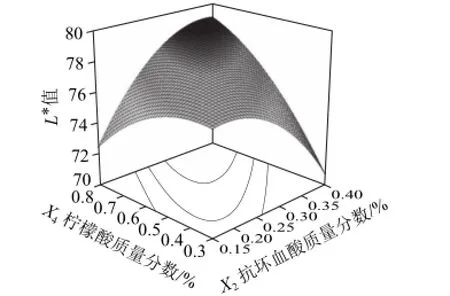
图9 抗坏血酸和柠檬酸对百合干色泽(L*值)的影响Fig.9 Effects of ascorbic acid and citric acid on L* value of dried lily
从图9可以看出,当抗坏血酸质量分数为0.32%~0.34%,柠檬酸质量分数大于0.7%时,百合干色泽(L*值)有最大值78.6。当抗坏血酸质量分数小于0.32%或大于0.34%,柠檬酸质量分数小于0.7%时,百合干色泽(L*值)呈下降趋势。

图10 10 L-半胱氨酸和柠檬酸对百合干色泽(L*值)的影响Fig.10 Effects of L-cysteine and citric acid on L* value of dried lily
从图10可以看出,当L-半胱氨酸质量分数为0.36%~0.38%,柠檬酸质量分数大于0.79%时,百合干色泽(L*值)有最大值79.2。当L-半胱氨酸质量分数小于0.36%或大于0.38%,柠檬酸质量分数小于0.79%时,百合干色泽(L*值)呈下降趋势。
2.2.3 最佳护色剂配方的确定及验证实验
根据二次回归的数学模型分析结果,得出最佳护色剂配方为:氯化钠质量分数0.65%、抗坏血酸质量分数0.3%、L-半胱氨酸质量分数0.3%、柠檬酸质量分数0.8%,此时百合干L*值的预测值为79.92。为了验证响应面法的可行性,将响应面二次回归所得最佳条件重复实验3次,百合干的实测L*值78.69,与理论值相差不大,充分验证了模型的正确性,表明响应面法适用于百合干无硫护色剂配方的优化。
3 结 论
在单因素试验设计的基础上,对百合干无硫护色剂进行了四因素三水平的Box-Behnken响应面试验设计,建立了响应值和各个因素之间的数学模型,依据此数学模型确定的最佳护色配方为氯化钠质量分数0.65%、抗坏血酸质量分数0.3%、L-半胱氨酸质量分数0.3%、柠檬酸质量分数0.8%, 此时百合干L*值的实测值为78.69。模型方差分析和响应面的分析表明,该模型回归极显著,对试验拟合较好,对无硫脱水百合干的生产有一定应用价值。
[1] 李天真. 百合功能性因子的研究进展[J]. 食品科技, 2007, 32(7): 248-252.
[2] 肖培根, 杨世林. 百合[M]. 北京: 中国中医药出版社, 2001.
[3] 杨林莎, 孙艳红, 方晓艳. 中药百合的研究进展[J]. 河南中医药学刊, 2002, 17(1): 74-76.
[4] 曲伟红, 周日宝, 童巧珍, 等. 百合的化学成分研究概况[J]. 湖南中医药导报, 2004, 10(3): 75-76.
[5] 齐士福. 兰州百合无公害栽培与贮运加工[M]. 兰州: 甘肃文化出版社, 2008: 14-16.
[6] 宋军阳, 杜军志, 张会梅. 果实采后酶促褐变研究进展[J]. 湖北农学院学报, 2001(1): 54-58.
[7] 陈洪国, 陈中. 硫处理技术在果蔬贮藏保鲜中的研究和应用[J]. 广东林业科技, 2001, 17(1): 45-49.
[8] PHOMKONG W, SOPONRONNARIT S, THAMMARUTWASIK P. Chemical pretreatments affecting drying characteristics of chilli (cv. huarou yon)[J]. Drying Technology, 2010, 28(12): 1466-1476.
[9] 谌国莲, 黄晓钰, 曾详添, 等. 整果荔枝干护色研究[J]. 食品科学, 2001, 22(8): 51-54.
[10] HAISMAIND R. The effect of sulphur dioxide on oxidizing enzyme systems in plant tissues[J]. Journal of the Science of Food and Agriculture, 1974, 25: 803-810.
[11] 周德庆, 张双灵, 辛胜昌. 亚硫酸盐在食品加工中的作用及其应用[J]. 食品科学, 2004, 25(12): 198-202.
[12] SAGAR V R, SURESH KUMAR P. Recent advances in drying and dehydration of fruits and vegetables: a review[J]. Journal of Food Science and Technology, 2010, 47(1): 15-26.
[13] 李波, 芦菲, 王东玲. 杏鲍菇干制的非硫护色方法研究[J]. 农业工程学报, 2008, 24(5): 258-260.
[14] 李新明, 张永茂, 张俊, 等. 干制苹果片无硫复合护色液的优化配制[J]. 北方园艺, 2011(10): 142-148.
[15] 徐向宏, 何明珠. 试验设计与Disign-Expert、SPSS应用[M]. 北京:科学出版社, 2010: 146-157.
[16] 何俊萍, 李建中, 苑杜强, 等. 双孢菇加工前变色反应及色泽控制[J].河北农业大学学报, 2002, 25(3): 54-56.
[17] 邹波. 果蔬加工过程中的褐变及护色措施[J]. 黔东南民族职业技术学院学报, 2008, 4(3): 23-25.
[18] 郭香凤, 史国安, 向进乐. 银条加工中烫漂护色工艺的研究[J]. 食品科学, 2007, 28(9): 222-225.
[19] 邓小莉, 常景玲, 王斌, 等. 石榴汁护色工艺[J]. 食品工业科技, 2011, 32(8): 266-272.
[20] CHRISTINE R, FLORENCE R, CLAUDE R, et al. A kinetic study of the inhibition of palmito polyphenol oxidase by L-cysteine[J]. The International Journal of Biochemistry & Cell Biology, 1996, 28(4): 457-463.
[21] 卢影, 郑建仙. 复合护色液对鲜切苹果的防褐变研究[J]. 现代食品科技, 2009, 25(9): 1024-1028.
[22] 方子铖, 李海平, 郑剑. 腌制竹笋防褐变无硫护色剂的研发[J]. 安徽农学通报, 2011, 23(17): 167-168.
[23] 綦菁华, 陈芳, 于同泉, 等. 干制板栗仁非硫护色的研究[J]. 食品科学, 2007, 28(1): 91-94.
[24] 卢可, 娄永江, 周湘池. 响应面优化杨梅果醋发酵工艺参数研究[J].中国调味品, 2011, 36(2): 57-60.
[25] 陈书勤, 黄健全, 黄康宁, 等. 响应面法在优化果糖和葡萄糖色谱分离中的应用[J]. 广西轻工业, 2011(10): 20-21.
Formula Optimization of Non-Sulfur Color-Protective Agents for Dried Lanzhou Lily by Response Surface Methodology
LI Xia, LI Yong-cai*, BI Yang, MA Yan-qing
(College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China)
This study aimed to solve the problem of browning of Lanzhou lily during drying process and to develop a nonsulfur color-protective agent for dried Lanzhou lily. Four components including ascorbic acid, citric acid, L-cysteine and sodium chloride were used as influencing factors and the color (L* value) of dried lily was used as response value. Based on one-factor-at-a-time experiments, Box-Behnken design (BBD) was applied to establish the correspon ding mathematical model. The results showed that the protective effects of these four components on lily color followed the decreasing order: L-cysteine > ascorbic acid > sodium chloride > citric acid. The optimum formula (by mass) was composed of 0.65% sodium chloride, 0.3% ascorbic acid, 0.3% L-cysteine and 0.8% citric acid. Under the optimal conditions, the L* value of dried lily was 78.69 indicating a good color-protecting effect.
Lanzhou lily; drying process; color-protectiive agent; browning; response surface methodology
TS255.52;TS201.1
A
1002-6630(2014)04-0016-05
10.7506/spkx1002-6630-201404004
2013-03-14
甘肃省应用技术研究与开发专项计划项目(1004TCYA039);兰州市高新技术产业化项目(2011-1-34)
李霞(1987—),女,硕士,研究方向为采后生物学。E-mail:lixia5625@126.com
*通信作者:李永才(1973—),男,副教授,博士,研究方向为果蔬的采后防腐鲜技术。E-mail:liyongcai@gsau.edu.cn
