液相色谱-质谱检测3种不同属新鲜黄芩中8种成分
2014-01-18黄湘鹭张庆生肖盛元IanColeSusanMurch
董 喆,黄湘鹭,曹 进,*,张庆生,肖盛元,Ian B. Cole,Susan J. Murch
(1.中国食品药品检定研究院食品化妆品检定所,北京 100050;2.北京理工大学生命科学院,北京 100081;3.卑诗大学奥根分校科学与艺术学院化学系,大不列颠哥伦比亚 基洛纳 V1V1V7)
液相色谱-质谱检测3种不同属新鲜黄芩中8种成分
董 喆1,黄湘鹭1,曹 进1,*,张庆生1,肖盛元2,Ian B. Cole3,Susan J. Murch3
(1.中国食品药品检定研究院食品化妆品检定所,北京 100050;2.北京理工大学生命科学院,北京 100081;3.卑诗大学奥根分校科学与艺术学院化学系,大不列颠哥伦比亚 基洛纳 V1V1V7)
目的:利用在线的方式,建立对3个属的新鲜黄芩样品中8种成分(褪黑素、5-羟色胺、吲哚-3-乙酸、金丝桃素、黄芩苷、黄芩素、汉黄芩苷、野黄芩苷)的液相色谱-质谱联用测定方法。方法:植物样品的匀浆与适量填料混合后,被填入相应的样品仓,通过杂质去除,目标物质富集洗脱等步骤,用于成分测定。结果:测定黄芩样品中8种成分,方法的检出限及定量限条件的回收率均大于90%,重复性及稳定性相对标准偏差不大于3.1%。结论:可以用于对黄芩原料中功效成分的评价。
液相色谱-质谱法;中国黄芩;北美黄芩;南美黄芩
近年来,随着人们生活质量的提高,对保健品的需求越来越大,黄芩因其特殊功效被制作成各类保健食品,比如养生茶、植物粉等。黄芩属是拥有大约300多个种的一类植物,因其形态常被叫做“小圆帽”,该属植物通常广泛生长在温带地区和热带山地。在中国,黄芩作为一种中药材,常以根入药,有清热燥湿、凉血安胎、解毒功效,已使用了几百年[1-3]。在北美,它用于治疗消化问题,还可作为一种神经镇定剂或者温和的镇静剂,用于辅助治疗焦虑、抑郁、失眠等。近几年研究发现,黄芩提取物还具有抗菌[4]、抗病毒[5]、抗肿瘤[6-7]、抗炎[8-9]、抗氧化[10-11]、免疫调节[8,12]等的作用,并可以作为辅助消化的保健食品用于日常消费[13]。现代研究表明,黄芩属植物中含有上百种成分,其主要的有效成分为黄芩苷[14]、黄芩素、汉黄芩素等黄酮类化合物[15-16],在对黄芩药材的评价,也是基于对有效成分的含量测定或者色谱指纹图谱的方式进行产地来源、质量优劣以及在不同配伍中的存在状态的评价[17-18]。但是,目前尚未见对中美不同产地来源的黄芩植物进行比较分析报道。以往的研究[19]只是利用了在线装置对粉末植物样品进行植物激素的测定,而没有进行新鲜植物样品(即含水植物组织)的处理研究。由于在新鲜植物组织进行干燥处理的过程中,常会引起物质的变化,因此,建立一种可以用于新鲜植物样品测定的在线制备方式,对植物组织样品进行测定,可为有效成分研究提供检测途径和方法。
本研究通过对3种不同属黄芩样品中国黄芩(Scutellaria baicalensis Georgi)、北美黄芩(Scutellaria laterif ora L.)以及南美黄芩(Scutellaria racemosa Pers.)的新鲜组织进行在线直接制备处理,运用液相色谱-质谱方法测定其中8种成分的含量。
1 材料与方法
1.1 材料与试剂
3种黄芩种子(中国黄芩、北美黄芩、南美黄芩)分别购自河北省安国市、加拿大Kelowna及美国佛罗里达橙县,经卑诗大学化学系Susan J. Murch教授鉴定。
褪黑素、5-羟色胺、吲哚-3-乙酸、金丝桃素对照品、甲酸(分析纯)、乙酸(分析纯) 美国Sigma公司;黄芩苷、黄芩素、汉黄芩苷、野黄芩苷 中国食品药品检定研究院;甲醇和乙腈(色谱纯) 加拿大VWR公司。
1.2 仪器与设备
Alliance液相色谱、Premier LCT串联质谱 加拿大Waters公司;Masslynx V4.0数据控制软件 英国Micromass公司。
1.3 方法
1.3.1 仪器条件
1.3.1.1 色谱条件
色谱柱:W a t e r s X t e r r a C18H P L C柱(100 mm×2.1 mm,3.5øm);流动相体系:0.45%甲酸(A)-乙腈(B);梯度程序:0~5 min、100% A,5~30 min、100%~0% A,30~45 min、100% B,45~46 min、100%~0% B,46~60 min、100% A;流速:0.25 mL/min;柱温:30 ℃;进样器温度:20 ℃;进样体积:10 øL。
1.3.1.2 质谱条件
质谱调谐参数的优化是利用每一种物质的标准溶液,质量浓度为0.001 mg/mL,直接注射进样调节。模式:多反应监测,正离子模式;毛细管电压:3.00 kV;锥孔电压:褪黑素13 V、5-羟色胺14 V、吲哚-3-乙酸10 V、金丝桃素11 V、黄芩苷17 V、黄芩素39 V、汉黄芩苷29 V及野黄芩苷20 V;提取电压:4.00 V;RF棱镜电压:0.0 V;离子源温度:150 ℃;干燥温度:400 ℃;锥孔气流速:100 L/h;干燥解吸气体流速:1 000 L/h;低分子质量分离度:14.5;高分子质量分离度:15.3;离子能量1:0.4 V;进口电压:25 V;碰撞电压:褪黑素15 V、5-羟色胺10 V、吲哚-3-乙酸15 V、金丝桃素14 V、黄芩苷30 V、黄芩素35 V、汉黄芩苷30 V及野黄芩苷35 V;出口电压:30 V;低分子质量分离度:15.0;高分子质量分离度:15.0;离子能量2:1.5 V;倍增器电压:650 V;池压力:6.92×10-4mbar。
1.3.2 样品制备
1.3.2.1 黄芩培育及样品采集
3种黄芩的种子经表面灭菌处理后,在水基培养基中发芽后移植于位于加拿大卑诗大学奥根湖区的温室中,具体培育参见文献[20]。3个月后,分别对种苗的根、茎、叶、花进行采集,分装于样品管中,直接用于测定或者存放于-20 ℃待测。
1.3.2.2 样品处理及制备
1.3.2.1 节获得的植物组织各分为4种模式进行处理:在室温条件下,剪碎样品通过氮气流进行干燥处理,研磨粉碎后,准确称量2.0 g样品于50 mL烧杯中,加入10 mL甲醇-0.45%甲酸(40∶60,V/V)混合溶液,超声提取45 min,重复1次,每次萃取液经4 500×g离心10 min,获取上清液,并以甲醇-0.45%甲酸(40∶60,V/V)溶液清洗残渣并入萃取液,最终上清液定容至30 mL,为待测组1;直接称取约3.0 g匀浆后新鲜组织样品,按照组1样品制备方式制备,为组2;另取样品按照以往研究[19],进行干燥后,粉末装填处理,为组3;取样品采用新鲜样品处理方法,装填后,进行处理,为组4。
1.3.2.3 新鲜样品的在线制备
在线装置的构建参考前期文献[6]报道,在用于新鲜植物组织样品测定时进行了部分改进和优化。其中样品仓的装填是采用均质化样品以一定比例加入反相C18填料后,装填入仓,利用筛板以高压泵压实,操作步骤见图1所示。研究[19]表明,样品可以在进行粉末化后,通过一定的惰性物质填充后,增加提取仓的反压,从而加快提取的速度。而对于新鲜样品,其不能如粉末样品般经过颗粒筛选后进行填充并形成一定的反压,因此新鲜植物组织样品在4 ℃匀浆后,吸取适量匀浆,加入一定比例填料(30 øm,C18填料)并混匀,此时的样品状态为半干燥,以夹心填充的方式置于样品仓中,操作过程中,采用堵头对样品仓出口进行堵塞,进口利用高压泵,以水为载体加压(1 000~1 500 psi)1~2 min,形成的空腔以填料填实后,装配好样品仓,放入流路进行样品在线处理。参见图1。
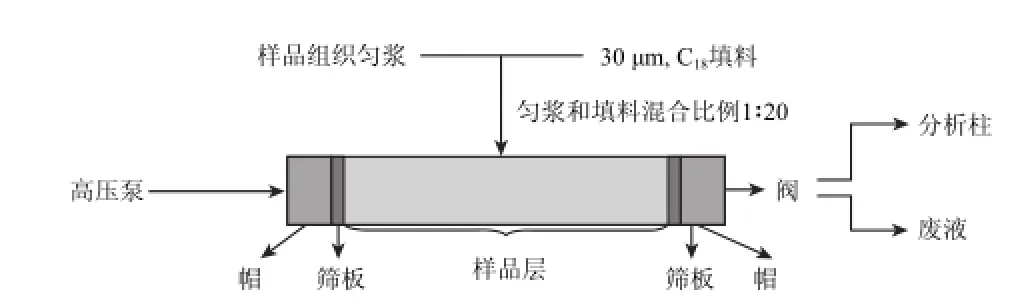
图1 新鲜植物样品在线处理结构示意图Fig.1 Schematic diagram of experimental set-up for on-line fresh botanical sample treatment
2 结果与分析
2.1 检测条件的优化
为了获取不同种质来源黄芩的质量差异,因此选择代表黄芩主要质量的4种活性成分,黄芩苷、黄芩素、汉黄芩苷及野黄芩苷作为比较的基础,另考虑其种质生长相关的4种植物神经递质,金丝桃素、褪黑素、5-羟色胺、吲哚-3-乙酸作为生长情况评价参考加入比较。方法采用标准溶液对各个物质的母离子及子离子谱进行了优化研究,按照三离子(准分子离子及两个碎片离子)原则对每种物质选取了两个子离子作为定性和定量识别的依据,多反应监测选择的离子对(括号内两对离子对,前者为定量离子对)分别为:褪黑素(m/z 233>174,m/z 233>216);5-羟色胺(m/z 177>160,m/z 177>115);吲哚-3-乙酸(m/z 176>130,m/z 176>103);金丝桃素(m/z 538>413,m/z 538>277);黄芩苷(m/z 447>271,m/z 447>168);黄芩素(m/z 271>123,m/z 271>169);野黄芩苷(m/z 463>287,m/z 463>175);汉黄芩苷(m/z 285>270,m/z 285>139),各离子对分别为对应流动相体系和碰撞状态下的最强的两对离子,样品中的目标物质确定方式为,与标准品保留时间相对标准偏差(relative standard deviation,RSD)在2%以内,其两对离子对相对丰度比在样品和标准品间RSD为10%以内。
2.2 8种成分的线性分析
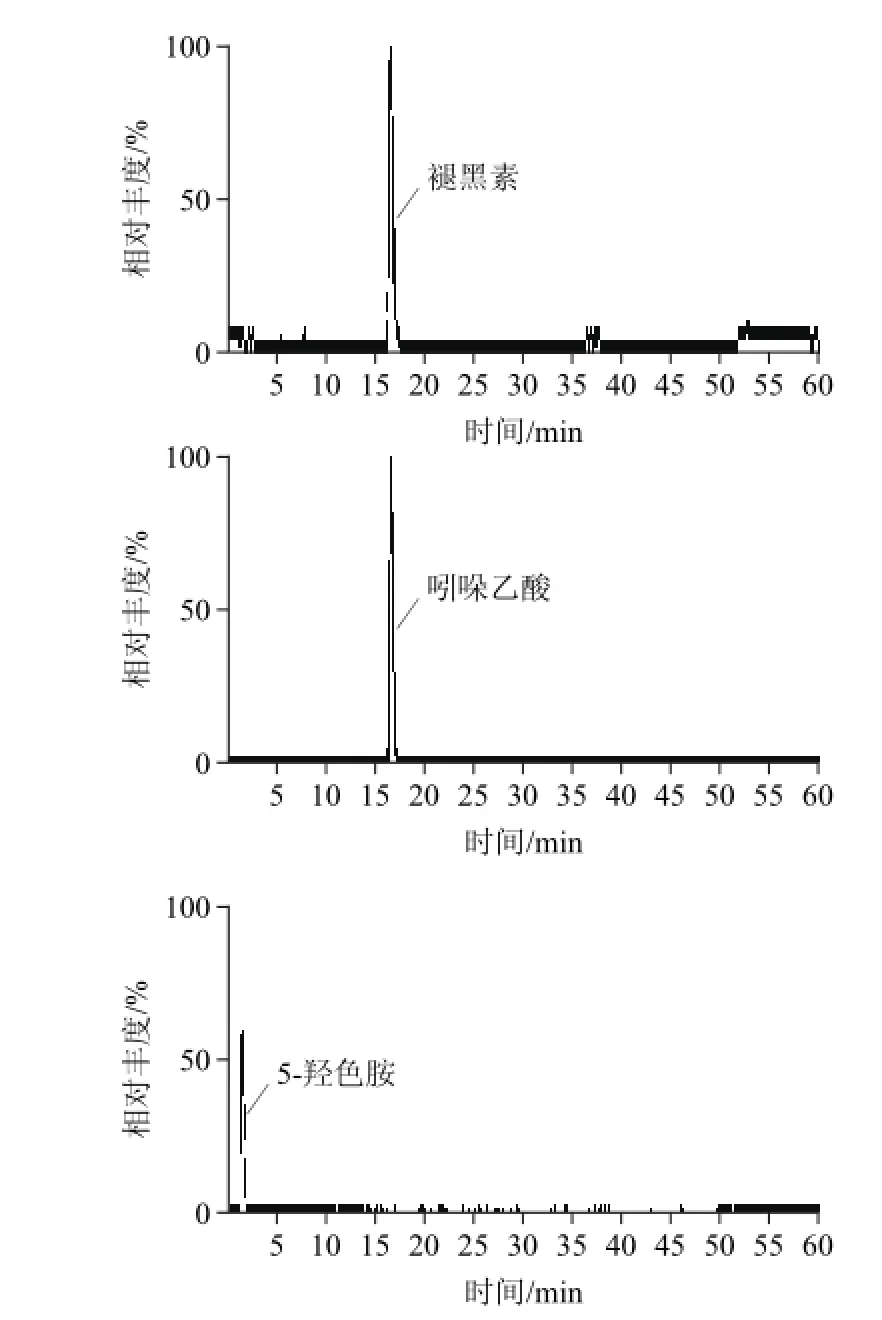
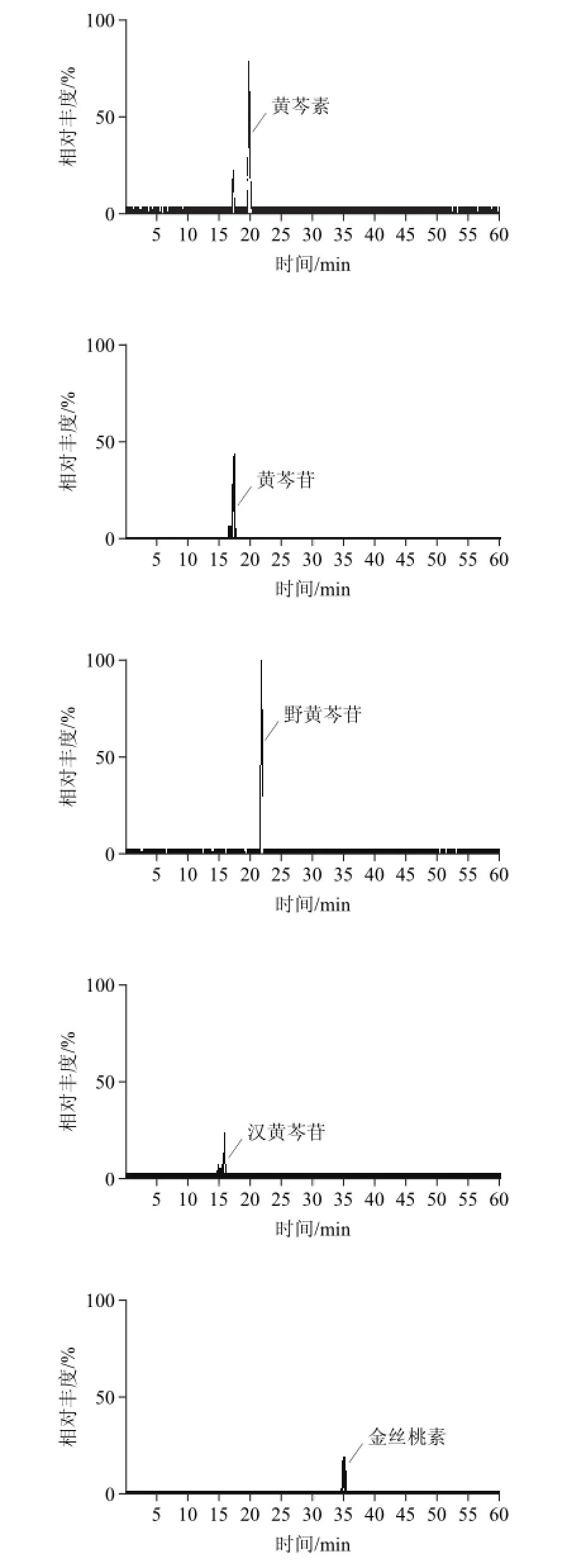
图2 8种目标物质的样品色谱图Fig.2 MRM chromatograms of 8 analytes in sample
中国黄芩根样品中8种成分色谱图见图2,每种物质建立了两条标准曲线,分别为高、低质量浓度线性关系结果见表1。
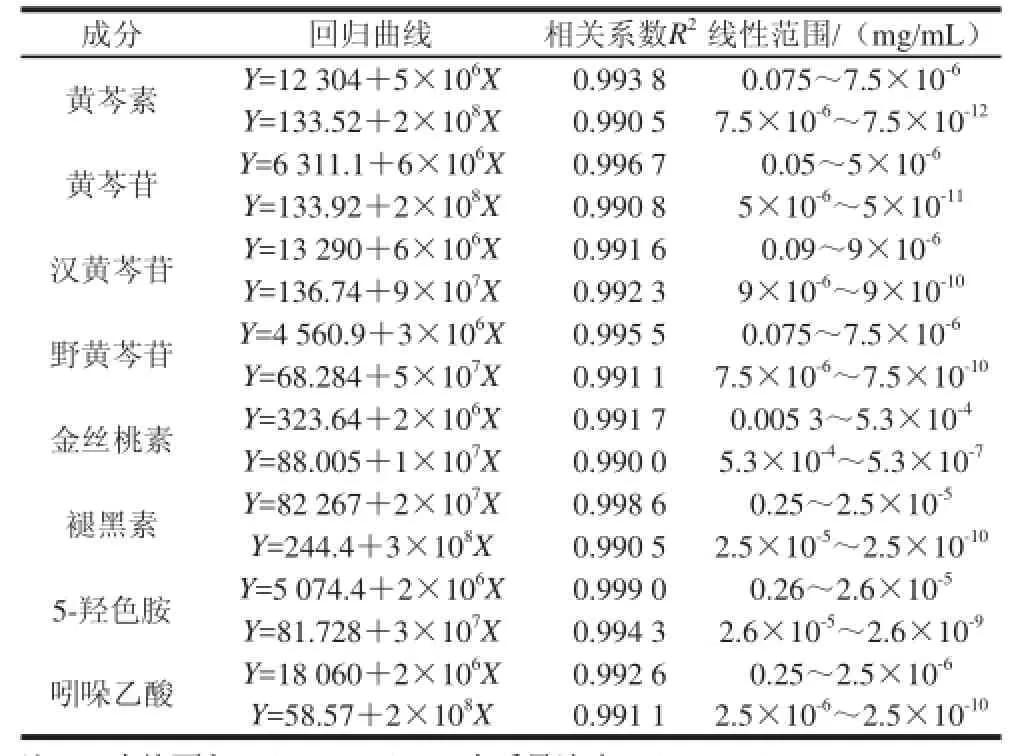
表1 8种目标物质的线性关系及范围Table 1 Linear relationships and ranges for 8 analytes
2.3 在线制备的优化
2.3.1 在线杂质洗脱过程
参考固相萃取的洗脱优化方式,同时兼顾8种成分的洗脱行为,其中黄芩苷、黄芩素、汉黄芩苷、野黄芩苷、褪黑素、吲哚-3-乙酸最佳洗脱液为60%甲醇溶液,而5-羟色胺为30%甲醇溶液,金丝桃素为70%甲醇。为同时测定8种成分,杂质去除分为两段进行,首先以100%水冲洗1 min,再以25%甲醇溶液冲洗2 min,再以30%甲醇溶液洗脱至富集柱上后,切入上样位,进行分离分析。上述最佳洗脱比例,是在该比例下,物质在2 min内可以完全洗脱至富集柱上,且不进一步洗脱流失,由于上述最佳洗脱比例差别较大,实验中进一步研究了富集柱保留行为,发现在30%甲醇洗脱下,最难洗脱物质金丝桃素可以在6 min完全洗脱下来,同时该时间5-羟色胺在富集柱上继续保留,而不因洗脱而流失,因此最终采用30%甲醇洗脱6 min,作为样品制备富集时间。
2.3.2 在线制备过程的优化
前期制备研究[19]是将样品干燥后粉末化,直接装填或者与惰性填料混合后装填,以增加样品仓的反压,从而提高了提取的效率。本实验针对新鲜样品,采用与填料混装的方式,形成了制备反压,主要优化了匀浆和填料的混合比例,比较了1∶10、1∶15、1∶20、1∶25、1∶30混合比例的提取效率。经过比较发现,由于含水量及含木质素多少的不同,装柱后加压状态下,形成的空腔比例存在较大的差异,因此需要补充填入填料。根据重复性比较结果得到最佳制备条件,其中根混合比例1∶15、加压1 000 psi,茎混合比例1∶15、加压1 200 psi,花和叶混合比例1∶25、加压1 500 psi,在固定了上述条件后,采用2.3.1节步骤进行操作。由于8种成分在不同组织样品中转移趋势一致,因此,以黄芩苷为例来说明方法效果,结果数值均已进行含水量的校正,见表2所示。
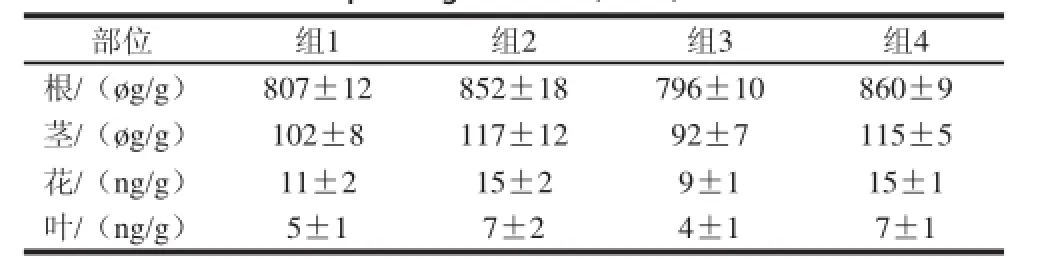
表2 4种处理方式各部分黄芩苷含量结果( =5)Table 2 Comparative baicalin content in different plant parts of Scutellaria extracted at different ratios of homogenated samples to packing material ( = 5)
由表2可以看出,干法(组1、3)和新鲜样品(组2、4)的测定结果存在明显的差异,这说明干法样品在组织干燥以及加入溶剂萃取的过程中待测成分有明显的减少,因此,在对植物组织中有效物质的检测中,检测新鲜样品可以更为有效地反映出物质成分存在的状况。另外,由于在高反压下提取,在线过程(组3、4)的分析周期明显要低于离线状态(组1、2),一般提取过程仅需要10 min,具体时间与杂质洗脱、填料的容量以及萃取柱的饱和程度等有关,而离线过程通常需要40~50 min左右。
2.3.3 质谱基质效应
在液相色谱-质谱检测中,离子化程度直接决定了信号的有效检出。基质效应的影响,虽然在通常液相色谱-质谱方法开发中得到了一定的考虑,但是往往很难适应较为宽泛的基质耐受范围。在离线状态,无论干燥样品或者新鲜样品进行制备,其主要基质还存在于萃取体系中,因此,在此状态下,即使得到后期液相分离,也不能消除共存基质的干扰。与此相比,在线过程由于存在前期溶剂清洗,大部分基质并不进入后期分离分析,因此基质效应会减少很多。比较结果显示,基质效应由高到低的情况大致为:组2>组1>>组3>组4。对于方法的检出限,提取系统条件下,实际可检测的数据,没有考虑本底的干扰和基质影响,见表3、4。由于较难获取含共存基质,而不含待测成分的本底,因此,以标准物质比较了离线和在线方法检测的检出限水平,可以获得相似的检出限数据和回收率数据(离线数据未列出)。
2.4 方法验证
2.4.1 8种成分的检出限及定量限
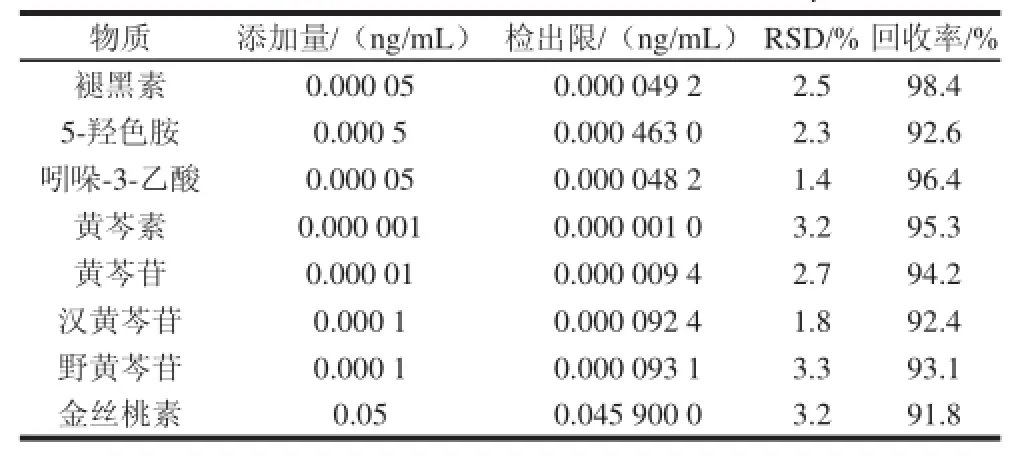
表3 8种物质的检出限及其回收率( =5)Table 3 Limits of detection and recoveries of 8 analytes ( = 5)
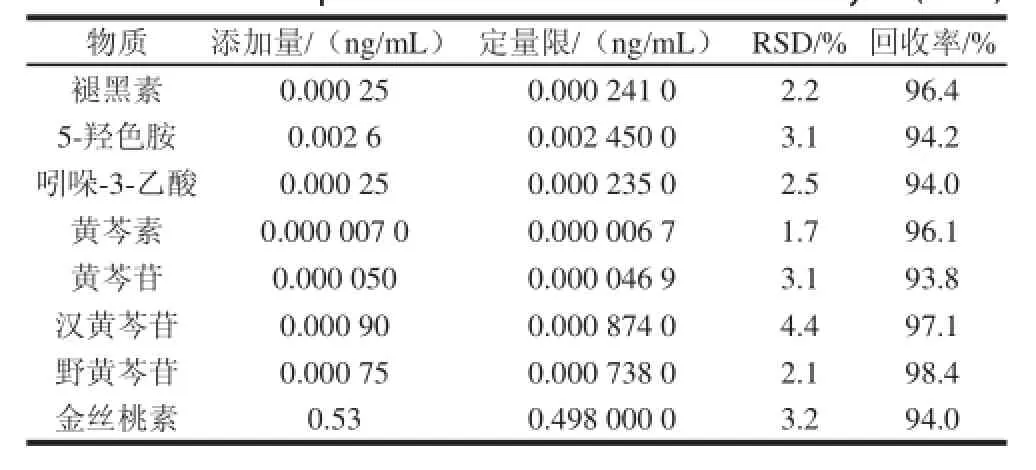
表4 8种物质的定量限及回收率( =5)Table 4 Limits of quantification and recoveries of 8 analytes ( = 5)
根据实际信号区分,方法的检出限和定量限分别选取的是2、5倍信噪比水平计算,结果见表3、4。
2.4.2 回收率及方法验证
方法在检出限及定量限附近的加标回收实验可以看出,检出限附近的精密度小于3.5%(n=5),回收率均在90%以上;定量限附近的精密度小于3.2%(n=5),回收率在93%以上,证明此方法可以用于黄芩属样品中8种物质的测定。将标准溶液滴加在惰性填料中,氮气流下吹干后装填入样品仓中,按照1.3.2.1节方法进行样品富集、测定。另外对在线样品制备进行加样回收实验,4组实验回收率均在90%以上,说明在线制备在测量的准确性上占有更好地优势。
2.4.3 重复性及稳定性
按照在线制备的方式,进行了样品制备,对8种物质的重复性及样品稳定性进行了测定,测定采用中国黄芩茎配制的样品,其中样品中成分含量为黄芩素10 μg/g、黄芩苷10 μg/g、汉黄芩苷7 μg/g、野黄芩苷6 μg/g、褪黑素1 μg/g,5-羟色胺和吲哚-3-乙酸人为添加,添加量为1 μg/g。稳定性实验用该样品分别在0、3、7、10、15、24、48 h进行测定,结果见表5。
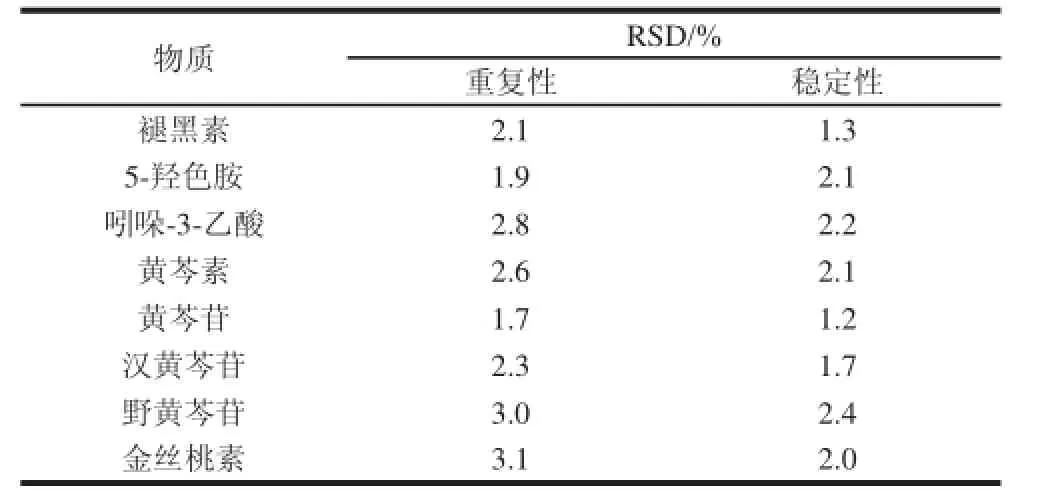
表5 8种物质的重复性及稳定性(n=5)Table 5 Repeatability and stability of the method ( n= 5)
2.5 样品测定
由表6可见,黄芩素、黄芩苷、汉黄芩苷、野黄芩苷4种物质,在3个来源的种子培育的根样品中均可以发现,在50批相同培育条件获得的样品中,以上4种物质的含量高低分别为中国黄芩>北美黄芩>南美黄芩,而在组织分布中,由高到低为根、茎、叶、花;金丝桃素作为一种植物神经传输相关的物质,仅在中国黄芩的花和叶中发现;3种神经递质褪黑素、5-羟色胺和吲哚-3-乙酸在3类黄芩属样品中均可以发现褪黑素,其中中国黄芩最高,南美黄芩次之,北美黄芩最低,而5-羟色胺和吲哚-3-乙酸则仅在部分样品中测到,其测定值较低,且不存在样品的相关性。
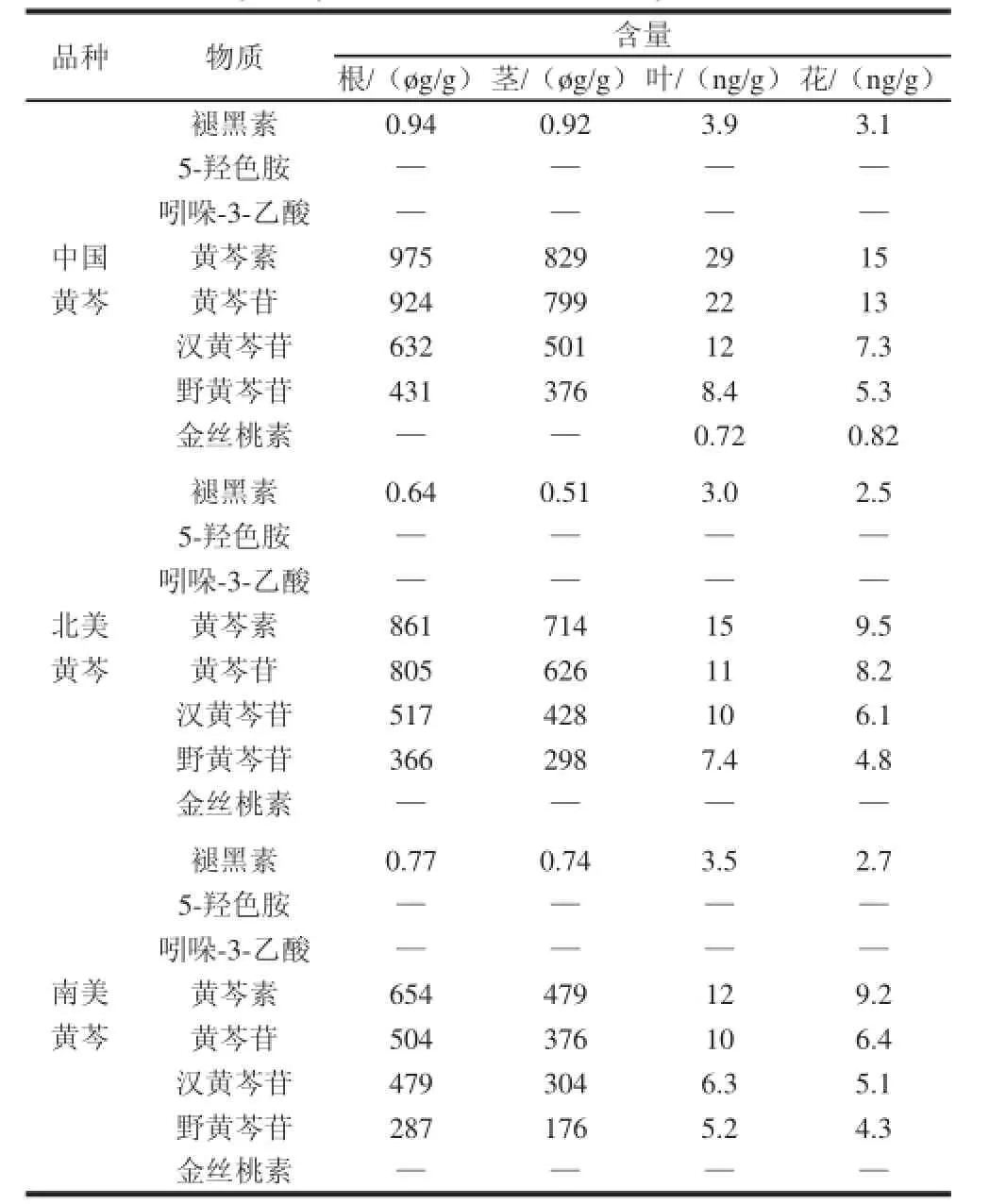
表6 3个种质来源样品检测结果Table 6 Contents of 8 active components in fresh samples of different plant parts of three Scutellaria species
3 结 论
通过对3个种质来源黄芩中8种成分的含量测定,可以获得来自不同地域来源的黄芩属植物的化学定性和定量信息,同期研究中也尝试了利用本方法对植物的不同部位,如茎、叶、花等上述物质的测定,观察与部分地域相关的植物化学属性,由于比较的是方法和处理过程,数据未列出。从现有的数据结果而言,新鲜组织样品的在线检测可以有效地反映出目标物质在分析对象中的真实含量水平。对于整体分析方法来说,尽可能减少样品处理过程对原有样品状态的改变,可以更为准确地获取待测物质的真实水平。
参考文献:
[1] YANG Zaichang, WANG Bochu, YANG Xiaosheng, et al. The synergistic activity of antibiotics combined with eight traditional Chinese medicines against two different strains of Staphylococcus aureus[J]. Colloids Surf B Biointerfaces, 2005, 41(2/3): 79-81.
[2] MA Shuangcheng, DU Jing, BUT P P H, et al. Antiviral Chinese medicinal herbs against respiratory syncytial virus[J]. Journal of Ethnopharmacology, 2002, 79(2): 205-211.
[3] HUANG Yu, TSANG S Y, YAO Xiaoqiang, et al. Biological properties of baicalein in cardiovascular system[J]. Current Drug Targets. Cardiovascular & Haematological Disorders, 2005, 5(2): 177-184.
[4] 吴静, 胡东, 王克霞. 黄芩和黄芩苷对幽门螺旋杆菌的体外抗菌活性研究[J]. 中药材, 2008, 31(5): 707-710.
[5] 吴莹, 金叶智, 吴珺, 等. 黄芩主要成分体外抗甲型流感病毒作用的研究[J]. 北京中医药大学学报, 2010(8): 541-545.
[6] 任学群, 李宜雄. 黄芩素抗肿瘤机制研究进展[J]. 河南大学学报: 医学版, 2010(3): 175-179.
[7] 杨莉, 尤启冬, 杨勇, 等. 汉黄芩素抗肿瘤作用的研究进展[J]. 中国药科大学学报, 2009, 40(6): 576-579.
[8] 崔晓燕, 张敏, 刘晓明. 黄芩含药血清对3种巨噬细胞的抗炎免疫活性[J]. 中国临床药理学杂志, 2011, 27(4): 287-290.
[9] 张汝学, 贾正平, 刘景龙, 等. 黄芩水提取物对急性肺损伤大鼠的保护作用及其与胆碱抗炎通路的相关性研究[J]. 中草药, 2012, 43(2): 316-320.
[10] 郭少英, 程发峰, 钟相根, 等. 黄芩苷的体外抗氧化研究[J]. 时珍国医国药, 2011, 22(1): 9-11.
[11] 程发峰, 宋文婷, 郭少英, 等. 黄芩苷对大鼠原代皮层神经元过氧化氢损伤的保护作用[J]. 中华中医药杂志, 2011, 26(5): 950-953.
[12] 杨凌, 崔晓燕, 张许. 黄芩提取物的抗炎免疫作用研究[J]. 中国药房, 2007, 18(24): 1856-1858.
[13] CHAN E, WONG C Y, WAN Chunwai, et al. Evaluation of antioxidant capacity of root of Scutellaria baicalensis Georgi, in comparison with roots of Polygonum multiflorum Thunb and Panax ginseng CA Meyer[J]. The American Journal of Chinese Medicine, 2010, 38(4): 815-827.
[14] WU Jinyi, TSAI K W, LI Yizhen, et al. Anti-bladder-tumor effect of baicalein from Scutellaria baicalensis Georgi and its application in vivo, evidence-based complementary and alternative medicine[J]. Evidence Based Complement Alternat Medicine, 2013,doi:10. 1155/2013/579751.
[15] KURODA M, IWABUCHI K, MINAKI Y. Chemical constituents of the aerial parts of Scutellaria laterif ora and their alpha-glucosidase inhibitory activities[J]. Natural Product Communication, 2012, 7(4): 471-474.
[16] ZHANG Zhizhen, LIAN Xiaoyuan, LI Shiyou, et al. Characterization of chemical ingredients and anticonvulsant activity of American skullcap (Scutellaria lateriflora)[J]. Phytomedicine, 2009, 16(5): 485-493.
[17] KIM E H, SHIM B, KANG S, et al. Anti-inflammatory effects of Scutellaria baicalensis extract via suppression of immune modulators and MAP kinase signaling molecules[J]. Journal of Ethnopharmacology, 2009, 126(2): 320-331.
[18] LIM B O. Effects of wogonin, wogonoside, and 3, 5, 7, 2’, 6’-pentahydroxyf avone on chemical mediator production in peritoneal exduate cells and immunoglobulin E of rat mesenteric lymph node lymphocytes[J]. Journal of Ethnopharmacology, 2003, 84(1): 23-29.
[19] 曹进, 苗兰, 刘建勋, 等. 液相色谱-质谱联用在线测定3种植物激素[J].分析化学, 2011, 39(3): 367-371.
[20] COLE I B, CAO Jin, ALAN A R, et al. Comparisons of Scutellaria baicalensis, Scutellaria laterif ora and Scutellaria racemosa: genome size, antioxidant potential and phytochemistry[J]. Planta Medica, 2008, 74(4): 474-481.
Determination of 8 Components in Fresh Samples of 3 Scutellaria Species Using On-Line Liquid Chromatography-Tandem Mass Spectrometry
DONG Zhe1, HUANG Xiang-lu1, CAO Jin1,*, ZHANG Qing-sheng1, XIAO Sheng-yuan2, Ian B. Cole3, Susan J. Murch3
(1. Institute of Food and Cosmetics Control, National Institutes of Food and Drug Control, Beijing 100050, China; 2. School of Life Science, Beijing Institutes of Technology, Beijing 100081, China; 3. Chemistry, I.K. Barber School of Arts and Sciences, University of British Columbia Okanagan, Kelowna V1V1V7, Canada)
Objective: An on-line liquid chromatography-tandem mass spectrometry method was developed to determine 8 components in fresh Scutellaria samples from three germplasm sources. Methods: Mixtures of homogenated tissue samples and appropriate amounts of packing material were packed in sample chamber. After removing matrix impurities and enriching the target analytes, 8 components in fresh Scutellaria samples were determined. Results: The recoveries were greater than 90% at the limits of detection and quantification. Meanwhile, the RSDs of repeatability and stability were less than 3.1%. Conclusion: The method developed can be used for the de termination of active components in Scutellaria samples.
liquid chromatography-mass spectrometry (LC-MS); Scutellaria baicalensis Georgi; Scutellaria laterif ora L.; Scutellaria racemosa Pers.
O657.63
A
1002-6630(2014)04-0131-06
10.7506/spkx1002-6630-201404027
2013-04-25
科技部国际合作课题(2011DFA31440);“十二五”国家科技支撑计划项目(2012BAK08B02)
董喆(1984—),男,助理研究员,硕士,研究方向为分析化学。E-mail:dongzh2009@163.com
*通信作者:曹进(1970—),男,副研究员,博士,研究方向为分析化学。E-mail:cao1208@gmail.com
