渥堆发酵过程中木糖添加量对普洱茶品质的影响
2014-01-18刘通讯
高 力,刘通讯*
(华南理工大学轻工与食品学院,广东 广州 510640)
渥堆发酵过程中木糖添加量对普洱茶品质的影响
高 力,刘通讯*
(华南理工大学轻工与食品学院,广东 广州 510640)
以实验室环境模拟普洱茶发酵过程,研究木糖添加量(0.2%~0.8%)对普洱茶渥堆发酵过程中微生物、多酚氧化酶酶活、理化性质和感官品质的影响。结果表明:与空白组相比,添加0.8%、0.6%木糖的渥堆平均温度相对较高;发酵前期的霉菌总数和多酚氧化酶活最大值与木糖添加量正相关;茶多酚、儿茶素指标变化速度加快,且与木糖添加量正相关;而木糖添加量对茶黄素变化呈显著负相关,相关系数为-0.492。与空白组24 d发酵周期相比,添加0.8%木糖组的发酵时间可以缩短到18~19 d,0.6%木糖组可以缩短到19~21 d,0.4%可缩短到21~23 d。添加木糖各组茶汤滋味比空白组更甘甜,香气更浓郁,优于空白组。
普洱茶;木糖;渥堆发酵
普洱茶是以云南特色大叶茶种制作的特殊茶类。其分为生茶、熟茶。普洱生茶是未经过发酵生产的晒青毛茶,而普洱熟茶是由普洱生茶经微生物作用后发酵过程获得,其色泽乌润或褐红,滋味醇厚回甘,并具有独特的陈香[1-2]。近年来普洱茶以其显著的降脂减肥、抗脂质过氧化、抗衰老、防癌等生理功能[3],受到越来越多消费者的认同和喜爱。然而传统的普洱茶(熟茶)加工工艺存在发酵周期长(50~60 d),品质不稳定(不同产地、不同季节有异)、茶叶损耗大(损耗率20%~30%)等诸多缺点[4],已经不能满足消费者对高品质普洱茶的需求。近年来虽有通过接种外源微生物[5-6],添加外源酶[7-8]改善微生物品质的研究,但是其操作复杂,成本较高。因此,本实验在实验室模拟渥堆发酵的条件下,通过添加外源物质,为普洱发酵过程中的优势菌种(霉菌、酵母)提供额外的外源碳源,改善微生物的生长环境,旨在缩短发酵周期,提高茶叶品质,为开发高品质普洱茶提供理论基础。
1 材料与方法
1.1 材料与试剂
渥堆原料:2012年,云南腾冲大叶六级晒青毛茶。
木糖(纯度>99%) 上海博奥生物科技有限公司。
1.2 仪器与设备
电子分析天平 上海精科电子有限公司;UV752N紫外-可见分光光度计 上海仪电分析仪器有限公司;富华420型三用水箱 金坛市富华仪器有限公司;型恒温恒湿培养箱 广东省医疗器械厂;手提式压力蒸汽灭菌锅 江阴滨江医疗设备有限公司;电热DHG90A恒温鼓风干燥箱 上海索普仪器有限公司;GL-21M高速冷冻离心机 长沙湘仪离心机仪器有限公司。
1.3 实验设计
取4 kg晒青毛茶,加水增湿使其水分含量为45%[9],在实验室环境下在50 cm×37 cm×31 cm塑料箱中加湿自然渥堆发酵。实验时间为2012年10—12月,室内温度在18~27 ℃。木糖溶解到加湿水中后加入毛茶中。比较添加占毛茶质量0.2%~0.8%的木糖对普洱茶的品质和发酵周期的影响。
取样:从加水渥堆开始,每6 d翻堆一次,每次翻堆前取堆表、堆芯处采取五点法取样[10],每次70 g,充分混匀后用于测定。分别用F0、F1、F2、F3、F4表示毛茶、一翻、二翻、三翻、四翻样。
1.4 茶样分析
1.4.1 渥堆温度测定
用100 ℃的酒精温度计记录每天中午12时的堆芯温度。
1.4.2 茶样理化、微生物、酶活检测方法
水分:采用GB/T8304—2002《茶 水分测定》;儿茶素总量:采用香荚兰素比色法;茶多酚:采用GB8313—1987《茶 茶多酚测定》;茶色素:采用紫外分光光度法;霉菌总数:采用GB4789.15—2010《食品微生物学检验 霉菌和酵母计数》;多酚氧化酶:采用邻苯二酚比色法[11]。
1.4.3 感官评价[12]
采用百分制评分,以市面上一级普洱茶作为对照样(100分),从色泽、汤色、香气、滋味、叶底五方面评分,各部分分别占15、20、20、35、10分,由专业评茶师进行密码感官审评打分,并根据品质特性给予相应的评语,评茶术语参照云南地方标准 DB53/T103—2006《普洱茶》。
1.5 数据分析
用Microsoft Excel 2010处理数据和做图。用SPSS17.0进行方差分析(实验数据取表层和芯层的平均值分析)。
2 结果与分析
2.1 木糖添加量对普洱茶渥堆发酵堆温变化的影响
发酵过程中,温度对普洱茶的风味及品质影响十分重要,一方面温度变化影响发酵过程中微生物的生长活性,胞外酶的分泌,进而影响茶叶品质[13-14]。另一方面,通过监测温度变化可以判别发酵终点,控制发酵周期。由图1可知,从加水渥堆开始,堆温逐渐升高,到二翻前,各个样的温度都在30~50 ℃间,除添加了0.2%木糖组的渥堆堆温与空白组差别不大,其他质量分数的平均堆温明显高于空白组,且堆温随木糖添加量的增加而升高。说明外源木糖给渥堆过程的微生物提供了充足的营养,使得微生物大量繁殖代谢产生热量。二翻过后,堆温逐渐降低,到三翻结束,堆温趋于室温,微生物作用的发酵过程也逐渐缓慢。

图1 不同木糖添加量下普洱渥堆发酵堆温的变化Fig.1 Changes in pile temperature during fermentation of Pu-erh tea with different levels of xylose addition
2.2 木糖添加量对渥堆发酵过程霉菌变化的影响
表1 不同木糖添加量下渥堆发酵过程中霉菌变化Table 1 Changes in mould count in Pu-erh tea during fermentation with different levels of xylose additionCFU/g

表1 不同木糖添加量下渥堆发酵过程中霉菌变化Table 1 Changes in mould count in Pu-erh tea during fermentation with different levels of xylose additionCFU/g
注:同列小写字母不同表示差异显著(P<0.05)。
茶样 F0 F1 F2 F3 F4空白组 (1.4±0.1)×102b(7.5±0.6)×108a(3.3±0.6)×107a(3.9±0.5)×106a(8.8±0.7)×105a0.2%木糖组 (1.4±0.1)×102b(1.1±0.4)×109a(8.4±0.3)×107b(2.3±0.6)×107b(1.5±0.4)×106b0.4%木糖组 (1.4±0.1)×102b(2.3±0.2)×109a(1.4±0.2)×108b(3.3±0.3)×106b(4.6±0.4)×106b0.6%木糖组 (1.4±0.1)×102b(3.1±0.6)×109a(2.0±0.2)×108b(3.8±0.5)×106b(3.5±0.2)×106b0.8%木糖组 (1.4±0.1)×102b(3.8±0.3)×109a(4.7±0. 5)×108b(4.0±0.3)×105b(3.0±0.3)×105b
霉菌是普洱品质形成的优势微生物,对普洱茶品质风味形成起着很大的作用[15-17]。故检测渥堆过程中霉菌的含量有利于探索普洱品质的形成机理。由表1可知,原料加湿后,霉菌迅速繁殖,一翻时达到最大值,木糖添加量越高霉菌繁殖越旺盛,添加0.8%木糖组的霉菌最多,有3.8×109CFU/g,空白组霉菌最少,为7.5×108CFU/g。二翻到三翻霉菌下降迅速,其中添加0.8%木糖组的霉菌数量下降最为迅速,可能是前期发酵速率较快,使其迅速达到发酵终点。霉菌的变化与堆温的变化趋势保持一致,说明微生物的繁殖活性影响堆温。
2.3 木糖添加量对渥堆发酵过程多酚氧化酶变化的影响
多酚氧化酶是一类作用于茶叶中多酚类物质的氧化酶。由图2可知,原料的多酚氧化酶活非常低,只有0.026 U/(g·min),一翻时,添加0.8%木糖样的酶活迅速达到最大值,为1.42 U/(g·min)。空白组、0.2%、0.4%、0.6%木糖组酶活均在二翻时达到最大,分别为0.450、0.567、0.672、0.735 U/(g·min)。说明多酚氧化酶是一种由微生物分泌的外源酶。三翻后酶活迅速下降,四翻时,所有样酶活均低于0.1 U/(g·min)。添加木糖组的最大酶活均高于空白组的最大酶活力,且添加木糖添加量越高,最大酶活力越高。这表明酶活与发酵过程中微生物的消长有关,也与微生物的繁殖多少有关。

图2 不同木糖添加量下渥堆发酵过程表层样多酚氧化酶活力Fig.2 Changes in pholyphenol oxidase activity in the top layer of Puerh tea during fermentation with different levels of xylose addition
2.4 木糖添加量对渥堆发酵茶多酚和儿茶素变化的影响

图3 不同木糖添加量下渥堆发酵过程茶多酚含量变化Fig.3 Changes in polyphenol contents in Pu-erh tea during fermentation with different levels of xylose addition
茶多酚是形成普洱茶品质的重要活性物质,在茶汤中呈苦涩味,有较强的刺激性,与普洱茶品质相关系数为0.875[18]。测定普洱茶中茶多酚的变化对研究普洱品质形成具有重要作用。由图3可知,茶多酚随发酵时间的增加而逐渐减少,一翻二翻下降迅速,从原料到四翻结束,空白样和0.2%、0.4%、0.6%、0.8%木糖组茶多酚减少量分别为68.7%、68.2%、73.4%、77.6%、91.4%。表明添加木糖能加快普洱的渥堆发酵进程,使得普洱中茶多酚减速加快,且茶多酚的减少量与木糖添加量呈正相关。
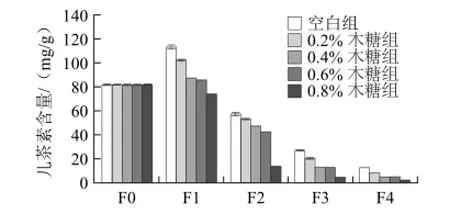
图4 不同木糖添加量下渥堆发酵过程儿茶素含量变化Fig.4 Changes in catechin content in Pu-erh tea during fermentation with different levels of xylose addition
儿茶素是普洱茶中的主要多酚物质,由图4可知,空白组、0.2%、0.4%、0.6%木糖组的表层样的总儿茶素含量在一翻时高于原料样。可能原料在加湿添糖后,茶叶中的糖类经过一系列酶作用形成了部分儿茶素。一翻后所有样儿茶素含量均随着翻堆次数增加而逐渐降低,与茶多酚的变化趋势保持一致。其中添加0.8%木糖组在二翻时儿茶素含量下降到了原料样的16.5%,说明前期发酵速率很快。四翻时空白组、0.2%、0.4%、0.6%、0.8%木糖组儿茶素所剩量分别为原料的84.7%、89.7%、94.3%、94.2%、97.1%。再次表明木糖加快了普洱发酵速率,使得儿茶素含量加快降低,且与添加木糖添加量正相关。
2.5 木糖添加量对渥堆发酵过程茶色素变化的影响

图5 不同木糖添加量下渥堆发酵过程茶黄素含量变化Fig.5 Changes in theaflavin content in Pu-erh tea during fermentation with different levels of xylose addition
茶黄素、茶红素、茶褐素是普洱茶主要色素物质,茶黄素、茶红素和茶褐素分别是茶汤亮色、红色、褐色的主要成分[19],所以,茶色素是评价普洱茶汤色泽的重要物质。由图5可知,空白组,添加0.2%、0.4%、0.6%木糖组的茶黄素从原料到一翻先增大,一翻后逐渐降低,添加0.8%木糖组下降最明显下降了。茶红素从原料的1.45%逐渐下降,由于其是茶黄素氧化的中间产物,在发酵中后期,茶红素不生成。
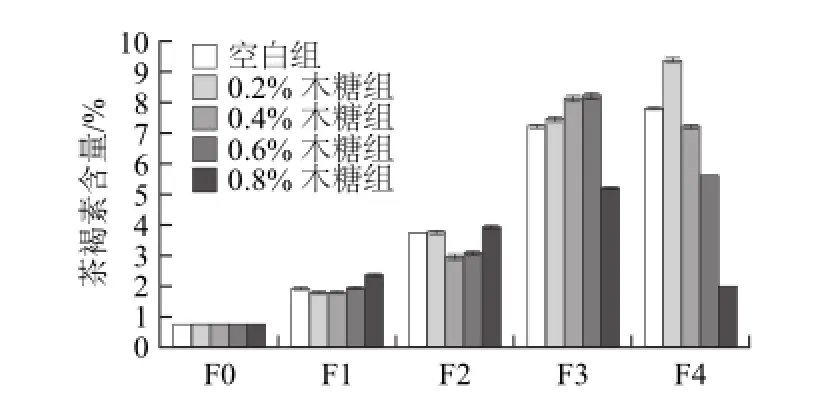
图6 不同木糖添加量下渥堆发酵过程茶褐素含量变化Fig.6 Changes in theabrownin content in Pu-erh tea during fermentation with different levels of xylose addition
由图6可知,空白样、添加0.2%木糖样的茶褐素随着翻堆次数的增加而增加,而0.4%木糖组、0.6%木糖组、0.8%木糖组的茶褐素在三翻时达到最大,到四翻时有下降,0.8%木糖组下降最多,0.6%木糖组下降次之,0.4%木糖组下降较少。说明添加了木糖后,加快发酵速率,添加较高质量分数的木糖使得茶汤能在三翻时就形成褐红明亮、滋味浓醇甘爽的品质,而继续发酵使得茶褐素进一步氧化减少,导致茶汤色泽又向透亮方向转变。所以由茶褐素的改变可以看出,对于添加有高质量分数外源碳源的样品在三翻即18 d后陆续终止其发酵进程。
2.6 相关性分析
对添加木糖后的普洱渥堆发酵过程相应指标的关系,有助于进一步探索其化学成分变化机理。因此,对各项指标和木糖添加量之间进行相关性和显著性分析,结果见表2。霉菌和多酚氧化酶、茶多酚和儿茶素两组之间呈极显著正相关(P<0.01),相关系数分别为0.547、0.845,说明多酚氧化酶活与霉菌变化一致,受霉菌繁殖状况的影响。茶黄素、茶红素与儿茶素呈极显著正相关,相关系数分别为0.636、0.807,茶褐素与茶多酚儿茶素极显著负相关,相关系数分别为-0.721、-0.801,这也与田洋等[20]的研究结果一致。木糖添加量与茶黄素变化呈显著负相关(P<0.05),与茶多酚、儿茶素、茶红素、茶褐素呈负相关,说明添加木糖添加量越高,茶多酚、儿茶素、茶红素、茶褐素下降越快,而木糖添加量与多酚氧化酶和霉菌呈正相关,说明添加木糖添加量越高,霉菌和多酚氧化酶活有相应的提高。多酚氧化酶与茶多酚、茶黄素、茶红素、茶褐素都呈现负相关性,说明多酚氧化酶作为一种氧化酶类,促进这些酚类物质的氧化。在有较高多酚氧化酶活性的发酵样中这些多酚类物质被氧化的更迅速,明显提高发酵速度,缩短发酵周期。

表2 各项指标相关系数和显著性分析Table 2 Correlation coefficients of microbial and biochemical indexes and significant test results
2.7 感官评定和最佳发酵周期探讨
由表3可知,各样品在发酵24 d后,除0.8%木糖组,其他各组在汤色、香气、滋味上都略优于空白组。添加0.8%木糖组,茶汤色泽又向浅黄透亮发展,且叶底也发硬,表明茶叶发酵过头,品质变差。添加0.4%木糖组和0.2%木糖组发酵24 d后颜色最佳,0.4%木糖组澄清度要优于0.2%木糖组,0.2%木糖组要略优于空白组,添加木糖的各组茶汤与空白组相比有微弱的甜味,使得普洱茶浓醇有回甘,口感更佳。由于综合评分为0.4%木糖组最佳,其次是0.2%木糖组和0.6%木糖组,0.8%木糖组因发酵过头,感官品质最差。正因为普洱的品质的形成与微生物的繁殖相关,添加木糖为微生物带来的良好生长环境也优化了普洱品质的形成,口感更佳。

表3 不同木糖添加量下茶样感官评定分析Table 3 Sensory assessment of Pu-erh tea fermented with different levels of xylose addition
通过对各不同样品堆温、理化指标、感官品质的检测,在本研究设定的发酵环境下,0.8%木糖组的最佳发酵周期为18~19 d,0.6%木糖组的最佳发酵周期为20~21 d,0.4%木糖组的最佳发酵周期为22~23 d,0.2%木糖组和空白组的最佳发酵时间为24~26 d。超过这个时间容易导致普洱发酵过头,品质下降。另外,木糖作为一种成本较低、易获取的外源碳源物质对改善普洱品质效是可行性的。
3 结 论
木糖作为低成本、易获取的外源碳源添加到普洱原料中为发酵过程中的微生物提供了额外营养物质,使得渥堆温度高于空白组,其中添加0.8%、0.6%木糖组的平均温度明显高于空白组。良好的渥堆温度为微生物的生长提供更合适的环境,微生物繁殖更加旺盛,霉菌数量、多酚氧化酶酶活与添加的木糖添加量整体成正相关,且霉菌数和多酚氧化酶间存在极显著相关性(P<0.01),相关系数为0.547。
添加木糖后,渥堆发酵速度提高,茶多酚、儿茶素、茶叶褐素指标变化速度加快。茶黄素、茶红素与儿茶素呈极显著正相关,相关系数分别为0.636、0.807,茶褐素与茶多酚、儿茶素极显著负相关,相关系数分别为-0.721、-0.801。木糖添加量与茶黄素变化还呈显著负相关性(P<0.05)。
添加木糖后,普洱茶增加了甘甜味,其渥堆发酵周期缩短,其中添加0.8%木糖组的发酵时间可以缩短到18~19 d,0.6%木糖组可以缩短到19~21 d,0.4%木糖组可以缩短到21~23 d。添加木糖各组茶汤滋味比空白组更甘甜,香气更浓郁,优于空白组。木糖作为一种易获取,成本低的外源碳源物质对促进普洱发酵、优化普洱品质具有积极意义。
参考文献:
[1] 刘勤晋. 中国普洱茶之科学读本[M]. 昆明: 云南科技出版社, 2005.
[2] 杨崇仁, 陈可可, 张颖君. 茶叶的分类与普洱茶的定义[J]. 茶叶科学技术, 2006, 46(2): 37-38.
[3] 邓时海. 普洱茶做为人体健康食疗的探讨(四)[J]. 云南茶叶, 1996(1): 19-21.
[4] 梁名志. 人工接种真菌发酵普洱茶的化学成分变化研究[J]. 中国茶叶, 2009(1): 11-13.
[5] 彭翠珍, 刘川, 李晚谊. 云南普洱茶人工接种发酵研究[J]. 云南大学学报: 自然科学版, 2008, 30(增刊1): 351-355.
[6] CHEN C S, CHAN H C, CHANG Y N, et al. Effects of bacterial strains on sensory quality of Pu-erh tea in an improved pile-fermentation process[J]. Journal of Sensory Studies, 2009, 24(4): 534-553.
[7] 李中皓, 刘通讯. 外源酶对成品普洱茶品质的影响研究[J]. 食品工业科技, 2008, 23(2): 152-154.
[8] 隋华嵩, 杨旭, 周红杰, 等. 普洱茶发酵过程中不同外源添加物对氧化酶活性与成分变化的影响[J]. 食品与生物技术学报, 2010, 29(5): 648-651.
[9] 胡捷, 刘通讯. 不同潮水量下普洱茶渥堆过程中微生物及酶活变化研究[J]. 食品工业科技, 2012, 33(17): 93-97.
[10] 冯超浩, 刘通讯. 不同潮水量条件下普洱茶渥堆过程化学成分的变化[J]. 食品科学, 2013, 34(7): 135-139.
[11] 张灵枝, 程楚镇, 李烨普. 洱茶渥堆过程主要酶系活性变化研究[J].食品科学, 2010, 31(11): 1-4.
[12] LIANG Yuerong, LU Jianliang, ZHANG Lingyun, et al. Estimation of black tea quality by analysis of chemical composition and colour difference of tea infusions[J]. Food Chemistry, 2003, 80(2): 283-290.
[13] 王汉生. 关于普洱茶的人工渥堆发酵工序[J]. 广东茶叶, 2005(4): 3-4.
[14] 白文祥. 云南普洱茶渥堆发酵过程关键控制因素分析[J]. 中国茶业, 2009, 31(2): 20-21.
[15] 赵龙飞. 云南普程中的主要微生物初探[J]. 商丘师范学院学报, 2005, 21(2): 129-133.
[16] ABE M, TAKAOKA N, IDEMOTO Y, et al. Characteristic fungi observed in the fermentation process for Puer tea[J]. International Journal of Food Microbiology, 2008, 124: 199-203.
[17] 董坤, 熊辛宇, 蓝增全. 普洱茶发酵过程中微生物类群分析[J]. 现代农业科技, 2009(1): 164-165.
[18] 梁名志, 孙荣琴. 普洱茶品质化学研究进展[C]//云南省首届普洱茶国际研讨会论文集. 昆明: 云南科技出版社, 2004: 121-128.
[19] 周红杰. 云南普洱茶[M]. 昆明: 云南科技出版社, 2004: 49.
[20] 田洋, 肖蓉, 徐昆龙, 等. 普洱茶加工过程中主要成分变化及相关性研究[J]. 食品科学, 2010, 31(11): 20-24.
Effects of Addition of Different Contents of Xylose on the Quality of Pu-erh Tea during Pile Fermentation
GAO Li, LIU Tong-xun*
(College of Light Industry and Food Science, South China University of Technology, Guangzhou 510640, China)
The effect of different levels of xylose addition (0.2%–0.8%) on microbes, polyphenol oxidase activity, physical and chemical properties and organoleptic quality of Pu-erh tea during the pile-fermentation process was investigated in a simulated laboratory environment. The results showed that the average pile-fermentation temperature was significantly higher upon xylose addition at 0.8% and 0.6% compared with the control. Mould quantity at the early stage of fermentation and the maximum polyphenol oxidase activity were positively correlated with xylose concentration. The changes of polyphenols and catechins were also accelerated when compared with that of the control and positively correlated with xylose concentration. However, theaflavin was significantly negatively correlated with xylose concentration with a correlation coefficient of-0.492. By adding 0.8%, 0.6% and 0.4% xylose the fermentation time could be shortened to 18–19 d, 19–21 d and 21–23 d, respectively, compared with 24 d for the control. The tea fermented with the addition of xylose was much sweeter and had a stronger aroma than the control.
Pu-erh tea; xylose; pile fermentation
TS272.4
A
1002-6630(2014)03-0168-05
10.7506/spkx1002-6630-201403034
2013-03-01
高力(1990—),女,硕士研究生,研究方向为粮食、油脂及植物蛋白工程。E-mail:gaogaohao_2008@163.com
*通信作者:刘通讯(1965—),男,副教授,博士,研究方向为粮食、油脂及植物蛋白工程。E-mail:txliu@scut.edu.cn
