微波处理对葡萄糖异构酶性质的影响
2014-01-18胡国洲张甫生陈光静武菁菁阚建全
胡国洲,张甫生,胡 鹏,陈光静,武菁菁,阚建全*
(西南大学食品科学学院,重庆市农产品加工及贮藏重点实验室,农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆 400715)
微波处理对葡萄糖异构酶性质的影响
胡国洲,张甫生,胡 鹏,陈光静,武菁菁,阚建全*
(西南大学食品科学学院,重庆市农产品加工及贮藏重点实验室,农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆 400715)
研究微波处理对葡萄糖异构酶酶活性、稳定性、动力学参数及构象的影响。结果表明:不同微波处理时间和微波处理功率对葡萄糖异构酶的活力都有着不同的影响。在7 0 ℃处理5 min条件下,当微波功率为30 0、400 W时,葡萄糖异构酶的相对酶活力分别增加14.23%、8.42%;而当微波功率为600、800 W时,葡萄糖异构酶的相对酶活力分别降低到95.69%、90.78%;微波处理也对葡萄糖异构酶的最适反应温度和动力学参数Km和Vmax有影响,但对其最适pH值几乎没有影响。紫外和荧光光谱研究表明微波处理将导致葡萄糖异构酶部分去折叠,分子中赖氨酸和色氨酸残基所处的微环境发生变化,葡萄糖异构酶的三级结构因此可能发生了改变,即微波处理可能通过改变葡萄糖异构酶的构象从而改变酶的性质。
葡萄糖异构酶;微波处理;酶活性;最适反应温度;最适pH值;构象
葡萄糖异构酶(D-glucose isomerase,GI,EC 5.3.1.5)又称D-木糖异构酶,能够催化D-葡萄糖,D-木糖分别转化成D-果糖和D-木酮糖,已成为食品工业中一种极为重要的酶[1-2]。在高果葡糖浆(high fructose corn syrup,HFCS)的工业化生产中,葡萄糖异构酶催化葡萄糖转化成果糖,已发展成为一种最成功的商业化酶生产应用实例[3-4]。目前,HFCS作为甜味剂已逐步取代了蔗糖的地位。在同等甜度条件下,HFCS比蔗糖便宜10%~20%,而且人体对果糖的再吸收率低,HF CS产生的热量也较少[5]。葡萄糖和果 糖的溶解度都比蔗糖高,因此在食品应用中因结晶作用而产生问题较少。HFCS已经广泛应用于果浆、果冻、冰淇淋、罐装食品、焙烤食 品、腌制食品、调味酱、粉状食品等食品中[6]。随着HFCS在各种饮料中应用与日俱增,许多研究者开始关注以HFCS为甜味剂的饮料消费与肥胖、糖尿病等慢性病的关系[7-8]。葡萄糖异构酶还在以半纤维素工业化生产乙醇应用中引起重视[9]。葡萄糖异构酶在催化葡萄糖转化成果糖时需要在较高的温度下进行,这将导致其较快地失活,影响使用寿命和降低经济效益。因此,葡萄糖异 构酶的酶活力如何方便快捷再生的问题迫切需要解决,但至今还没有有效的解决方法。
微波辐射是一种清洁、快捷的能量源,已广泛用于食品工业中。微波辐射可以直接地穿透物质,使物料中的极性分子振动,将电磁场能转化成热能[10],产生热效应。研究显示微波的非热效应可以使S-腺苷高半胱氨酸水解酶[11]、蛋白酶[12]、胰蛋白酶[13]等分子发生生理、生化和功能上的变化,微波处理能够增强脂肪酶的活性和稳定性[14]。鉴于此,微波处理能否成为葡萄糖异构酶的酶活力方便快捷再生的有效方法,值得期待和探讨,但有关微波辐射对葡萄糖异构酶的性质和构象的研究还未见报道。因此,本实验以葡萄糖异构酶为研究对象,研究微波处理对其活性、稳定性、酶动力学参数及构象的影响,旨在为寻求一种葡萄糖异构酶活力方便快捷再生的方法提供实验数据。
1 材料与方法
1.1 材料与试剂
葡萄糖异构酶(≥10万U/g) 武汉银河化工有限公司。
咔唑、半胱氨酸盐酸盐、葡萄糖、磷酸氢二钠、磷酸二氢钠、硫酸镁、高氯酸(均为分析纯) 成都科龙试 剂有限公司。
1.2 仪器与设备
M A S-Ⅱ型微波快速制样系统(工作功率0~1 000 W,工作温度25~250 ℃) 上海新仪公司;F-2500型荧光分光光度计、V-2450型紫外分光光度计日本岛津公司;B-10精密pH计 赛多利斯科学仪器(北京)有限公司;FA2004型电子天平 上海精科仪器有限公司;DK-8D型三孔电热恒温水槽 上海齐欣科学仪器有限公司。
1.3 方法
1.3.1 葡萄糖异构酶样品溶液的制备
称取500 mg葡萄糖异构酶,将其溶解于pH 7.0的磷酸缓冲液250 mL容量瓶中,制成2 mg/mL溶液,4 ℃保存。分别量取30 mL葡萄糖异构酶溶液,使用微波制样系统在200、300、400、600、800 W,控温70 ℃处理5 min,处理后的酶液置于4 ℃,3 h后检测其活性,分析不同微波处理功率对葡萄糖异构酶活性的影响。再分别量取30 mL葡萄糖异构酶溶液,使用微波制样系统在300 W,控温70 ℃,分别处理0、2、3、5、10、20、30 min,处理后的酶液置于4 ℃,3 h后检测其活性,分析不同微波处理时间对葡萄糖异构酶活性的影响。
1.3.2 葡萄糖异构酶酶活力测定
采用Dische等[15]半胱氨酸-咔唑法。反应体系为:2 mol/L葡萄糖溶液2.0 mL,0.2 mol/L pH 7.0磷酸盐缓冲液2.5 mL,0.02 mol/L MgSO4500 øL,0.01 mol/L CoCl2200 øL,500 øL待测酶液。反应混合液置于70 ℃水浴中,反应30 min后,迅速加入5 mL 0.5 mol/L高氯酸终止反应。取200 øL反应液适度稀释后,用半胱氨酸-咔唑法反应,在560 nm波长检测吸光度,根据果糖标准曲线得到反应混合液中的果糖含量。酶活力单位的定义:在该反应条件下,1 min内转化生成1 ømol果糖所需的酶量定义为1个酶活力单位,1 U。
1.3.3 不同微波功率对葡萄糖异构酶活力的影响
固定处理温度70 ℃和处理时间5 min,检测微波处理功率为0、200、300、400、600、800 W时的葡萄糖异构酶的活性,以未经过微波处理的酶活力为100%,参照1.3.2节酶活力检测方法计算各相对酶活力,分析不同功率对葡萄糖异构酶活力的影响。重复实验3次,求平均值。
1.3.4 微波处理对葡萄糖异构酶的最适温度与温度稳定性的影响[16]
经0、300、400、800 W微波处理后的葡萄糖异构酶溶液(10 mL、2 mg/mL)分别置于30~90 ℃的水浴锅中保温5 min,再参照1.3.2节检测酶活力,以最高酶活力为100%,分别计算相对酶活力,分析不同微波处理后葡萄糖异构酶的最适反应温度。
经0、300、400、800 W微波处理后的葡萄糖异构酶(10 mL、2 mg/mL)分别置于40、75、90 ℃各水浴保温1 h后,测定其酶活力,以其中最高酶活力为100%计算相对酶活力,分析不同微波处理后葡萄糖异构酶的温度稳定性。
1.3.5 微波处理对葡萄糖异构酶的最适pH值与pH值稳定性的影响
配制不同pH值(醋酸盐缓冲液pH 4.0~5.0;柠檬酸盐缓冲液pH 6.0;磷酸缓冲液pH 7.0~8.0;硼酸缓冲液pH 9.0~10.0)0.2 mol/L的缓冲液,将经过0、300、400、800 W微波处理后的葡萄糖异构酶,在不同pH值的混合液中测定酶活力,以最高酶活力为100%计算相对酶活力。
用pH值为4.0、7.5、9.0的缓冲液配制质量浓度为2 mg/mL的葡萄糖异构酶酶液,经过0、300、400、800 W的微波处理后,在30 ℃保温1 h后,参照1.3.2节测定酶活力,以最高酶活力为100%计算相对酶活力,分析不同微波处理后葡萄糖异构酶的pH值稳定性。
1.3.6 微波处理对葡萄糖异构酶的Km值与Vmax的影响
取2 mg/mL的葡萄糖异构酶经过0、300、400、800 W微波处理后的,检测一系列葡萄糖浓度(100、300、500、800、1 000、1 500 mmol/L)条件下的酶活力,根据经典的Michaelis-Menten动力学方程,运用Lineweaver-Burk作图[5](双倒数法)得到米氏方程的倒数形式:
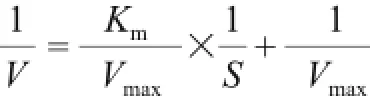
式中:V为酶促反应的速率/(mol/(L· min));S为底物浓度/(mol/L);Vmax为初始底物浓度最大时得到的最大反应速率/(mol/(L·min));Km为该反应的米氏常数/(mol/L)。利用上述公式计算不同处理条件下葡萄糖异构酶的Km和Vmax。
1.3.7 微波处理过的葡萄糖异构酶的紫外光谱分析[17]
用0.02 mol/L的磷酸缓冲液(pH 7.0)配制质量浓度为2 mg/mL葡萄糖异构酶酶液,取30 mL葡萄糖异构酶溶液,使用微波制样系统在200、300、400、600、800 W,控温70 ℃处理5 min后,4 ℃冷藏3 h。取3 mL处理后的酶液,采用UV-2450紫外分光光度计在220~340 nm紫外区域扫描,扫描速度为中速,测定时的分辨率为0.2 nm,基线扫描以0.02 mol/L的磷酸缓冲液进行。
1.3.8 微波处理过的葡萄糖异构酶的荧光光谱分析[18]
采用F-2500荧光光度计,取适量1.3.7节处理后的葡萄糖异构酶液,使用激发波长λEx为295 nm,常温下(2 5±1)℃重复扫描3次,扫描波长λEm范围为300 ~400 nm,狭缝宽度为5 nm,并以未经过微波处理的葡萄糖异构酶液为对照。
1.4 数据分析
实验数据运用Excel 2010和OriginPro 8.0进行分析处理和图形绘制。
2 结果与分析
2.1 不同微波处理功率对葡萄糖异构酶活力的影响

图1 不同微波功率下葡萄糖异构酶的相对酶活力Fig.1 Relative residual activities of glucose isomerase treated with different microwave powers
由图1可知,葡萄糖异构酶在不同功率微波处理后,其酶活力呈先增加后降低的趋势。在固定温度为70 ℃和处理时间5 min的条件下,300、400 W的微波处理可使葡萄糖异构酶的相对酶活力分别显著地增加了14.23%、8.42%(P<0.05);而当微波功率为600、800 W时,葡萄糖异构酶的相对酶活力分别降低到95.69%、90.78%。
2.2 不同微波处理时间对葡萄糖异构酶酶活力的影响
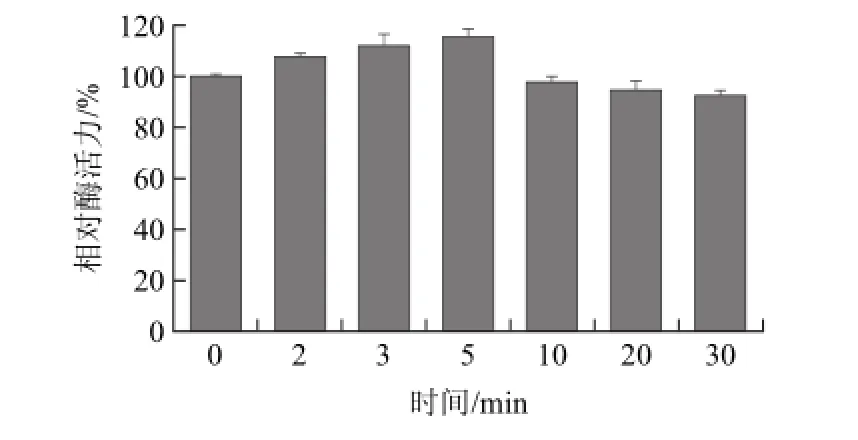
图2 不同微波处理时间下葡萄糖异构酶的相对酶活力Fig.2 Relative residual activities of glucose isomerase treated for different times
由图2可知,在固定温度为70 ℃和微波功率为300 W条件下,葡萄糖异构酶的活力随处理时间的增加而先增加后降低。其中处理时间为3、5 min时,葡萄糖异构酶的相对酶活力分别增加了11.85%、15.45%;当处理时间为10、20、30 min时,葡萄糖异构酶的相对酶活力逐渐降低到97.50%、94.53%、92.27%,但下降趋势并不显著(P>0.05)。
2.3 微波处理对葡萄糖异构酶最适反应温度和温度稳定性的影响
温度是影响葡萄糖异构酶活性的一个重要因素,高温能够提高异构化反应速率,还可使葡萄糖-果糖化学平衡向果糖方向移动[19]。在适宜的温度范围内,葡萄糖异构酶比较稳定,当偏离最适温度后,酶就会发生热变性而导致失活。

图3 微波处理对葡萄糖异构酶的最适反应温度影响Fig.3 Temperature-dependent activity profiles of glucose isomerase treated with different microwave powers
由图3可知,未经微波处理的葡萄糖异构酶的最适反应温度为70~80 ℃,经过300 W微波处理后的最适反应温度为70 ℃,经过400、800 W微波处理后的最适反应温度为75 ℃,这说明微波处理并未明显改变葡萄糖异构酶的最适反应温度。但是经过微波处理的葡萄糖异构酶的最适温度范围变大,未经微波处理的葡萄糖异构酶在70~90 ℃范围内其活力保持在85%以上,而经过300 W微波处理后,葡萄糖异构酶活力在65~90 ℃范围内均在85%以上。
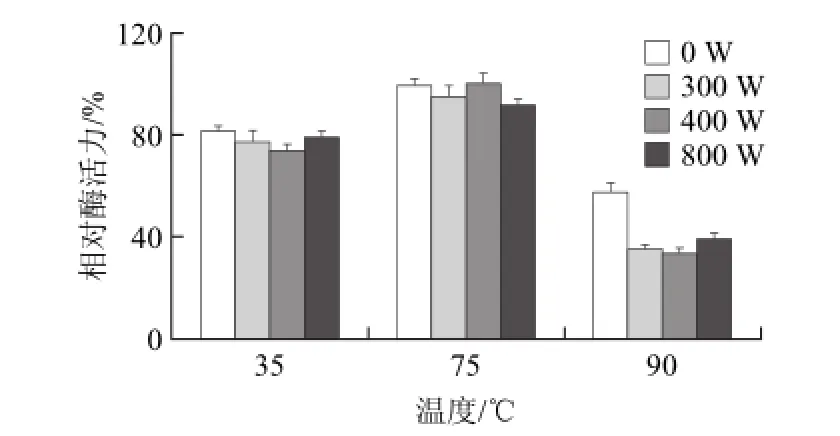
图4 微波处理对葡萄糖异构酶温度稳定性的影响Fig.4 Thermal stability of glucose isomerase treated with various microwave powers
由图4可知,在75 ℃保温1 h后,与未经微波处理的葡萄糖异构酶相比,300、400、800 W微波处理后的相对酶活力分别为94.76%、99.82%、91.65%,表明在此条件下微波处理并未显著改变酶的温度稳定性(P>0.05);在35 ℃保温1 h后,300、400、800 W微波处理后的相对酶活分别为77.08%、73.73%、78.83%,未经微波处理的葡萄糖异构酶相对酶活力为81.13%;经过300、400、800 W微波处理后的葡萄糖异构酶在90 ℃保温1 h后其相对酶活力均少于40%,明显低于未微波处理的葡萄糖异构酶的酶活力(P<0.01)。由此可见,微波处理显著地降低了葡萄糖异构酶在高温中的稳定性,但是没有明显改变其在最适温度(75 ℃)的稳定性。微波处理对酶热稳定性的影响研究不多,仅有Porcelli等[11]使用10.4 GHz微波在90 ℃处理半胱氨酸水解酶40 min后,其相对酶活力只有18%;而用同样条件对甲硫腺苷磷酸化酶处理后,其酶活力仍有78%。
2.4 微波处理对葡萄糖异构酶最适pH值和pH值稳定性的影响
pH值可影响酶分子活性部位上有关基团的解离及底物的解离状态,从而影响酶活性中心与底物的结合或催化,而且有关基团解离状态的改变会影响酶的空间构象,甚至会使酶变性。葡萄糖异构酶的工业化应用中要求弱酸性的环境,以减少褐变反应和相关副产物的形成[3]。

图5 微波处理对葡萄糖异构酶的最适pH值影响Fig.5 pH-dependent activity profiles of glucose isomerase treated with different microwave powers
由图5可知,未经微波处理的葡萄糖异构酶的最适pH值为7.0~7.5,经过微波处理并未改变葡萄糖异构酶的最适pH值,仍然为7.0~7.5。
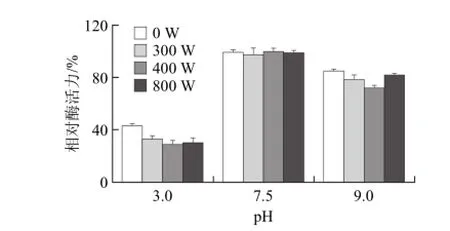
图6 微波处理对葡萄糖异构酶pH值稳定性影响Fig.6 pH stability of glucose isomerase treated with various microwave powers
由图6可知,经过300、400、800W的微波处理后的葡萄糖异构酶在pH7.5保温1h后,其相对酶活分别为97.30%、100%、99.03%,酶活力变化并不显著(P>0.05)。在pH 3.0和pH 9.0保温1 h后,葡萄糖异构酶的相对酶活力变化各不相同,在pH 3.0条件下微波处理后的葡萄糖异构酶的酶活力明显低于未处理的(P<0.05),而且葡萄糖异构酶在pH 9.0条件下酶活力明显比在pH 3.0高(P<0.01)。
2.5 微波处理对葡萄糖异构酶的Km值和Vmax影响
表1 微波处理对葡萄糖异构酶K和V的影响Table 1 The kinetic parameters of glucose isomerase treated with various microwave powers

表1 微波处理对葡萄糖异构酶K和V的影响Table 1 The kinetic parameters of glucose isomerase treated with various microwave powers
微波功率/W 0 300 400 800 Km/( mol/L)Vmax/( mol/(L·min))0.366 1.19×10-30.345 1.75×10-30.337 1.63×10-30.522 1.02×10-3
由表1可知,未经处理的葡萄糖异构酶的Km为0.366 mol/L,最大反应速率Vmax为1.19×10-3mol/(L·min)。经3 0 0 W微波处理后的Km为0.3 4 5,Vmax为1.75×10-3mol/(L· min),经400 W微波处理后的Km为0.337,Vmax为1.63×10-3mol/(L·min),而经800 W微波处理后的葡萄糖异构酶Km为0.522,Vmax为1.02×10-3mol/(L·min)。经过300 W和400 W微波处理后酶的Km变小,说明酶与底物的亲和力变大;而经过800 W微波处理后酶的Km增加,说明酶与底物的亲和力变小。
2.6 微波处理对葡萄糖异构酶紫外光谱的影响
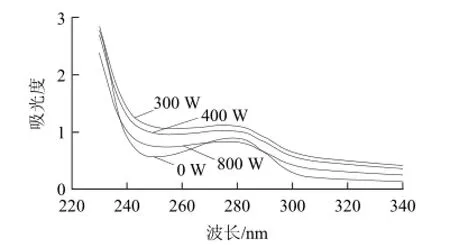
图7 微波处理对葡萄糖异构酶的紫外吸收光谱的影响Fig.7 UV absorption spectra of glucose isomerase treated with various microwave powers
由图7可知,未经微波处理的葡萄糖异构酶的紫外光谱最大吸收峰出现在280 nm波长处,经过300、400 W微波处理后,270~280 nm波长处吸收值迅速增强,最大吸收峰逐渐消失,最大吸收峰位于278 nm波长处。经过400 W微波处理后的葡萄糖异构酶的明显低于300 W处理后的。而经过800 W微波处理后的,葡萄糖异构酶在280 nm波长处的吸收强度低于未经处理的,最大吸收峰位变化不大。280 nm波长处的紫外吸收变化可以反映氨基酸残基所处微环境的变化,300、400 W微波处理可能使葡萄糖异构酶的一些生色集团暴露出来,导致紫外吸收增强[20]。而在800 W微波处理后紫外吸收降低的原因可能是微波处理导致酶分子构象的去折叠引起的。张兆琴等[18]报道动态高压微射流处理后菠萝蛋白酶构象发生变化,酶分子部分去折叠,其紫外光谱吸收降低。Housaindokht等[21]研究表明十四烷基三甲基溴化铵可使α-乳白蛋白构象伸展导致紫外吸收降低。
2.7 微波处理对葡萄糖异构酶荧光光谱的影响

图8 微波处理对葡萄糖异构酶的荧光光谱的影响Fig.8 Intrinsic fluorescence spectra of glucose isomerase treated with various microwave powers
由图8可知,未经微波处理的葡萄糖异构酶的荧光吸收强度峰值位于340 nm波长处。由于300、400 W荧光光谱图重叠,这里未标出400 W荧光图谱。300、600、200 W微波处理后的葡萄糖异构酶的荧光强度依次降低,但均高于未经处理的,而经800 W微波处理的葡萄糖异构酶的在340 nm波长处的荧光强度低于未经微波处理的,该结果与紫外吸收光谱是一致的。蛋白质内源性荧光主要是由赖氨酸和色氨酸发射的[22]。Yin等[23]研究发现,强酸或强碱性条件可破坏菜豆蛋白的三级结构,使菜豆蛋白中的疏水集团暴露,荧光强度增加。200、300、600 W微波处理葡萄糖异构酶的荧光光谱变化表明,微波处理使得葡萄糖异构酶中的赖氨酸和色氨酸残基所处的微环境发生改变,赖氨酸和色氨酸残基所处位置的三级结构发生改变。800 W微波处理后荧光强度降低,可能也是此原因。
3 结 论
不同功率微波处理对葡萄糖异构酶的相对酶活力、最适反应温度和动力学参数影响不同,但对最适pH值几乎没有影响。紫外和荧光光谱研究表明微波处理导致葡萄糖异构酶部分去折叠,分子中赖氨酸和色氨酸残基所处的微环境发生变化,葡萄糖异构酶的三级结构可能发生了改变。
[1] BORGI M A, SRIH-BELGUITH K, ALI M B, et al. Glucose isomerase of the Streptomyces sp. SK strain: purification, sequence analysis and implication of alanine 103 residue in the enzyme thermostability and acidotolerance[J]. Biochime, 2004, 86(8): 561-568.
[2] HARTLEY B S, HANLON N, JACKSON R J, et al. Glucose isomerase: insights into protein engineering for increased thermostability[J]. Biochimica et Biophysica Acta, 2000, 1543(2): 294-335.
[3] BHOSALE S H, RAO M B, DESPHANDE V V. Molecular and industrial aspects of glucose isomerase[J]. Microbiological Reviews, 1996, 609(2): 280-300.
[4] DADVAR M, SAHIMI M. Pore network model of deactivation of immobilized glucose isomerase in packed-bed reactors II: threedimensional simulation at the particle level[J]. Chemical Engineering Science, 2002, 57(6): 939-952.
[5] TUKEL S S, ALAG D. Cat alytic efficiency of immobilized glucose isomerase in isomerization of glucose to fructose[J]. Food Chemistry, 2008, 111(3): 658-662.
[6] TRUAX A, BLISS A K, GUPTA S. High fructose corn syrup[J]. Annals of Clinical Psychiatry, 2011, 23(3): 228-229.
[7] BASCIANO H, FEDERICO L, ADELI K. Fructose, insulin resistance, and metabolic dyslipidemia[J]. Nutrition and Metabolism, 2005, 2(1): 1-14.
[8] BRAY G A, NIELSEN S J, POPKIN B M. Consumption of high-fructose corn syrup in beverages may play a role epidemic of obesity[J]. American Journal of Clinical Nutrition, 2004, 79(4): 537-543.
[9] PETROVSKA B, WINKELHAUSEN E, KUZMANOVA S. Ethanol and polyols production from glucose by Candida boidini NRLL Y-17213[J]. Bulletin of the chemists and technologists of Macedonia, 2000, 19: 57-63.
[10] VADIVAMBAL R, JAYAS D S. Changes in quality of microwavetreated agricultural products: a review[J]. Biosystems Engineering, 2007, 98(1): 1-16.
[11] PORCELLI M, CACCIAPUOTI G, FUSCO S. Non-thermal effects of microwaves on proteins: thermophilic enzymes as model system[J]. FEBS Letters, 1997, 402(2): 102-106.
[12] ROY I, GUPTA M N. Non-thermal effects of microwaves on proteasecatalyzed esterification and transesterification[J]. Tetrahedron, 2003, 59(29): 431-5436.
[13] DAMM M, NUSSHOLD C, CANTILLO D, et al. Can electromagnetic fields influence the structure and enzymatic digest of proteins? A critical evaluation of microwave-assis ted proteomics protocols[J]. Journal of Proteomics, 2012, 75(18): 5533-5543.
[14] REJASSE B, LAMARE S, LEGOY M D, et al. Stability improvement of immobilized Candida antarctica lipase B in organic medium under microwave radiation[J]. Organic and Biomolecular Chemistry, 2004, 2(7): 1086-1089.
[15] DISCHE Z, BORENFREUN E. A new spectrophotometric met hod for the detection and determination of keto sugars and trioses[J]. Journal of Biochemistry, 1951, 192(2): 583-587.
[16] YU H T, GUO Y L, WU D L, et al. Immobilization of glucose isomerase onto GAMM support for isomerization of glucose to fructose[J]. Journal of Molecular Catalysis B: Enzymatic, 2011, 72(2): 73-76.
[17] 王中江, 江连洲, 魏冬旭, 等. pH值对大豆分离蛋白构象及表面疏水性的影响[J]. 食品科学, 2012, 33(11): 47-51.
[18] 张兆琴, 刘伟, 梁瑞红, 等. 动态高压微射流对茎菠萝蛋白酶性质和构象的影响[J]. 食品科学, 2010, 31(7): 46-50.
[19] BANDISH R K, HESS J M, EPTING K L, et al. Glucose-to-fructose conversion at high temperatures with xylose (glucose) isomerases fr om Streptomyces murinus and two hyperthermophilic Thermotoga species[J]. Biotechnology and Bioengineering, 2002, 80(2): 185-194.
[20] GRZYSKA P K, HAUSINGER R P, PROSHLYAKOV D A. Metal and substrate binding to an Fe(Ⅱ) dioxygenase resolved by UV spectroscopy with global regression analysis[J]. Analytical Biochemistry, 2010, 399(1): 64-71.
[21] HOUSAINDOKHT M R, CHAMANI J, SABOURY A A, et al. Three binding sets analysis of α-lctalbumin by interaction of tetradecyl trimethyl ammonium bromide[J]. Bulletin of the Korean Chemical Society, 2001, 22(2): 145-148.
[22] 王守业, 徐小龙, 刘清亮, 等. 荧光光谱在蛋白质分子构象研究中的应用[J]. 化学进展, 2001, 13(4): 257-260.
[23] YIN S W, HUANG K L, TANG C H. Surface charge and conformational properties of phaseolin, the major globulin in red kidney bean: effect of pH[J]. International Journal of Food Science and Technology, 2011, 46(8): 1628-1635.
Effect of Microwave Treatment on the Properties of Glucose Isomerase
HU Guo-zhou, ZHANG Fu-sheng, HU Peng, CHEN Guang-jing, WU Jing-jing, KAN Jian-quan*
(College of Food Science, Southwest University, Chongqing Key Laboratory of Product Processing and Storage, Laboratory of Quality & Safety Risk Assessment for Agro-products on Storage and Preservation (Chongqing), Ministry of Agriculture, Chongqing 400715, China)
The effect of microwave treatment on the activity, stability, kinetic parameters and conformation of glucose isomerase (GI) was studied. Results indicated that different periods and power levels of microwave treatment had different effects on GI activity. After microwave treatment at powers of 300 W and 400 W for 5 min at 70 ℃, GI activity was increased by 14.23% and 8.42%, respectively. However, GI retained 95.69% and 90.78% of its original activity at 600 W and 800 W, respectively. The m icrowave treatment also had effects on the optimal reaction temperature and kinetic pa rameters, but had scarce effects on the optimal pH. Moreover, partial unfolding of GI and changes in microenvironment of tryptophan and tyrosine residues were observed from the ultraviolet and fluorescence spectra of microwave-treated GI. Thus we further speculated that the tertiary structure of GI was also disturbed by microwave treatment. As a conclusion, this study demonstrates that microwave treatment can change some properties of GI presumably by changing its conformational structure.
glucose isomerase; microwave treatment; activity; optimal reaction temperature; optimal pH; conformation
Q814.9
A
1002-6630(2014)03-0134-05
10.7506/spkx1002-6630-201403027
2013-02-05
中央高校基本科研业务费专项(XDJK2012B009);重庆市自然科学基金项目(cstc2012jjA80045)
胡国洲(1987—),男,硕士研究生,研究方向为食品安全与质量控制。E-mail:huguozhou.200@163.com
*通信作者:阚建全(1965—),男,教授,博士,研究方向为食品化学与营养学、食品生物技术。E-mail:ganjq1965@163.com
