芦丁抑制牛血清白蛋白糖基化
2014-01-18李晓明邓荣华孔阳辉夏秋琴吕丽爽
李晓明,邓荣华,孔阳辉,夏秋琴,吕丽爽*
(南京师范大学金陵女子学院,江苏 南京 210097)
芦丁抑制牛血清白蛋白糖基化
李晓明,邓荣华,孔阳辉,夏秋琴,吕丽爽*
(南京师范大学金陵女子学院,江苏 南京 210097)
目的:考察芦丁对糖及活性二羰基化合物诱导的牛血清白蛋白(bovine serum albumin,BSA)糖基化的抑制效果。方法:建立牛血清白蛋白-丙酮醛(bovine serum albumin-methylglyoxal,BSA-MGO)、牛血清白蛋白-乙二醛(bovine serum albumin-glyoxal,BSA-GO)、牛血清白蛋白-还原糖反应体系,利用荧光光 谱的方法考察MGO、GO和还原糖对于BSA糖基化的影响,并考察芦丁对于3个反应体系中晚期糖基化终末产物(advanced glycation end products,AGEs)的抑制作用。结果:MGO、GO、还原糖浓度分别为0.5、0.5、10 mmol/L时引发BSA蛋白糖基化反应较为显著。对于上述3个体系,芦丁的添加浓度分别为0.25、0.25、1 mmol/L时,能有效地抑制AGEs的形成。结论:芦丁能有效地抑制BSA-MGO、BSA-GO、BSA-还原糖体系的牛血清白蛋白糖基化。
牛血清白蛋白;二羰基化合物;芦丁;糖基化终末产物
蛋白糖基化是在糖及活性二羰基化合物的作用下,蛋白质中的氨基酸基团与活性羰基作用引起的蛋白质结构及生物学功能改变的反应。活性二羰基化合物丙酮醛和乙二醛是形成糖基化终产物(advanced glycation end products,AGEs)的前体,属于高反应活性糖基化因子,比葡萄糖的活性高200~50 000倍[1]。蛋白糖基化反应会形成分子内或者分子间交联,最终产生不同结构的晚期AGEs。研究表明:由于这类产物具有不可逆性,外源摄入过多的AGEs[2-4]或者内源性产生AGEs的积累[5-6],会引起阿兹海默症[7]以及糖尿病并发症如糖尿病性肾病[8]和糖尿病性视网膜疾病[9],从而对机体造成很大的损伤。研究发现AGEs的致病机制主要包括两个方面:第一,糖类物质直接与蛋白质交联,破坏蛋白质的结构,从而改变其功能。第二,AGEs与晚期糖基化终产物受体(receptor for advanced glycation end products,RAGE)结合,激活下游信号通路,改变细胞的功能,从而影响其生理活性[10]。
人血清白蛋白(human serum albumin,HSA)是人体内一种最常见的蛋白质,其糖基化的速度是血红蛋白的9倍,能反映近期血糖的水平。荧光法测定HSA蛋白糖基化显示,短期内荧光值可从3 mmol/mol Lys增加至6 mmol/mol Lys[11]。BSA和HSA有80%以上的同源性[12]且结构组成上相似,其差异性主要是BSA与HSA中的疏水性氨基酸不同,而蛋白质的二级结构和三级结构并没有本质的区别。且由于BSA安全、易得,因此可替代HSA被广泛地应用于模拟人体内蛋白质糖基化的研究。
自然界黄酮种类繁多,根据其结构可分为:黄酮类、黄酮醇、异黄酮、查耳酮、黄烷3-醇以及花青素。研究发现儿茶素、根皮素、染料木素、原花青素等黄酮类化合物能够在生理条件下抑制AGEs的形成[13-16]。基于对黄酮醇类化合物对蛋白糖基化抑制规律的研究尚不够完善,本实验选取水溶性好的双糖苷芦丁来表征黄酮醇类化合物,通过不同条件诱导蛋白糖基化体系,探讨芦丁抑制AGEs形成的规律。AGEs的组成部分由于蛋白质的交联,其结构具有一定的荧光吸收,故可以采用荧光光谱法测定AGEs的含量来反映AGEs的总含量[17-19]。
1 材料与方法
1.1 材料与试剂
牛血清白蛋白(分子生物级)、青霉素链霉素混合液 生工生物工程(上海)有限公司;丙酮醛、乙二醛美国Sigma公司;葡萄糖、果糖、半乳糖 上海国药集团化学试剂有限公司;核糖 上海如吉生物科技有限公司;芦丁(98%) 南京广润生物制品有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO) 上海久亿化学试剂有限公司。
1.2 仪器与设备
F200 多功能酶标仪 瑞士帝肯贸易有限公司;XW-80A微型漩涡混合仪 上海沪西分析仪器厂有限公司;HH-6数显恒温水浴锅 金坛市富华仪器有限公司;FA2104N电子分析天平 上海精密科学仪器有限公司;PHS-3C数字式pH计 上海三信仪表厂。
1.3 方法
1.3.1 芦丁对MGO(或GO)诱导牛血清蛋 白糖基化的影响
1.3.1.1 不同浓度MGO(或GO)和不同阶段BSAMGO(GO)体系中AGEs形成量的测定
依据文献[15]的测定方法加以改进,用浓度为0.2 mmol/L、pH 7.4的磷酸盐缓冲液溶解BSA,在10 mL的离心管中加入0.2 mL青霉素和链霉素的混合溶液、3 mg/mLBSA稀释液3 mL,再分别加入不同稀释浓度的MGO(或GO)溶液3 mL,使其最后的浓度分别为0.1、0.25、0.5、1.5 mmol/L。37 ℃水浴加热,在0、4、8、12、24、72、144、288、432、720 h分别取样500 μL于2 mL离心管中,-20 ℃冷冻贮藏。解冻后测定λEx/λEm=340 nm/465 nm荧光值,增益设定为55,以磷酸盐缓冲液代替MGO溶液作为空白,以不含芦丁组为对照组,做3组平行实验。
1.3.1.2 芦丁对BSA-MGO(GO)体系中AGEs形成的抑制
依据文献[15]的测定方法加以改进,用浓度为0.2 mmol/L,pH 7.4的磷酸盐缓冲液溶解BSA,在10 mL的离心管中加入0.2 mL青霉素和链霉素的混合溶液和4.5 mg/mL BSA稀释液2 mL,再加入PBS稀释的MGO(GO)溶液,使其最终浓度为500 ømol/L。在上述的溶液体系中加入不同浓度的DMSO溶解的芦丁溶液,使其最终浓度分别为0.25、0.5、1、2.5 mmol/L,37 ℃水浴加热,在0、24、72、144、288、432、720 h时分别取样500 μL于2 mL离心管,-20 ℃冷冻贮藏。解冻后测定荧光值,计算AGEs抑制率。
AGEs抑制率/%=(1-Rfu芦丁样品组/Rfu空白组)×100
式中:Rfu芦丁样品组为芦丁样品组相对荧光值;Rfu空白组为空白组相对荧光值。
1.3.2 芦丁对不同还原糖引起的牛血清蛋白糖基化的影响
1.3.2.1 不同还原糖种类和浓度对BSA-还原糖体系中AGEs形成量影响的测定
依据文献[20]的测定方法加以改进,用浓度为0.2 mmol/L、pH 7.4的磷酸盐缓冲液溶解BSA,在10 mL的离心管中加入0.2 mL青霉素和链霉素的混合溶液和3 mg/mL BSA稀释液3 mL,再加入稀释后不同浓度的葡萄糖、果糖、半乳糖、核糖溶液3 mL,使其最后的浓度分别为5、10、20、50、100 mmol/L,37 ℃水浴加热,720 h后-20 ℃冷冻贮藏。解冻后测定荧光值,计算AGEs抑制率。
1.3.2.2 芦丁抑制BSA-还原糖体系中AGEs形成的过程
依据文献[20]的测定方法加以改进,用浓度为0.2 mmol/L、pH 7.4的磷酸盐缓冲液溶解BSA,在10 mL的离心管中加入0.2 mL青霉素和链霉素的混合溶液和4.5 mg/mL BSA稀释液2 mL,再加入稀释后的葡萄糖、果糖、半乳糖和核糖溶液,使其最后的浓度分别为10 mmol/L,在上述的溶液体系中加入不同浓度DMSO溶解的芦丁溶液,使其最终浓度分别为1、5、50、250、1 000 ømol/L,37 ℃水浴加热,720 h后-20 ℃冷冻贮藏。解冻后测定荧光值,计算AGEs抑制率。
1.3.2.3 芦丁抑制BSA-核糖体系中AGEs形成的过程
参照1.3.2.2节实验方法制备BSA与核糖反应体系,37 ℃水浴加热条件下,在0、24、72、144、288、432、720 h分别取样500 μL于2 mL离心管,-20 ℃冷冻贮藏。解冻后测定荧光值,计算AGEs抑制率。
1.4 统计分析方法
采用Excel 2010 软件统计分析数据。
2 结果与分析
2.1 芦丁对MGO诱导牛血清蛋白糖基化的抑制效果
2.1.1 MGO浓度对BSA-MGO体系中AGEs形成量的影响

图1 MGO浓度对BSA-MGO体系AGEs形成的影响Fig.1 Effect of methylglyoxal concentration on the formation of advanced glycation end products in bovine serum albumin-methylglyoxal system
由图1可知,不同浓度的MGO(0.1~1.5 mmol/L)在24 h之内随着反应时间的增长,与BSA发生糖基化反应,形成了具有荧光吸收的糖基化终末产物。24 h后,随着时间的增加,晚期糖基化终产物的量不再增加。随着MGO浓度的增加,相对荧光值不断升高,AGEs产量增加,表明MGO浓度与荧光值存在量效关系。当MGO浓度为0.5 mmol/L时,牛血清蛋白糖基化反应已经非常显著,故确定后续实验中选取诱导牛血清蛋白糖基化的MGO浓度为0.5 mmol/L。
2.1.2 芦丁抑制BSA-MGO体系中AGEs形成的活性
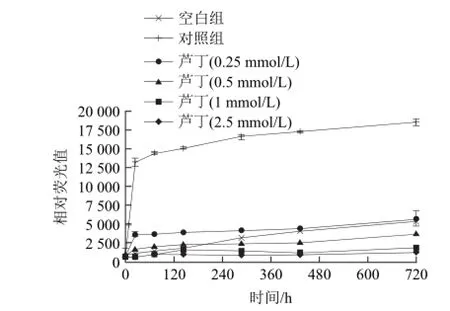
图2 芦丁浓度对BSA-MGO体系对AGEs形成的影响Fig.2 Effect of rutin concentration on the formation of advanced glycation end products in bovine serum albumin-methylglyoxal system
由图2可知,在0.25~2.5 mmol/L的浓度范围内,芦丁有明显的抑制AGEs形成的效果,且产生的AGEs的量随着芦丁浓度的增加减少。当芦丁浓度为0.25 mmol/L,反应24 h后芦丁对AGEs的抑制率达到79.42%;当芦丁浓度增加到0.5 mmol/L,反应24 h后对AGEs的抑制率高达95.93%。
2.2 芦丁对GO诱导牛血清蛋白糖基化的抑制效果
2.2.1 GO浓度对BSA-GO体系中AGEs形成量的影响

图3 GO浓度对BSA-GO体系AGEs形成的影响Fig.3 Effect of glyox al concentration on the formation of advanced glycation end products in bovine serum albumin-glyoxal system
由图3可知,随着反应时间的增长,BSA不断与不同浓度的GO(0.1~1.5 mmol/L)发生反应,形成了具有荧光的糖基化终末产物。随着GO浓度的增加,体系中相对荧光值不断升高,表征产生AGEs越多。当GO浓度为0.5 mmol/L时,牛血清蛋白糖基化程度已经非常显著,因此在后续实验中选择GO诱导牛血清蛋白糖基化的浓度为0.5 mmol/L。另外,GO引起糖基化的反应比MGO缓慢。整个反应周期内糖基化终产物的量始终在不断增加。与MGO相比,GO和牛血清蛋白糖基化的反应活性低、速度慢,且在相同的时间内糖基化终产物的荧光强度明显低于MGO。说明GO产生的AGEs低于MGO产生的AGEs。
2.2.2 芦丁抑制BSA-GO体系中AGEs形成的活性

图4 芦丁浓度对BSA-GO体系对AGEs形成的影响Fig.4 Effect of rutin concentration on the formation of advanced glycation end products in bovine serum albumin-glyoxal system
由图4可知,在0.25~2.5 mmol/L的浓度范围内,芦丁具有一定的抑制AGEs形成的作用,且抑制作用随着芦丁浓度的增加增强。当芦丁浓度为0.25 mmol/L时,芦丁抑制BSA-GO体系AGEs形成的效果相当显著,随着时间延长到24 h时,芦丁对AGEs的抑制率达到53.26%;当芦丁浓度增加到0.5 mmol/L、作用时间为24 h时,芦丁对AGEs的抑制率稍有增加,为57.71%。随着反应时间的不断增长,芦丁对AGEs的抑制率也逐渐增加,当作用时间为30 d,芦丁浓度为0.5 mmol/L时,其对AGEs的抑制率可达到93.48%。MGO体系在芦丁浓度相同的条件下对AGEs的抑制率达到90%以上,作用时间只需24 h,远远短于GO体系中的30 d。
2.3 芦丁对不同还原糖引起的牛血清蛋白糖基化的抑制效果
2.3.1 还原糖种类和浓度对BSA-还原糖体系中AGEs形成量的影响
体系的还原糖浓度为5~100 mmol/L条件下,选取葡萄糖、果糖、半乳糖、核糖4种不同种类的糖,研究其对BSA-还原糖体系中AGEs形成的影响,结果如图5所示。
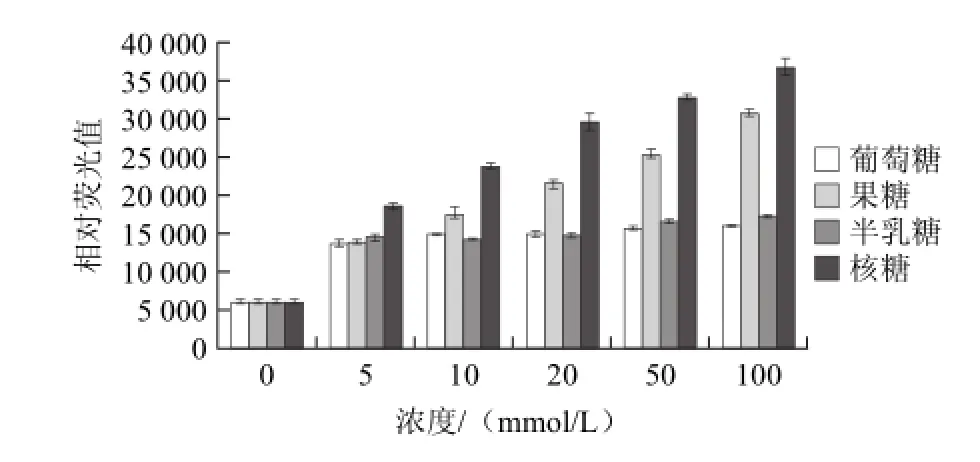
图5 糖浓度和种类对BSA-还原糖体系AGEs形成的影响Fig.5 Effect of concentration and species of sugar on the formation of advanced glycation end products in bovine serum albumin-sugar system
由图5可知,720 h时,随着还原糖浓度的增加,蛋白糖基化反应加强,AGEs产量增加。其中由果糖和核糖引发的蛋白糖基化,AGEs量随着浓度增大显著增加;而由葡萄糖和半乳糖引发的AGEs产量随浓度变化不显著。说明不同种类的糖引发蛋白糖基化的活性存在显著的差异,核糖和果糖更易于引发牛血清蛋白糖基化,产生较多AGEs,且AGEs与糖的浓度存在量效关系。在相同浓度下核糖引发牛血清蛋白糖基化的活性大于果糖。
2.3.2 芦丁抑制不同还原糖引起的牛血清蛋白糖基化的活性

图6 芦丁浓度对BSA-还原糖体系对AGEs形成的影响Fig.6 Effect of rutin concentration on the formation of advanced glycation end products in bovine serum albumin-sugar system
由图6可知,720 h时,在牛血清白蛋白在BSA-还原糖体系中,芦丁具有明显抑制AGEs形成的功效,且抑制率随着芦丁浓度的增加,其对AGEs的抑制率显著增加。当芦丁浓度为0.25 mmol/L时,对葡萄糖、果糖、半乳糖、和核糖与牛血清蛋白产生的AGEs的抑制率分别为56.05%、52.13%、49.29%、47.24%;而当芦丁浓度增大为1 mmol/L的时候,对4种糖的抑制率分别达到71.53%、75.73%、76.89%、74.14%。另外,实验结果还表明还原糖的种类对于芦丁抑制BSA-还原糖体系中AGEs形成量影响不大。
2.3.3 芦丁在不同阶段抑制BSA-核糖体系中AGEs形成的功效

图7 芦丁对BSA-核糖体系AGEs形成的影响Fig.7 Effect of rutin on the formation of advanced glycation end products in bovine serum albumin-ribose system
核糖是一种人体内存在的主要五碳糖,其引发蛋白糖基化的活性最强。由图7可知,随着时间的增加,牛血清蛋白与核糖作用产生的AGEs量逐步增加,当反应到12 d时,产生荧光性的AGEs的量趋于平稳。浓度为1 mmol/L的芦丁,能有效的抑制体系中AGEs的产生。在反应初期,芦丁抑制AGEs的活性随着时间的增加而增大;当作用时间为24 h时,芦丁对AGEs的抑制率达到67.53%;12 d时,其抑制率达到68.6%。
3 讨 论
通过对BSA-MGO、BSA-GO体系中形成AGEs的考察,表明在模拟生理条件下,一定浓度的MGO和GO能够强烈地引发牛血清蛋白发生糖基化反应,并产生大量具有荧光吸收的AGEs。且两者相比,MGO诱导糖基化的能力较GO更强。在人体内,这类活性二羰基化合物主要来源于糖与蛋白反应产生的Amadori分子重排产物、丝氨酸和苏氨酸的分解产物或者磷酸丙糖的分解产物[11]。它们通常会作用于蛋白质的关键性氨基酸,例如Arg、Lys[21-22],并经过一系列的重排和氧化还原反应,最终产生AGEs[23]。
通过对BSA-还原糖体系中形成AGEs的考察,表明在模拟生理条件下,一定浓度的还原糖能够和蛋白质发生缓慢的美拉德反应,引起蛋白质的糖基化。糖基化作用机理主要是糖与蛋白质中的氨基作用形成Schiff碱,进而产生Amadori分子重排产物;通过裂解不稳定的Schiff碱或者Amadori分子重排产物分解得到的二羰基化合物,二羰基化合物再与氨基酸上的活性氨基发生反应,产生AGEs[11]。实验中通过比较核糖、果糖、半乳糖、葡萄糖与牛血清蛋白的糖基化反应发现,核糖引发蛋白糖基化的作用最强,形成AGEs的量最多。各种糖的反应活性依次为:核糖>果糖>葡萄糖/半乳糖。而核糖是人体细胞核的重要组成部分,是人类生命活动中不可缺少的物质,因此,体内核糖引发的蛋白糖基化作用不容忽视。
实验表明还原糖引起蛋白糖基化的反应与二羰基化合物引发蛋白糖基化相比,其反应速率较慢,12 d才能完成;而二羰基化合物非常活泼,尤其是MGO,只要24 h即可与牛血清完成蛋白的糖基化反应,产生大量的AGEs。究其原因,还原糖与蛋白质中游离氨基发生一系列反应过程中产生中间产物——活性二羰基化合物,进而形成AGEs[11]。因此研究由活性二羰基化合物引起的蛋白糖基化具有更为重要的的实际意义。
本研究发现,芦丁能够有效抑制分别由活性二羰基化合物和还原糖引发的蛋白糖基化反应。芦丁抑制活性二羰基化合物的反应发生在24 h之内。在浓度为0.25 mmol/L时,24 h时芦丁抑制MGO和GO引发的蛋白糖基化形成AGEs的抑制率分别为79.42%、53.26%。芦丁对蛋白糖基化的抑制作用不受糖种类的影响,且在反应初期就达到较好的抑制率,当浓度为0.25 mmol/L时,24 h抑制率达60%以上。国外文献报道,部分黄酮类化合物抑制活性二羰基化合物引发蛋白糖基化的作用机理为通过捕获MGO和GO二羰基化合物形成加合物,从而抑制AGEs的形成[13-15]。推测芦丁也是通过捕获糖分解产生的活性二羰基化合物,从而在一定程度上抑制BSA-糖体系中AGEs的形成,但其作用机制以及具体作用过程有待进一步实验验证。
[1] RABBANI N, THORNALLEY P J. Dicarbonyls linked to damage in the powerhouse: glycation of mitochondrial proteins and oxidative stress[J]. Biochemical Society Transactions, 2008, 36(5): 1045-1050.
[2] URIBARRI J, WOODRUFF S, GOODMAN S. Advanced glycation end products in foods and a practical guide to their reduction in the diet[J]. Journal of American Dietetic Association, 2010, 110(6): 911-916.
[3] GEMA A L, FRANCISCO J M. Analysis, distribution, and dietary exposure of glyoxal and methylglyoxal in cookies and their relationship with other heat-induced contaminants[J]. Journal of Agricultural and Food Chemistry, 2010, 58(5): 2966-2972.
[4] FERRER E, ALEGRIÄA A, FARREÄ R, et al. Fluorescence, browning index, and color in infant formulas during storage[J]. Journal of Agricultural and Food Chemistry, 2005, 53(12): 4911-4917.
[5] ZHANG Qibin, TANG Ning, SCHEPMOES A A, et al. Proteomic profi ling of nonenzymatically glycated proteins in human plasma and erythrocyte membranes[J]. Journal of Proteome Research, 2008, 7(5): 2025-2032.
[6] YAMAGISHI S. Role of advanced glycation end products (AGEs) and receptor for AGEs (RAGE) in vascular damage in diabetes[J]. Experimental Gerontology, 2011, 46(4): 217-224.
[7] SIAGH R, BARDEN A, MORI T, et al. Advanced glycation end products:a review[J]. Diabetologia, 2001, 44(2): 129-146.
[8] TON A L Y, FORBES J M, COOPER M E. AGE, RAGE, and ROS in diabetic nephropathy[J]. Diabetic Nephropathy, 2007, 27(2): 130-143.
[9] BHATTACHARYYA J, SHIPOVA E V, SANTHOSHKUMAR P, et al. Effect of a single AGE modifi cation on the structure and chaperone activity of human αB-crystallin[J]. Biochemistry, 2007, 46(50): 14682-14692.
[10] 杨秀颖, 杜冠华. 糖基化终末产物及相关药物研究进展[J]. 中国药理学通报, 2011, 27(9): 1185-1188.
[11] ZHANG Qibin, AMES J M, SMITH R D, et al. A perspective on the maillard reaction and the analysis of protein glycation by mass spectrometry: probing the pathogenesis of chronic disease[J]. Journal of Proteome Research, 2009, 8(2): 754-769.
[12] RONDEAU P, BOURDON E. The glycation of albumin: structural and functional impacts[J]. Biochimie, 2011, 93(4): 645-658.
[13] SANG Shengmin, SHAO Xi, BAI Naisheng et al. Tea polyphenol(-)-epigallocatechin-3-gallate: a new trapping agent of reactive dicarbonyl species[J]. Chemical Research in Toxicology, 2007, 20(12): 1862-1870.
[14] SHAO Xi, BAI Naisheng, HE Kan, et al. Apple polyphenols, phloretin and phloridzin: new trapping agents of reactive dicarbonyl species[J]. Chemical Research in Toxicology, 2008, 21(10): 2042-2050.
[15] LÜ Lishuang, SHAO Xi, CHEN Huadong, et al. Genistein inhibits advanced glycation end product formation by trapping methylglyoxal[J]. Chemical Research in Toxicology, 2011, 24(4): 579-586.
[16] WANG Wei, YAGIZ Y, BURAN T J, et al. Phytochemicals from berries and grapes inhibited the formation of advanced glycation end-products by scavenging reactive carbonyls[J]. Food Research International, 2011, 44(9): 2666 -2673.
[17] YANG Bao, ZHAO Mouming, JIANG Yueming. Anti-glycated activity of polysaccharides of longan (Dimocarpus longan Lour.) fruit pericarp treated by ultrasonic wave[J]. Food Chemistry, 2009, 114(2): 629-633.
[18] RAMFUL D, TARNUS E, RONDEAU P, et al. Citrus fruit extracts reduce advanced glycation end products (AGEs)-and H2O2-induced oxidative stress in human adipocytes[J]. Journal of Agricultural and Food Chemistry, 2010, 58(20): 11119-11129.
[19] HO S C, WU S P, LIN S M R, et al. Comparison of anti-glycation capacities of several herbal infusions with that of green tea[J]. Food Chemistry, 2010, 122(3): 768-774.
[20] KIM H Y, LEE M L, YOKOZAWA T. Protective activity of flavonoid and flavonoid glycosides against glucose-mediated protein damage[J]. Food Chemistry, 2011, 126(3):892-895.
[21] KLOPFER A, SPANNEBERG R, GLOMB M A. Formation of arginine modifi cations in a model system of Nα-tert-butoxycarbonyl (Boc)-arginine with methylglyoxal[J]. Journal of Agricultural and Food Chemistry, 2011, 59(1): 394-401.
[22] NASIRI R, FIELD M J, ZAHED M. Cross-linking mechanisms of arginine and lysine with α, β-dicarbonyl compounds in aqueous solution[J]. Journal of Physical Chemistry A, 2011, 115(46): 13542-13555.
[23] 房红娟, 李红姣, 张双凤, 等. 加工条件对BSA-Glucose体系中晚糖基化末端产物形成的影响[J]. 食品科学, 2012, 33(21): 6-10.
Inhibitory Effect of Rutin on the Formation of Advanced Glycation End Products (AGEs) from Bovine Serum Albumin
LI Xiao-ming, DENG Rong-hua, KONG Yang-hui, XIA Qiu-qin, LÜ Li-shuang*
(Ginling College, Nanjing Normal University, Nanjing 210097, China)
Purpose: To study the inhibitory effect of rutin on the formation of advanced glycation end products (AGEs) in bovine serum albumin (BSA) system caused by sugar or dicarbonyl compounds metabolized by sugar. Methods: BSAMGO (methylglyoxal), BSA-GO (glyoxal) and BSA-reducing sugar reaction systems were established. The effects of MGO, GO and reducing sugar concentrations on the formation of AGEs were investigated by fluorescence spectrophotometry. The inhibitory effect of rutin on the formation of AGEs was investigated at various concentrations added in three reaction systems. Results: Non-enzymatic glycation of BSA was obviously observed in these three systems with MGO, GO and sugar at 0.5, 0.5 mmol/L and 10 mmol/L, respectively. Rutin addition at concentrations of 0.25, 0.25 mmol/L and 1 mmol/L could effectively inhibit the formation of AGEs in the three systems. Conclusion: Rutin can effectively inhibit AGEs in BSAMGO, BSA-GO and BSA-sugar systems.
bovine serum albumin; dicarbonyl compounds; rutin; advanced glycation end product
TS201.2
A
1002-6630(2014)03-0085-05
10.7506/spkx1002-6630-201403018
2013-04-16
江苏省普通高校研究生科研创新计划项目(CXLX12_0417);江苏省自然科学基金项目(BK2012850);江苏省教育厅自然科学基金项目(12KJB5500005)
李晓明(1989—),男,硕士研究生,研究方向为食品化学。E-mail:lixiaoming2000@163.com
*通信作者:吕丽爽(1969—),女,副教授,博士,研究方向为功能性食品成分的分离及活性。E-mail:lishuanglv@126.com
