新斯的明拮抗老年患者术后肌松药残留阻滞作用的量效研究
2014-01-18陈志聪史嘉华鲍亚楠廖长剑黄绍农刘志恒
陈志聪 史嘉华 鲍亚楠 廖长剑 黄绍农 刘志恒
深圳市第二人民医院麻醉科,广东深圳 518035
肌松药残留阻滞作用是指患者术中使用肌松药,在术后由于神经肌肉功能尚未恢复至正常水平而造成呼吸、视觉、吞咽等功能受限的现象,可造成患者术后严重的呼吸功能障碍,直接威胁患者生命安全[1]。老年患者因生理功能减退、慢性疾病以及药物分布容积和血浆清除率的改变等使肌松药的代谢速率减慢,恢复时间明显延长[2]。 因此老年患者的术后肌松药残留阻滞作用更应引起足够的重视。新斯的明被广泛应用于临床拮抗非去极化肌松药残留阻滞作用,但老年患者使用新斯的明的合适剂量一直没有很好定义。本研究拟在老年患者术后,使用不同剂量的新斯的明拮抗顺阿曲库铵的肌松药残留阻滞作用,观察拮抗效果及相应副作用。
1 资料与方法
1.1 一般资料
选择深圳市第二人民医院2013 年2~9 月在全麻下腹腔镜胆囊摘除术的老年患者80 例。 入选标准:ASAⅠ或Ⅱ级;既往无心脏、肝脏、肾脏及神经肌肉疾病史; 术前及术中未使用影响肌松药阻滞效能的药物; 术前无水电解质紊乱, 无发热; 体重指数(BMI)18~25 kg/m2。 排除标准:腕部尺神经表面有外伤或手术史; 近期使用干扰神经肌肉兴奋传导的药物如氨基甙类抗生素、苯妥英钠等;既往有顺式阿曲库铵、新斯的明过敏史。 随机分为4 组,每组各20例,按照术后当4 个成串刺激比值 (train-of-four ratio,TOFR)恢复至0.5 时,分别单次给予生理盐水、新斯的明5、10、20 μg/kg,相应标记为T0,T5,T10和T20组。 本研究经医院伦理委员会批准, 患者及其家属知情同意并签署知情同意书。 各组患者的年龄、性别等一般资料比较,差异无统计学意义(P > 0.05),具有可比性。 见表1。
表1 4 组患者一般情况比较(±s)

表1 4 组患者一般情况比较(±s)
?
1.2 麻醉方法
所有患者入手术室后, 使用多功能监护仪(GE Datex-Ohmeda S/5)监测Ⅱ导联心电图(ECG),无创动脉血压(NIBP),脉搏血氧饱和度(SpO2)及鼻咽温。 连接双频脑电指数(BIS)监测。 麻醉诱导予静脉靶控输注丙泊酚,初始血浆靶控浓度为3 μg/mL,待患者意识消失后,启动肌松监测仪,进行自动定标后开始持续记录TOFR。然后静脉注射顺式阿曲库铵(葛兰素史克公司,英国)0.2 mg/kg,再缓慢(30~60 s)静脉注射盐酸瑞芬太尼0.5~1 μg/kg, 并予0.1~0.5 μg/(kg·min)持续泵注。 在TOFR 为0 时行气管插管。 气管插管成功后,所有患者行机械间歇性正压通气,通气参数为潮气量7~8 mL/kg,频率12~15 次/min,控制呼末二氧化碳(PETCO2)在35~45 mm Hg(1 mm Hg=0.133 kPa)范围内。 术中静脉输注丙泊酚和瑞芬太尼维持麻醉,维持BIS 值40~60,维持NIBP 波动≤20%基础血压,HR 在40~90 次/min。 术中维持室温在21~23℃,鼻咽温36~37℃之间。 术中不追加顺阿曲库铵,手术结束前20 min 静脉注射帕瑞昔布钠40 mg 及布托啡诺1 mg 术后镇痛。 手术结束时停止输注丙泊酚及瑞芬太尼, 按分组予生理盐水或者新斯的明静脉注射。TOFR 恢复到1.0 后再观察10 min,待患者清醒,呼吸恢复良好后拔除气管导管。
1.3 肌松监测
所有患者采用TOF-Watch SX 肌松监测仪(欧加农公司,爱尔兰)监测神经肌肉功能。 麻醉诱导前,用酒精清洁皮肤后粘贴表面电极于尺神经两侧,连接刺激导线。 用硅胶带固定手掌式适配器,使拇指传感器有200~300 g 前负荷。 除拇指外,固定余下四指及前臂。 启动肌松监测仪,选用4 个成串刺激(TOF)模式,频率为2 Hz,波宽0.2 ms,每个成串刺激间隔15 s,自动定标。 术中肌松监测仪通过光纤及RS232 适配器与计算机USB 接口连接, 在计算机系统中应用监测程序(TOF-WATCH SX MONITOR Version 1.2.INT)持续监测及记录TOFR,直至TOFR 恢复至1.0 后10 min。整个监测过程中维持掌侧温度在32~34℃。
1.4 观察指标
记录各组自注射新斯的明或者生理盐水后TOFR 恢复到1.0 的时间,记录在10 min 内TOFR 恢复到1.0 的患者数量及计算其百分比,记录拮抗前及拮抗后第3、5、10 分钟的心率(HR)、血压(BP)的变化,记录术后6 h 恶心呕吐发生率。
1.5 统计学方法
采用统计软件SPSS 19.0 对数据进行分析, 正态分布计量资料以均数±标准差(±s)表示,多组间比较采用方差分析,两两比较采用LSD-t 检验。 计数资料以率表示,采用χ2检验。 以P < 0.05 为差异有统计学意义。
2 结果
2.1 4 组TOFR 恢复至1.0 的时间
与T0组[(19.1±1.0)min]比较,T5组及T10组TOFR恢复到1.0 的时间有所缩短[(17.2±1.12)、(15.9±1.3)min],但差异无统计学意义(P>0.05)。与T0组[(19.1±1.0)min]比较,T20组TOFR 恢复到1.0 的时间明显缩短[(7.3±0.4)min],差异有统计学意义(P < 0.05)。
2.2 注射新斯的明或生理盐水后10 min 内,4 组TOFR 成功恢复至1.0 的百分率
与T0组3(15%)比较,T5组及T10组在10 min 内TOFR 成功恢复到1.0 的百分率有所增加[5(25%),9(45%)],但差异无统计学意义(P > 0.05)。 与T0组[3(15%)] 比较,T20组10 min 内TOFR 成功恢复到1.0的百分率显著增加[18(90%)],差异有统计学意义(P < 0.05)。
2.3 4 组HR 及MAP 比较
T20组HR 下降明显,在第3、5、10 分钟时与给药前比较,差异有统计学意义(P < 0.05),其中有4 例HR<60 次/min,需要使用阿托品纠正心动过缓。而T5、T10组HR 与给药前比较, 差异无统计学意义 (P >0.05)。 4 组给药前和给药后MAP 的变化差异无统计学意义(P > 0.05)。 见表2。
表2 各组用药前后HR 及MAP 变化(±s)
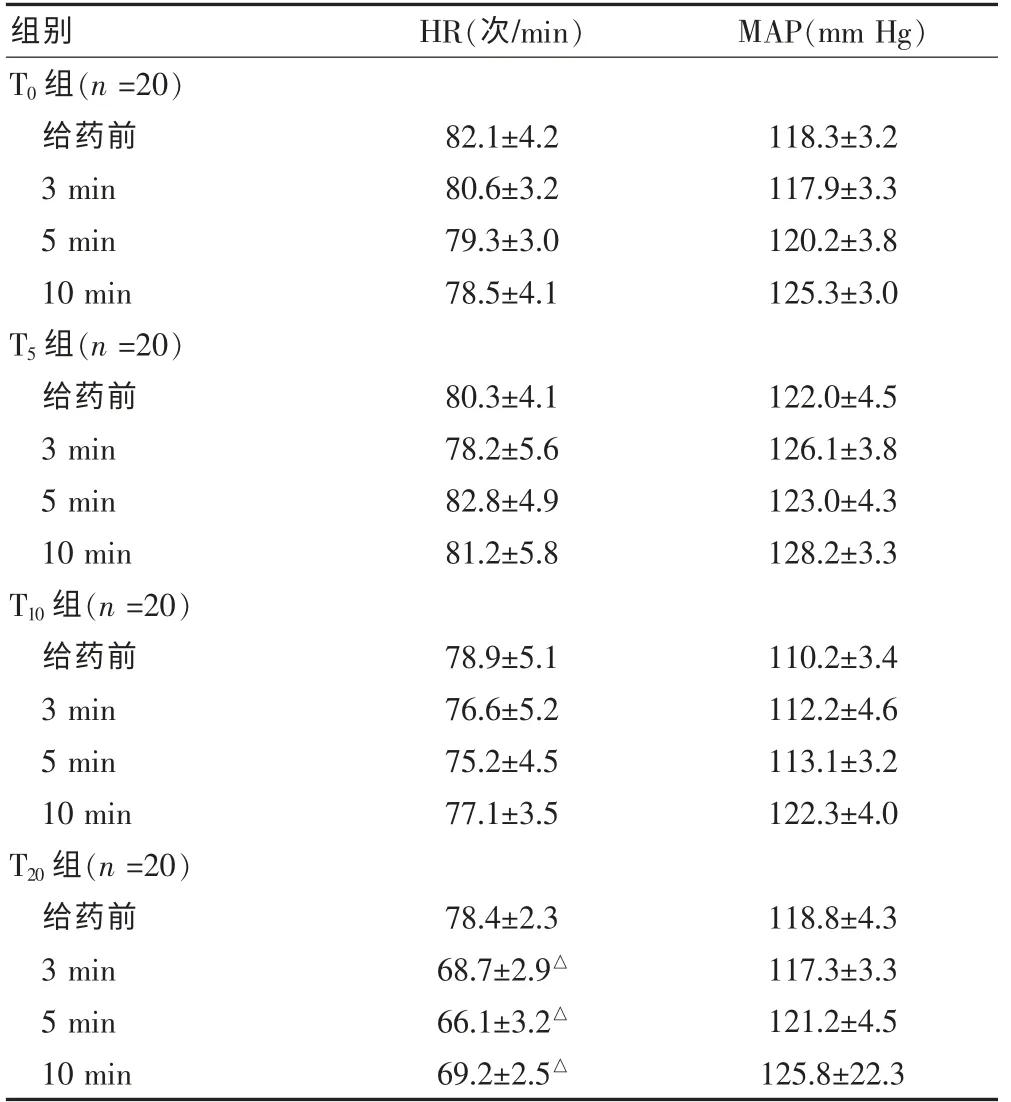
表2 各组用药前后HR 及MAP 变化(±s)
注: 与同组给药前比较,△P<0.05;HR: 心率;BP: 血压;1 mm Hg=0.133 kPa
?
2.4 4 组术后恶心呕吐发生率比较
T5、T10、T20组术后恶心呕吐发生率分别为15%、20%、15%,与T0组(15%)比较,差异无统计学意义(P> 0.05)。
3 讨论
目前腹腔镜下胆囊切除手术多采取全身麻醉,为确保腹腔镜手术过程中腹腔内压力<12 mm Hg(1 mm Hg = 0.133 kPa),以减少腹腔内脏器的缺血再灌注损伤和炎性反应,利于暴露术野,因此术中应达到较深的肌松程度。 通常此类手术术程短小,但即使在诱导时给予单次插管剂量的 (3 ~4 倍ED95)的顺式阿曲库铵,术后也存在肌松药残留阻滞作用的可能[3],可导致呼吸肌和咽部肌群无力,增加低氧血症和反流误吸风险, 并可引起无力咳嗽,不能有效清除分泌物,而导致术后肺部并发症的发生,明显延长住院时间,增加术后的并发症和病死率[4-5],因此需要重视拮抗这类手术的肌松药残留阻滞作用。
随着年龄的增长,老年患者肝肾功能降低,致使肌松药物清除的速率减慢,半衰期延长,术后更易出现肌松药残留阻滞作用。 顺阿曲库铵因其代谢特点,接近80%通过Hoffman 降解, 对肝肾功能的依赖比其他肌松药更少,因而适合老年患者应用。 而即使是成年患者使用顺阿曲库铵, 术后仍有40%的患者需要拮抗肌松药残留作用,因此,对老年患者应用顺阿曲库铵, 更应重视其术后的肌松药残留阻滞作用的拮抗。
既往研究证实[6-7],炎性反应可以有效拮抗顺阿曲库铵的残留阻滞作用, 减少肌松药残留带来的危害。 炎性反应由氨基甲酸和一组季铵组成,能与乙酰胆碱酯酶的催化部位发生静电结合, 并通过氨基甲酸与胆碱酯酶共价结合从而暂时抑制乙酰胆碱酯酶,增加神经肌肉接头部乙酰胆碱的浓度,促进神经肌肉兴奋传递恢复正常。 静脉注射新斯的明后,其作用通常在5~10 min 时表现明显,10 min 时达高峰。在国内专家共识中建议,在成年人术后,当TOF 出现2 个反应或者开始有自主呼吸时拮抗, 使用剂量从40~70 μg/kg,最大剂量5 mg。 如此剂量新斯的明对老年患者可能产生明显的副作用如严重心动过缓,心律失常及冠状动脉痉挛等严重并发症, 限制了临床上大剂量新斯的明在老年患者中的使用[8]。 此外,研究显示,老年患者对新斯的明较成年人更为敏感,起效快,所需的剂量更小。 因此,选择合适剂量的新斯的明拮抗老年患者术后肌松药残留阻滞作用尤为重要。
本研究结果显示,老年患者在TOFR 恢复到0.5时,给予20 μg/kg 剂量的新斯的明拮抗,TOFR 恢复到1.0 的时间缩短为 (7.3±0.4)min,10 min 内TOFR 成功恢复到1.0 的百分率达90.0%, 这一结果与Fuchs-Buder 等[9]及Sauer 等[10]的研究 结果相似,也证实在轻度的肌松药残留的情况下 (如TOFR≥0.5),给予新斯的明20 μg/kg 可有效拮抗肌松药的残留阻滞作用。这一研究结果,为国内专家共识建议的成年患者拮抗剂量的1/4~1/2,差别的主要原因可能在于拮抗的时机, 在专家共识中建议在TOF 出现2 个反应或者出现自主呼吸就开始拮抗, 其肌松药残留的程度远比TOFR 恢复到0.5 时的要深。 因此,在TOFR 恢复到0.5 的情况下,随着更多神经肌肉接头功能的恢复,需要新斯的明剂量更少。 另外一方面,老年患者随着年龄而伴随的生理改变, 导致对新斯的明更为敏感, 也可能是小剂量新斯的明可有效拮抗肌松药残留阻滞作用的原因。 在更轻度的肌松药残留情况,如TOFR 恢复到0.7 等情况,拮抗所需的新斯的明合适的剂量是否可进一步减少, 或者需要更多研究证实。
临床上常伍用阿托品治疗新斯的明拟胆碱的副作用,剂量为新斯的明的半量或者三分之一[8]。本研究发现, 使用5 μg/kg 和10 μg/kg 剂量的新斯的明,并不影响心率。 随着剂量增大,20 μg/kg 剂量的新斯的明,使心率变慢,该组别中只有4 例患者需要使用阿托品治疗心动过缓,占该组别的20%。 鉴于应用阿托品主要缺点是导致心率增快[11],心脏做功和氧耗增加,并且增加老年患者术后谵妄和认知功能障碍机会[12]。因此,对于老年患者使用小剂量新斯的明拮抗轻度肌松药残留作用时,是否需常规伍用阿托品或需进一步研究。
既往的研究认为,新斯的明增加术后恶心呕吐的风险。但本次研究发现小剂量的新斯的明并不引起术后恶心呕吐的增多,这一结果与一项荟萃分析[13]结果类似。 该荟萃分析认为,新斯的明不增加术后恶心呕吐风险,因此不应担心新斯的明引发恶心呕吐而不使用来拮抗肌松药残留阻滞作用。
在既往的文献中,TOFR 0.9 多作为成功肌松拮抗的终点,但即使是TOFR 恢复到0.9,仍存在咽喉肌功能紊乱的风险[14],部分患者主诉吞咽困难,眼睑下垂和视力模糊等不适。而且Capron 等[15]研究认为加速度肌松监测仪在TOFR 恢复到1.0 方可排除肌松残余。 因此本次研究选取TOFR 恢复到1.0 为研究终点,尽可能确保老年患者术后通气及气道保护功能的充分恢复,以策安全。
本研究不足之处为仅在特定的时机 (TOFR 0.5)给予新斯的明拮抗肌松药残留作用,而在临床麻醉过程中,准确的拮抗肌松药残留作用往往不太现实。 一方面由于神经肌肉传递功能的量化监测远未普及,正如Grayling 等[16]和Fuchs-Buder 等[17]的调查发现,在英国和德国, 仅有10%~18%的麻醉医生常规使用肌松监测。 而另一方面,大部分的麻醉医生在拔除气管导管前,仍然主要依靠观察患者的临床表现,或通过睁眼抬头、抬腿、紧握、咬力等测试判断是否存在肌松残余。 尽管如此,本研究提示,在老年患者术后,若通气功能恢复,而出现吞咽困难,眼睑下垂和视力模糊等症状,可以考虑给予小剂量(如20 μg/kg)的新斯的明拮抗肌松药残留作用。
综上所述, 在老年患者腹腔镜胆囊切除术后,当TOFR 恢复至0.5 时, 使用20 μg/kg 新斯的明可有效的拮抗顺式阿曲库铵的残留作用,但仍需注意拮抗后出现心动过缓的风险。
[1] 孙瑗,王祥瑞,陈杰,等.维库溴铵用于肝功能损害病人残余肌松与呼吸功能恢复的研究[J].临床麻醉学杂志,2007,23(2):123-125.
[2] stergaard D,Viby-Mogensen J,Pedersen NA,et al.Pharmacokinetics and pharmacodynamics of mivacurium in young adult and elderly patients[J].Acta Anaesthesiol Scand,2002,46(6):684-691.
[3] Cammu G,De Baerdemaeker L,Blauwen N,et al. Postoperative residual curatization with cisatracurium and rocuronium infusions[J].European Journal of Anaesthesiology,2002,19(2):129-134.
[4] Murphy GS,Brull SJ.Residual neuromuscular block:lessons unlearned.Part Ⅰ:definitions,incidence,and adverse physiologic effects of residual neuromuscular block [J]. Anesthesia & Analgesia,2010,111(1):120-128.
[5] Kopman AF. Undetected residual neuromuscular block has consequences [J]. Anesthesiology,2008,109(3):363-364.
[6] Kopman AF,Kumar S,Klewicka MM,et al.The staircase phenomenon:implications for monitoring of neuromuscular transmission [J]. Anesthesiology,2001,95:403-407.
[7] Claudius C,Viby-Mogensen J. Acceleromyography for use in scientific and clinical practice:a systematic review of the evidence [J]. Anesthesiology,2008,108:1117-1140.
[8] 中华医学会麻醉学分会.肌肉松弛药合理应用的专家共识(2013)[J].中华医学杂志,2013,93(25):1940-1943.
[9] Fuchs-Buder T,Meistelman C,Alla F,et al. Antagonism of low degrees of atracurium-induced neuromuscular blockade:dose-effect relationship[J].Anesthesiology,2010,112(1):34-40.
[10] Sauer M,Stahn A,Soltesz S,et al. The influence of residual neuromuscular block on the incidence of critical respiratory events.A randomised,prospective,placebo-controlled trial [J]. Eur J Anaesthesiol,2011,28(12):842-848.
[11] Marine JE,Watanabe MA,Smith TW,et al. Effect of atropine on heart rate turbulence [J]. The AmericanJournal of Cardiology,2002,89(6):767-769.
[12] Cilag J,Abbott E. Anticholinergic effects of medication in elderly patients [J]. J Clin Psychiatry,2001,62(21):11-14.
[13] Cheng CR,Sessler DI,Apfel CC.Does neostigmine administration produce a clinically important increase in postoperative nausea and vomiting? [J]. Anesthesia and Analgesia,2005,101(5):1349.
[14] Sundman E,Witt H,Olson R,et al. The incidence and mechanisms of pharyngeal and upper oesophageal dysfunction in partially paralyzed humans [J]. Anesthesiology,2000,92:977-984.
[15] Capron F,Alla F,Hottier C,et al. Can acceleromyography detect low levels of residual paralysis A probability approach to detect a mechanomyographic train-of-four ratio of 0.9 [J]. Anesthesiology,2004,100:1119-1124.
[16] GraylingM,SweenyBP.Recoveryfromneuromuscularblockade:a survey of practice[J].Anaesthesia,2007,62:806-809.
[17] Fuchs-Buder T,Fink H,Hofmockel R,et al. Application of neuromuscular monitoring in Germany[J].Anaesthesist,2008,57:908-914.
