头痛宁胶囊对偏头痛大鼠中脑降钙素基因相关肽表达的影响
2014-01-18赵继福于挺敏
姚 刚 赵继福 黄 倩 于挺敏▲
1.吉林大学第二医院神经内科,吉林长春 130041;2.长春市中医院内科,吉林长春 130022
降钙素基因相关肽(calcitonin gene-related peptide,CGRP) 是内源性痛觉调制系统中重要的中介物质, 拮抗和减弱内源性阿片肽在中脑的镇痛效应,参与调节内源性痛觉调制系统的功能[1-2]。头痛宁胶囊对多种慢性头痛(如偏头痛、紧张型头痛等)均有较为满意的疗效[3-4]。 该药对内源性痛觉调制系统的关键结构——中脑CGRP 的表达是否产生影响目前尚无相关研究。本实验通过观察头痛宁胶囊对偏头痛模型大鼠中脑CGRP mRNA 表达的影响,探讨该药对偏头痛的治疗机制。
1 材料与方法
1.1 试剂与仪器
头痛宁胶囊(咸阳步长制药有限公司);硝酸甘油注射剂(山西康宝生物制品股份有限公司);RNAiso Reagent、RNA PCR Kit (AMV)Ver.3.0、E.coli DH5α、pEASY-T1 Vector、限制酶BamH Ⅰ和EcoR Ⅴ、SYBR Premix Ex TaqTM均购自大连TaKaRa 公司;AxyPrep DNA Gel Extraction Kit 及AxyPrep Plasmid Miniprep Kit购自Axygen Biosciences 公司;其他试剂均为国产分析纯。PCR 仪(Perkin Elmer GeneAmp PCR system2400);台式冷冻离心机(MIKRO 22R zentrifugen);超低温冰箱(MDF-382E);Sub-Cell GT(Agarose Gel Electrophoresis Systems,BIO-RAD);BIO-RAD Power PAC 200/300稳压稳流电泳仪;凝胶成像系统(Kada);紫外分光光度计(UV-2401PC,Shimadzu),软件:UVPC version 3.9;定量PCR 仪(ABI PRISM 7500)。
1.2 方法
1.2.1 实验动物、分组、药物干预、造模
健康Wistar 大鼠24 只,雌雄各半,200~220 g,由吉林大学基础医学院动物中心提供。 24 只健康成年Wistar 大鼠,随机分为4 组:对照组(A 组),偏头痛组(B 组),头痛宁胶囊对照组(C 组),头痛宁胶囊治疗组(D 组),每组6 只。 根据成人每日口服剂量换算得到实验大鼠给药剂量,头痛宁胶囊对照组和头痛宁胶囊治疗组给予头痛宁胶囊0.375 g/(kg·d)灌胃,对照组、偏头痛组给予生理盐水2 mL/d 灌胃给药,连续给药7 d 后, 偏头痛组和头痛宁胶囊对照组大鼠制备偏头痛大鼠模型 (臀部皮下注射硝酸甘油注射剂10 mg/kg),以造模大鼠出现爬笼次数增多、前肢频繁搔头、往返运动、咬尾等不适的症状为造模成功的指标[6]。 对照组和头痛宁胶囊对照组大鼠皮下注射生理盐水2 mL/kg。
1.2.2 标本采集
造模2 h 时10%水合氯醛麻醉大鼠(0.3 mL/100 g),取脑,分离中脑,-70℃保存。
1.2.3 实时定量PCR
1.2.3.1 cDNA 合成 按RNA 提取试剂盒说明书提取各组大鼠中脑总RNA。 MgCl24 μL, RNase Inhibitor 0.5 μL, AMV Reverse Transcriptase 1 μL,5×RT Buffer 4 μL,dNTP Mixture (各10 mmol/L)2 μL,Random 9 mers 1 μL, 总RNA 250 ng, 以及RNase Free dH2O,总体积为20 μL。 逆转录反应条件:30℃10 min,42℃30 min,99℃5 min,5℃5 min。
1.2.3.2 标准品制备 CGRP 引物上游5'-AAGTTCTCCCCTTTCCTGGT-3',下游5'-GGTGGGCACAAAGTTG TCCT-3'。 PCR 扩增反应条件:变性(94℃30s),退火(53℃30 s),延伸(72℃30 s),35 个循环。 试剂盒回收、纯化PCR 扩增的目的基因,与pEASY-T1 载体连接,之后转化到E.coli DH5α 中,氨苄青霉素筛选,试剂盒提取质粒,限制酶BamH Ⅰ、EcoR Ⅴ双酶切鉴定及测序,证实CGRP cDNA 全长完全正确。 计算所提取质粒的拷贝数(测OD260值),作为标准品(无菌水10 倍系列稀释后分装),-20℃保存。
1.2.3.3 SYBR GreenⅠ实时定量PCR SYBR Premix ExTaqTM10 μL,ROX Reference Dye 0.4 μL, 上下游引物各0.4 μL(10 μmol/L),cDNA 标本2.0 μL,dH2O 6.8 μL,总反应体系为20 μL。 10 倍系列稀释的标准品,同时进行PCR 扩增。各标本均做3 个复孔。反应条件:变性(94℃30 s),退火(53℃30 s),延伸(72℃30 s),共40个循环。 同时进行熔解曲线分析,分析模式:95℃15 s,60℃20 s,95℃15 s。
1.3 统计学方法
采用SPSS 17.0 统计学软件进行数据分析, 计量资料数据用均数±标准差(±s)表示,组间差别采用单因素方差分析和Tukey 比较,以P < 0.05 为差异有统计学意义。
2 结果
2.1 CGRP 质粒标准品
采用普通PCR 获得CGRP 基因扩增产物,纯化回收,与pEASY-T1 载体连接成为重组质粒(标准品),质粒标准品经过双酶切鉴定与预期结果一致,测序结果回报所克隆序列同靶基因序列的同源性达100%。
2.2 CGRP 标准品实时定量PCR 标准曲线
利用10 倍系列稀释的CGRP 质粒标准品制作PCR 标准曲线。 基因检测的下限为2.7×103拷贝/μL,检测的上限为2.7×109拷贝/μL, 回归方程Ct=-2.69Log(x)+38.875,r=0.993,线性范围达7 个数量级(图1)。
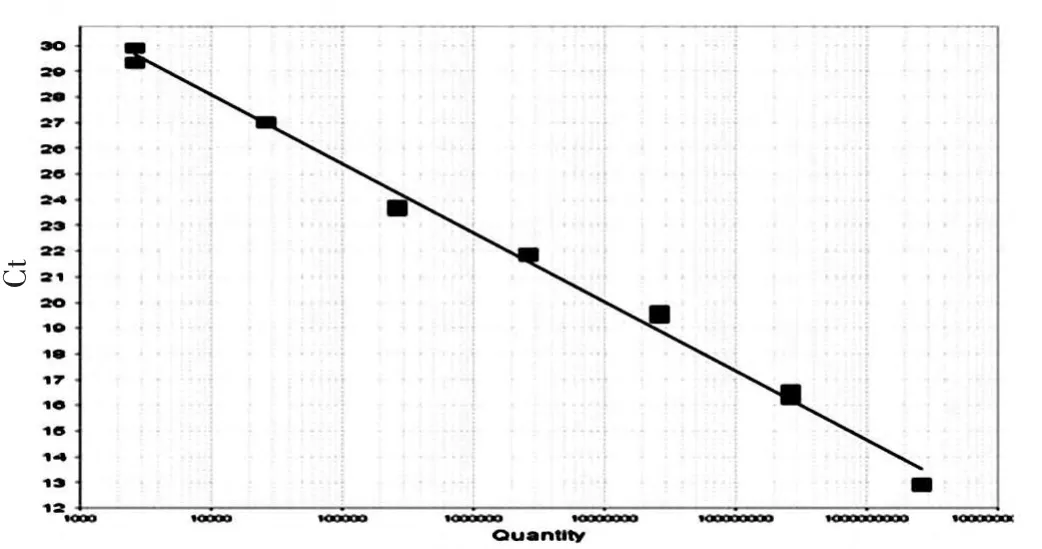
图1 降钙素基因相关肽基因标准品实时定量PCR 标准曲线
2.3 产物特异性
熔解曲线分析结果显示,10 倍系列稀释的CGRP质粒标准品PCR 产物熔解曲线峰值均在88℃, 峰形锐利,说明产物特异。
2.4 各组大鼠中脑CGRP mRNA 表达量
根据标准曲线,计算机可直接计算出各标本模板的CGRP mRNA 初始含量(图2)。各标本PCR 扩增产物熔解曲线峰值也在88℃,说明产物特异。 各组大鼠中脑每250 ng 总RNA 中脑CGRP mRNA 拷贝数分别为(1.13±0.68)×104、(1.61±0.51)×104、(0.80±0.45)×104、(0.75±0.27)×104。 A、B 组大鼠中脑CGRP mRNA拷贝数比较,差异无统计学意义(P >0.05);C、D 组大鼠中脑CGRP mRNA 拷贝数,差异无统计学意义(P >0.05);C、D 组大鼠中脑CGRP mRNA 拷贝数比较,明显低于B 组,差异有统计学意义(P <0.05)。
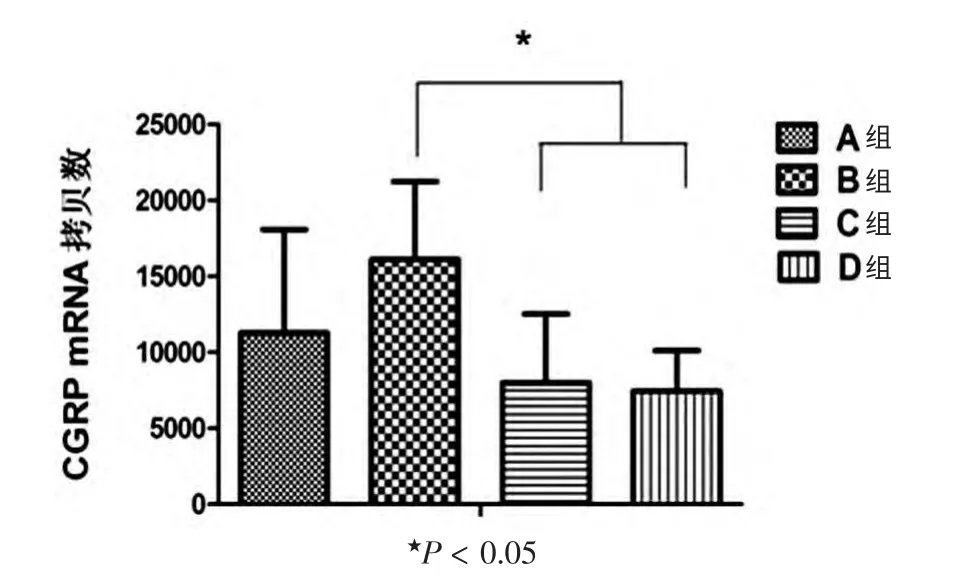
图2 各组大鼠中脑CGRP mRNA 表达情况
3 讨论
头痛宁胶囊由天麻、土茯苓、制何首乌、防风、全蝎、当归六味药材按照GMP 标准严格生产的中成药制剂。 多数单药组分具有镇痛作用,天麻具有镇静、安神、减轻头痛等作用[7]。 动物实验发现,土茯苓能明显提高小鼠的热板痛阈值[8]。 当归的抗氧化和抗自由基效应,起到神经保护的作用[9]。 全蝎中含有的蝎毒多肽具有很强的镇痛作用。 有研究发现:头痛宁胶囊可以上调偏头痛大鼠中脑脑啡肽原mRNA 的表达,进而增加与内源性镇痛直接相关的两种脑啡肽 (甲硫氨酸脑啡肽和亮氨酸脑啡肽)在中脑的含量,说明头痛宁胶囊对内源性痛觉调制系统的功能发挥调节作用[10]。
内源性痛觉调制系统的核心结构是中脑导水管周围灰质(periaqueductal gray,PAG),凡是由激活更高中枢所产生的镇痛效应, 大部分都被证明是通过PAG 才得以实现的, 这充分体现了PAG 在痛觉调制中的重要性[11-12]。 PAG 与延髓头端腹内侧网状结构相连接,调节脊髓背角的痛觉初级传入活动,这一过程通过下行抑制通路得以实现。 CGRP 作为内源性痛觉调制系统中重要的中介物质,参与疼痛与镇痛过程。
本研究以头痛宁胶囊为干预因素,观察其对硝酸甘油型偏头痛大鼠中脑CGRP 表达的影响,进一步观察头痛宁胶囊对内源性痛觉调制系统的调节作用,探讨其治疗偏头痛的中枢机制。本实验建立的检测大鼠CGRP 基因的实时定量PCR 方法,具有很高的敏感性和重复性,使得实验结果精确可靠。实验结果发现:以头痛宁胶囊作为干预因素的偏头痛大鼠, 其中脑CGRP mRNA 表达明显低于偏头痛模型大鼠,说明头痛宁胶囊对偏头痛大鼠中脑CGRP 基因表达具有抑制作用。
CGRP 与偏头痛关系极为密切,在外周,CGRP 是最有效的血管扩张肽[13],CGRP 与位于脑血管平滑肌的CGRP 受体结合导致脑血管异常扩张[14-15],引发头痛。三叉神经血管末梢释放的CGRP 可触发脑膜肥大细胞脱颗粒,进而引发一系列生物学反应,诱发脑膜神经源性炎症[16],导致头痛发生。 除此以外,CGRP 还是三叉神经脊束核中伤害性感受神经元的神经调质[17],传递痛觉信息。 在中脑,CGRP 的主要作用是拮抗内源性阿片肽的镇痛效应[18]。 本研究发现头痛宁胶囊可以下调偏头痛大鼠中脑CGRP 的基因表达,由此认为头痛宁胶囊治疗偏头痛的机制与其抑制中脑CGRP的表达有关。
[1] Seifert F,Kiefer G,DeCol R,et al. Differential endogenous pain modulation in complex-regional pain syndrome [J].Brain,2009,132(Pt3):788-800.
[2] De Santana JM,Sluka KA.Central mechanisms in the maintenance of chronic widespread noninflammatory muscle pain [J]. Curr Pain Headache Rep,2008,12(5):338-343.
[3] 张秀玲.头痛宁胶囊治疗偏头痛120 例临床观察[J].中西医结合心脑血管病杂志,2010,8(7):814-815.
[4] 张颖,缪月琴,王振海.头痛宁胶囊治疗紧张型头痛与偏头痛的疗效观察[J].陕西中医,2010,31(7):845-846.
[5] Tassorelli C,Greco R,Wang D,et al. Nitroglycerin induces hyperalgesia in rats——a time-course study[J].Eur J Pharmacol,2003,464(2-3):159-162.
[6] Yu TM,Yao G,Zhang LP.Magnesium effects on behavior and substance P mRNA expression in the midbrain of a rat migraine model [J]. Neural Regeneration Research,2009,4(11):912-917.
[7] 薛柳华,唐一鹏,孙承琳,等.天麻素对缺血再灌注神经细胞膜的保护作用[J].北京中医药大学学报,1998,21(3):18-21.
[8] 吴丽明,张敏.土茯苓中落新妇甙的利尿和镇痛作用[J].中药材,1995,18(12):627-630.
[9] 巫少荣,李自成,裘汉璋.当归在心血管系统的作用[J].中医药研究,2001,17(3):56-58.
[10] Yao G,Man YH,Qi JJ,et al.Effects of Toutongning capsule on enkephalin in a rat migraine headache model [J].Neural Regeneration Research,2011,6(9):661-665.
[11] Tuveson B,Leffler AS,Hansson P. Influence of heterotopic noxious conditioning stimulation on spontaneous pain and dynamic mechanical allodynia in central poststroke pain patients [J]. Pain,2009,143(1-2):84-91.
[12] Potvin S,Grignon S,Marchand S. Human evidence of a supra-spinal modulating role of dopamine on pain perception [J]. Synapse,2009,63(5):390-402.
[13] Brain SD,Grant AD. Vascular actions of calcitonin generelated peptide and adrenomedullin[J].Physiol Rev,2004,84(3):903-934.
[14] Edvinsson L,Alm R,Shaw D,et al. Effect of the CGRP receptor antagonist BIBN4096BS in human cerebral,coronary and omental arteries and in SK-N-MC cells [J].Eur J Pharmacol,2002,434(1-2):49-53.
[15] Moreno MJ,Abounader R,Hebert E,et al. Efficacy of the non-peptide CGRP receptor antagonist BIBN4096BS in blocking CGRP-induced dilations in human and bovine cerebral arteries:potential implications in acute migraine treatment [J]. Neuropharmacology,2002,42(4):568-576.
[16] Theoharides TC,Donelan J,Kandere-Grzybowska K,et al.The role of mast cells in migraine pathophysiology [J].Brain Res Brain Res Rev,2005,49(1):65-76.
[17] Messlinger K. Migraine:where and how does the pain originate [J]. Exp Brain Res,2009,196(1):179-193.
[18] 谢启文.神经肽[M].上海:复旦大学出版社,2004:7.
