1-MCP处理对鲜切芋艿褐变的影响
2014-01-17谭谊谈曾凯芳
谭谊谈,曾凯芳,2,*
(1.西南大学食品科学学院,重庆 400715;2.农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆 400715)
1-MCP处理对鲜切芋艿褐变的影响
谭谊谈1,曾凯芳1,2,*
(1.西南大学食品科学学院,重庆 400715;2.农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆 400715)
为了延缓鲜切芋艿褐变,延长其货架期,研究4℃贮藏条件下,10 øL/L 1-甲基环丙烯(1-methylcyclopropene,1-MCP)处理对鲜切芋艿色泽和褐变相关指标的影响。结果表明:10 øL/L 1-MCP熏蒸处理能够有效延缓鲜切芋艿贮藏期间L*值下降,降低芋艿苯丙氨酸解氨酶活性和总酚合成速度;延缓芋艿多酚氧化酶和过氧化物酶活性上升,抑制脂氧合酶活性,降低膜质的氧化损伤,进而延缓贮藏鲜切芋艿的褐变。而对照芋艿切片贮藏过程中,褐变底物累积速度加快,相关酶活性迅速上升,细胞膜结构完整性遭到破坏,褐变程度明显高于处理组。
1-甲基环丙烯;鲜切;芋艿;贮藏;褐变
芋艿(Colocasia esculenta Schott)又称为芋头,为天南星科单子叶多年生草本植物,在我国云南、四川、贵州、福建和海南等地均有栽培[1-2]。芋艿富含钙、磷、铁等多种矿质元素以及胡萝卜素、核黄素以及硫胺素等多种维生素[3]。是人类补充膳食营养的良好选择。但芋艿外表的皮毛难以清除,人手接触后会有发痒的感觉,不易为消费者接受[4]。
对芋艿进行最小加工处理或鲜切加工可以充分利用芋艿的营养特性,提高其消费者可接受性[4]。然而去皮产生的机械伤破坏了芋艿细胞结构的完整性,使得位于细胞液泡中的酚类物质外溢,与细胞质膜上的酚酶接触,在氧气的参与下,形成褐色聚合物,最终导致褐变的发生[5],严重影响了芋艿的商品价值。亚硫酸盐处理作为传统的褐变控制方法,已在莲藕[6]、甘薯[7]和双孢蘑菇[8]的保鲜上得到应用,但是近年来亚硫酸盐残留对人体健康和环境污染的影响受到越来越多人的关注[9],亚硫酸盐的使用受到很大的限制[10]。目前对于鲜切芋艿褐变控制方法的研究主要集中在抗坏血酸及其盐类、L-半胱氨酸以及4-己基间苯二酚等[4],这些处理虽然有较好的控制效果,但仍需考虑残留问题,因此需要寻求更加安全的方法以控制鲜切芋艿褐变的发生。
鲜切果蔬由于切分的伤信号会导致乙烯合成速度的加快,乙烯的大量累积加速了果蔬组织代谢进程,加快营养物质的损耗和衰老的发生。同时乙烯可以提高果蔬组织中酚酶的活性,加速贮藏期间褐变的发生[11-12]。1-甲基环丙烯(1-methylcyclopropene,1-MCP)是一种乙烯受体抑制剂,具有操作方便、高效无毒等优点,广泛应用于果蔬采后保鲜[13-15]。1-MCP处理能够抑制桃[16]和枣[17]贮藏期间多酚氧化酶(polyphenol oxidase,PPO)和过氧化物酶(peroxidase,POD)活性,以及西兰花[18]在贮藏期间苯丙氨酸解氨酶(phenylalanineammonia-lyase,PAL)、脂氧合酶(lipoxidase,LOX)的活性,从而延缓鲜切果蔬褐变的发生。然而,对于1-MCP控制鲜切芋艿贮藏期间褐变效果的研究未见报道。故本实验以10 øL/L 1-MCP处理鲜切芋艿,研究其对冷藏期间芋艿褐变的控制效果及机理,以期为鲜切芋艿贮藏中的品质控制提供理论依据。
1 材料与方法
1.1 材料
芋艿购于重庆市北碚区天生农贸市场,品种为魁芋。挑选大小均一、没有病虫害、外观完整无机械伤的芋艿,经清洗之后用灭菌的工具去皮,切分为厚度为0.5 cm大小均一的切片,将切分后的芋艿用消毒过的聚乙烯托盘分装,用于不同处理。
1.2 方法
1.2.1 实验分组
实验处理分组包括:1)对照:4 ℃密闭处理8 h;2) 4 ℃条件下用10 øL/L 1-MCP密闭处理8 h。处理后装有鲜切芋艿片的托盘用0.05 mm厚聚乙烯保鲜膜覆盖包装,贮藏于(4±1) ℃,85%~95%湿度条件下,分别于贮藏第2、4、6、8、10天随机取样进行观察测定。每处理用样500 g,每个实验处理重复3次。
1.2.2 指标测定
1.2.2.1 褐变度和色差值的测定
褐变度测定参考陈功等[19]方法,称取新鲜样品2 g,切碎,研磨后加入质量比1∶10的预冷蒸馏水,在20 ℃条件下、以3 500 r/min离心10 min,取上清液待测。用蒸馏水作为空白对照,测定波长410 nm处的吸光度,以A410nm×10表示褐变度。色差L*值用测色色差计测试。
1.2.2.2 总酚含量的测定
总酚的提取参考Dewanto[20]、Chu[21]等方法并修改:将2 g样品与50 mL冷冻的80%丙酮混合、均质再抽滤,滤液经80%丙酮冲洗后用旋转蒸发仪在45℃条件下旋转蒸发,并用蒸馏水定容到10 mL。总酚含量测定参照Chu等[21]方法。
1.2.2.3 PAL活性的测定
参照Zeng Kaifang[22]、曹健康[23]等的方法:称取2.5 g样品组织,冰浴条件下与5.0 mL提取缓冲液(pH 8.8 50 mmol硼酸缓冲液+5 mmol/L β-巯基乙醇+40 g/L聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP)+2 mmol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA))混合匀浆,在12 000×g、4℃低温离心30 min,取上清液为酶提取液。加入3.4 mL pH 8.8 50 mmol/L硼酸缓冲液、0.5 mL 20 mmol/L L-苯丙氨酸溶液和0.1 mL酶提取液(对照组酶提取液先煮沸8 min),摇匀。在37 ℃条件下保温30 min。保温结束立即向试管加入0.1 mL 6 mol/L盐酸溶液终止反应。测定波长设为290 nm,以蒸馏水为空白调零,分别测定活性管、对照管吸光度(A1和A0)。单位以0.01ΔA290nm/(h•g)表示,即每小时每克鲜质量样品反应体系吸光度增加0.01为一个PAL活性单位(U)。
1.2.2.4 PPO和POD活性的测定
称取1.0 g新鲜样品于研磨中,立即加6 mL 0.1 mol/L磷酸缓冲液(pH 6.8)和0.2 g PVP,冰浴条件下迅速研磨,匀浆液以12 000×g、4℃条件下离心30 min,上清液为酶提取液。PPO活性测定参照Zauberman等[24]的方法并改进。加入2 mL 0.1 mol/L、pH 6.8磷酸缓冲液、0.9 mL 50 mmol/L邻苯二酚和0.1 mL酶提取液。测定室温条件下420 nm波长处,反应液10 min内吸光度的变化。以每分钟吸光度变化0.01为一个酶活力单位(U)。POD活性测定参照Srivastava等[25]的方法并改进。加入2.7 mL pH 6.8 0.1 mol/L的磷酸缓冲液、0.1 mL 4%的愈创木酚、0.1 mL 0.5% H2O2和0.1 mL酶提取液。测定室温条件下于波长470 nm处反应液10 min内吸光度的变化。以每分钟吸光度变化0.01为一个酶活力单位(U)。
1.2.2.5 LOX活性的测定
参照陈松昆等[26-27]测定方法,并有所改进:称取1.0 g样品研钵中,加入5.0 mL提取液,在冰浴条件下研磨匀浆,然后转移至离心管中于4 ℃、12 000×g离心30 min,上清液为酶提取液。在2.775 mL 0.1 mol/L、pH 6.0柠檬酸缓冲液中,加入25 øL亚油酸钠母液,再加入200 øL粗酶液。以蒸馏水为参比调零,在波长234 nm处以15 s吸光度为初始值,然后每隔15 s测定1次,测到反应90 s为止。以每克鲜样每分钟吸光度增加0.01为1个LOX活性单位(U)。
1.2.2.6 电导率的测定
参照曹建康[23]、王国泽[28]等测定方法并进行一定修改。取厚薄均匀大小一致的组织圆片0.5 g,用20 mL去离子水的烧杯振荡10 min后,再用去离子水清洗3次并用滤纸片吸干圆片上的水分。再准确加入20 mL去离子水,放入振荡器中振动1 h,于20~25 ℃恒温条件下,用电导率测定仪测定溶液电导率(L1)。将试管煮沸10 min,冷却后再次测定提取液的电导率(L0)。细胞膜相对电导率按下式计算:
细胞膜相对电导率/%=L1/L0×100
2 结果与分析
2.1 1-MCP处理对鲜切芋艿褐变状态的影响
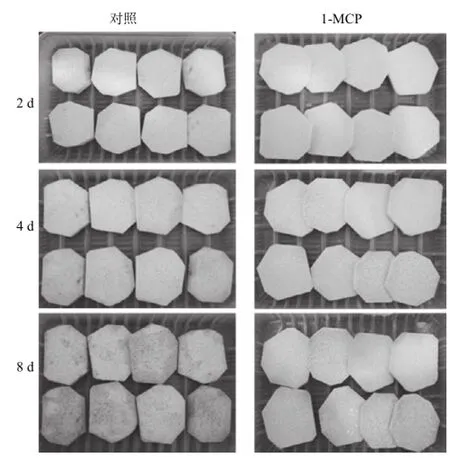
图1 1-MCP处理对贮藏期间鲜切芋艿褐变状态的影响Fig.1 Effect of 1-MCP treatment on browning of fresh-cut taro during storage
由图1可知,在贮藏过程中,鲜切芋艿由白色转变成深黄色(图中显示为灰色),最后变成褐色甚至黑色。与对照相比,1-MCP处理明显减缓了鲜切芋艿的褐变进程。褐变度能够反映果实的褐变程度,是酚类物质被酚酶所氧化形成褐色聚合物的表现[5]。
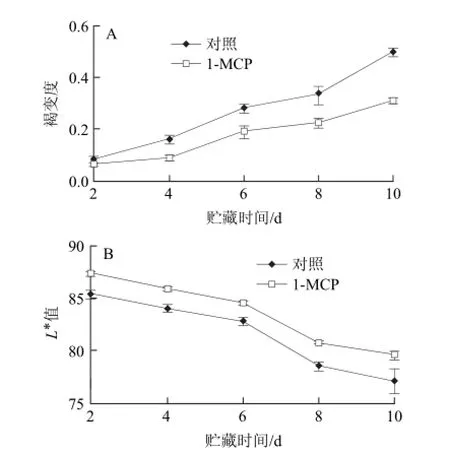
图2 1-MCP处理对鲜切芋艿褐变度(A)和L*值(B)的影响Fig.2 Effect of 1-MCP treatment on browning rate and L* value of fresh-cut taro
图2 A表明,鲜切芋艿的褐变度在贮藏期间呈现 不断上升的趋势,10 øL/L 1-MCP处理能够控制芋艿褐变度的上升,在贮藏第8天,1-MCP处理组的褐变度仅为对照组的67.9%。这与公谱[29]的研究结果一致。
L*表示亮度,可以间接反映出鲜切芋艿酶促褐变的程度[13]。图2B表明,贮藏期间鲜切芋艿的L*值呈现逐渐下降的趋势,贮藏第6天起L*值的下降速度加快,而10 øL/L 1-MCP处理显著延缓了鲜切芋艿L*值的下降。
2.2 1-MCP处理对鲜切芋艿PAL活性和总酚含量的影响
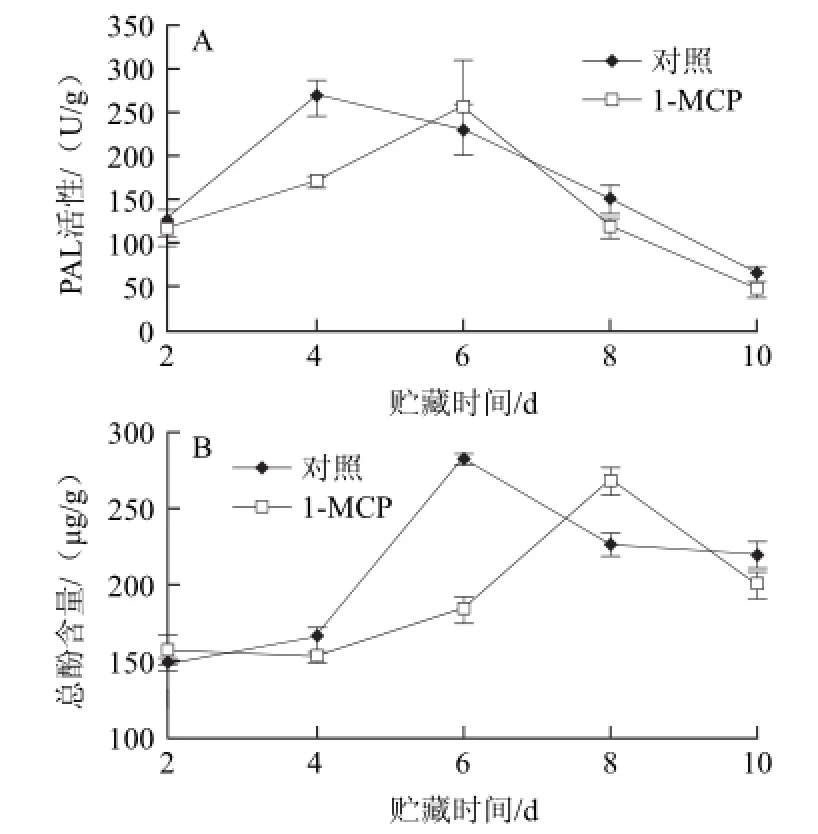
图3 1-MCP处理对鲜切芋艿PAL活性(A)和总酚含量(B)的影响Fig.3 Effect of 1-MCP treatment on PAL activity and total phenol content of fresh-cut taro
PAL是苯丙氨酸代谢途径中的第一个酶,能够分解苯丙氨酸经过一系列反应合成酚酶氧化底物酚类和类黄酮[30]。图3A表明,贮藏初期,鲜切芋艿PAL活性呈急剧上升趋势,对照组在贮藏第4天时,PAL活性即达到高峰,1-MCP处理组的PAL活性高峰出现在贮藏第6天,随后呈下降趋势。贮藏第4天时,对照组PAL活性比1-MCP处理组高36.5%。图3B表明,贮藏期间鲜切芋艿总酚含量呈现先升高后降低的趋势,对照组在贮藏第6天时,总酚含量达到高峰,1-MCP处理组芋艿在贮藏第8天时出现总酚含量的高峰。以上结果表明,1-MCP处理能够延缓鲜切芋艿PAL活性峰值的出现,抑制鲜切芋艿PAL的活性,从而延缓总酚含量升高的趋势,抑制酶促褐变的发生,这与郭香凤[30]、杨卫东[31]等的研究结论一致。
2.3 1-MCP处理对鲜切芋艿POD和PPO活性的影响
POD和PPO是引起鲜切果蔬酶促褐变的主要酶类,PPO通过氧化多酚和类黄酮产生褐色聚合物引起酶促褐变,而POD在H2O2存在的条件下能够氧化酚类物质形成褐色聚合物产生褐变[5]。鲜切果蔬由于机械伤的作用导致了POD和PPO活性升高,此时酚类物质和酚酶区域划分部被破坏,酚类与POD、PPO相结合导致褐变的发生[32]。图4表明,POD和PPO活性从贮藏第4天开始快速上升,对照组POD和PPO活性高峰出现在贮藏第6天,而1-MCP处理能够降低同期酶活性,并延缓POD活性高峰出现时间。从贮藏第6天开始,1-MCP处理组POD活性与对照组差异极显著(P<0.01)。以上结果表明1-MCP处理能够有效抑制鲜切芋艿贮藏期间POD、PPO的活性并延缓其活性高峰的到来,因此,延缓了鲜切芋艿的褐变进程。
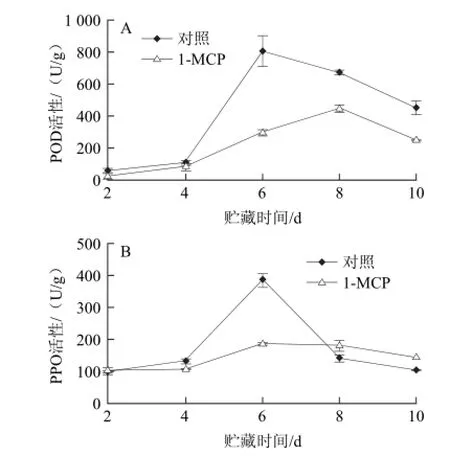
图4 1-MCP处理对鲜切芋艿POD(A)和PPO活性(B)的影响Fig.4 Effect of 1-MCP treatment on POD and PPO activities of fresh-cut taro
2.4 1-MCP处理对鲜切芋艿LOX活性和相对电导率的影响
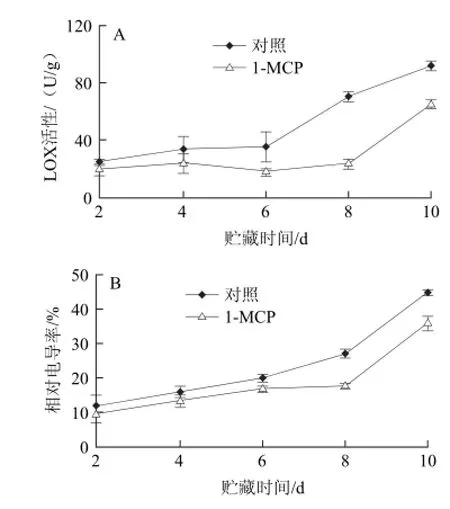
图5 1-MCP处理对鲜切芋艿LOX活性(A)和相对电导率(B)的影响Fig.5 Effect of 1-MCP treatment on LOX activity and conductivity of fresh-cut taro
LOX能专一催化含顺,顺-1,4-戊二烯结构的不饱和脂肪酸,引发植物细胞的膜脂过氧化,破坏细胞结构。在切分机械伤的伤信号激活下,LOX活性上升,导致膜脂过氧化的加剧,促使酚酶与底物的结合加速酶促反应[33]。在鲜切芋艿贮藏过程中,LOX活性呈现逐渐升高的趋势,对照组从贮藏第6天开始,LOX活性上升速率急剧增加,1-MCP处理组的LOX活性上升速度显著低于对照组。在贮藏第6、8、10天时,1-MCP处理组的LOX活性比对照组分别降低了48.8%、66%和28.6%。
电导率是描述鲜切果蔬细胞完整性的一个重要指标,贮藏期间电导率的升高反映了果蔬细胞膜脂过氧化的加剧和细胞衰老程度的上升[34]。实验结果表明,随着贮藏时间的延长,鲜切芋艿的相对电导率呈现逐渐上升趋势,1-MCP处理能够显著抑制鲜切芋艿相对电导率的上升,能够有效保持贮藏期间细胞结构的完整性,从而延缓了鲜切芋艿组织的衰老和酶促褐变的发生。1-MCP的这种作用在细胞超微结构的观察实验中也得到了验证[35]。
3 结 论
3.1 10 øL/L的1-MCP处理降低了芋艿贮藏期间PAL、LOX活性和总酚合成速度。
3.2 1-MCP处理能够显著降低鲜切芋艿贮藏过程中PPO和POD活性,延缓酚类氧化速度,抑制褐变的发生。
3.3 通过降低褐变底物合成速度和保持细胞膜脂结构完整性以及钝化褐变相关酶活性,1-MCP处理延缓了鲜切芋艿贮藏期间褐变度的上升和L*值的下降,从而达到控制鲜切芋艿贮藏期间褐变、提高贮藏品质的效果。
[1] 吴征镒. 中国种子植物属的分布区类型[J]. 云南植物研究, 1991(增刊Ⅳ): 18-126.
[2] 李恒. 天南星科的生态地理和起源[J]. 云南植物研究, 1986, 8(4): 363-381.
[3] NGUYEN V X, YOSHINO H, TAHARA M. Phylogenetic analyses of Taro (Colocasia esculenta (L.) Schutt) and related species based on esterase isozymes[J]. Scientific Reports of the Faculty of Agriculture Okayama University, 1998, 87: 133-139.
[4] 果雅凝. 鲜切芋艿褐变控制技术的初步研究[D]. 上海: 上海水产大学, 2006.
[5] 程双, 胡文忠, 马跃, 等. 鲜切果蔬酶促褐变机理及控制研究进展[J].食品与机械, 2009, 25(4): 173-176.
[6] 王向阳, 姜丽佳, 王忠英. 莲藕的酶促褐变及其贮藏中褐变的控制[J]. 农业工程学报, 2009, 25(4): 276-280.
[7] 郁志芳, 夏志华, 陆兆新, 等. 鲜切甘薯高效化学褐变抑制剂组合的筛选[J]. 食品科学, 2003, 24(11): 31-34.
[8] 王相友, 石启龙, 王娟, 等. 双孢蘑菇护色保鲜技术研究[J]. 农业工程学报, 2004, 20(6): 205-208.
[9] REIST M, JENNER P, HALLIWELL B. Sulphite enhances peroxynitrite-dependent alpha1-antiproteinase inactivation. A mechanism of lung injury by sulphur dioxide[J]. FEBS Letters, 1998, 423(2): 231-234.
[10] GB 2760—2011 食品添加剂使用卫生标准[S].
[11] SISLER E C, SEREK M. Inhibitors of ethylene responses in plants at the receptor level: recent developments[J]. Physiologia Plantarum, 1997, 100(3): 577-582.
[12] PORAT R, WEISS B, COHEN L, et al. Effects of ethylene and 1-methylcyclopropene on the postharvest qualities of ‘Shamouti’oranges[J]. Postharvest Biology and Technology, 1999, 15(2): 155-163.
[13] 朱学坤. 1-MCP和热处理对鲜切油菜贮藏品质的影响[D]. 重庆: 西南大学, 2012
[14] FAN X, ARGENTA L, MATTHEIS J P. Interactive effects of 1-MCP and temperature on ‘Elberta’ peach quality[J]. HortScience, 2002, 37: 134-138.
[15] SALTVEIT M E. Effect of 1-methylcyclopropene on phenylpropanoid metabolism, the accumulation of phenolic compounds, and browning of whole and fresh-cut ‘iceberg’ lettuce[J]. Postharvest Biology and Technology, 2004, 34(1): 75-80.
[16] ZHOU Ran, ZHANG Guixiang, HU Yunsheng, et al. Reductions in flesh discolouration and internal morphological changes in Nanhui peaches (Prunus persica (L.) Batsch, cv. Nanhui) by electrolysed water and 1-methylcyclopropene treatment during refrigerated storage[J]. Food Chemistry, 2012, 135(13): 985-992.
[17] ZHANG Zhanquan, TIAN Shiping, ZHU Zhu, et al. Effects of 1-methyl cyclopropene (1-MCP) on ripening and resistance of jujube (Zizyphus jujube cv. Huping) fruit against postharvest disease[J]. Food Science and Technology, 2012, 45(1): 13-19.
[18] YUAN Gaofeng, SUN Bo, YUAN Jing, et al. Effect of 1-methylcyclopropene on shelf life, visual quality, antioxidant enzymes and health-promoting compounds in broccoli florets[J]. Food Chemistry, 2010, 118(3): 774-781.
[19] 陈功, 余文华, 李洁芝, 等. 净菜莲藕加工关键技术研究[J]. 四川食品与发酵, 2007, 43(2): 56-59.
[20] DEWANTO V, WU X, ADOM K K, et al. Thermal processing enhances the nutritional value of tomatoes by increasing total antioxidant activity[J]. Journal of Agricultural and Food Chemistry, 2002, 50: 3010-3014.
[21] CHU Y F, SUN J, WU X Z, et al. Antioxidant and antiproliferative activities of co mmon vegetables[J]. Journal of Agricultural and Food Chemistry, 2002, 50(23): 6910-6916.
[22] ZENG Kaifang, CAO Jiankang, JIANG Weibo. Enhancing disease resis-tance in harvested mango (Mangifera indica L. cv. Matisu) fruit by salicylic acid[J]. Journal of the Science of Food and Agriculture, 2006, 86(5): 694-698.
[23] 曹健康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007: 142-144.
[24] ZAUBERMAN G, FUCHS Y, ROT I. Chilling injury peroxidase and cellulase activities in the peel of mango fiurt at low temperature[J]. Journal of Horticultural Science & Biotechnology, 1998, 23(4): 732-733.
[25] SRIVASTAVA M K, DWIVED U N. Delayed ripening of banana fruit by salicylic acid[J]. Plant Science, 2000, 158(l/2): 87-96.
[26] 陈昆松, 徐昌杰, 楼健. 脂氧合酶与猕猴桃果实后熟软化的关系[J].植物生理学报, 1999, 25(2): 138-144.
[27] 陈昆松, 徐昌杰, 许文平. 猕猴桃和桃果实脂氧合酶活性测定方法的建立[J]. 果树学报, 2003, 20(6): 436-438.
[28] 王国泽. 磷脂酶D感应和接受低温胁迫的功能及在黄瓜冷害中的作用[D]. 杭州: 浙江大学, 2006.
[29] 公谱. 采收成熟度和1-MCP处理对冷藏晚香蕉李果实品质和褐变的影响[D]. 沈阳: 沈阳农业大学, 2010.
[30] 郭香凤, 梁华, 赵胜娟, 等. 1-MCP对杏果实采后贮藏品质的影响[J].农业机械学报, 2006, 37(8): 107-110.
[31] 杨卫东, 李江阔, 张平, 等. 1-MCP处理对贮前预熟南果梨货架期间果实衰老的影响[J]. 华北农学报, 2010, 25(2): 164-167.
[32] MAYER A M, HAREL E. Polyphenol oxidases in plants[J]. Phytochemistry, 1979, 18(2): 193-215.
[33] 谭谊谈, 曾凯芳. 鲜切果蔬酶促褐变关键酶研究进展[J]. 食品科学, 2010, 32(17): 376-379.
[34] 汪开拓, 郑永华. 热处理对杨梅果实细胞膜组成及衰老的影响[J].西南农业学报, 2011, 24(2): 691-694.
Effect of 1-MCP Treatment on Browning of Fresh-Cut Taro
TAN Yi-tan1, ZENG Kai-fang1,2,*
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. Laboratory of Quality and Safety Risk Assessment for Agro-products on Storage and Presevation (Chongqing), Ministry of Agriculture, Chongqing 400715, China)
In order to control the browning of fresh-cut taro and extend its shelf life, the effect of 10 μL/L 1-methylcyclopropene (1-MCP) treatment on the color and browning of taro during storage at 4 ℃ was studied. Results showed that 10 μL/L 1-MCP treatment could delay the decrease of L* and inhibit the increases of phenylalanineammonialyase (PAL), polyphenol oxidase (PPO), peroxidase (POD) and lipoxidase (LOX) activities and the accumulation of total phenols, therefore inhibiting the browning of fresh-cut taro. However, control samples indicated accelerated accumulation of browning substrates and a prompt increase in the activities of browning-related enzymes. Moreover, the completeness of the cell membrane was damaged and a significantly higher degree of browning was observed.
1-methylcyclopropene (1-MCP); fresh-cut; taro; storage; browning
TS255.3
A
1002-6630(2014)02-0305-05
10.7506/spkx1002-6630-201402060
2013-06-08
重庆市自然科学基金资助项目(CSTC2011BB1014)
谭谊谈(1987—),男,硕士研究生,研究方向为农产品加工与贮藏工程。E-mail:tytkevin@163.com
*通信作者:曾凯芳(1972—),女,教授,博士,研究方向为农产品加工与贮藏工程。E-mail:zengkaifang@163.com
