超临界CO2萃取灵芝孢子油及其挥发性成分分析
2014-01-30高宇杰赵立艳安辛欣杨文建胡秋辉
高宇杰,赵立艳,安辛欣,杨文建,方 勇,马 宁,胡秋辉,★
(1.南京财经大学食品科学与工程学院,江苏 南京 210023;2.南京农业大学食品科技学院,江苏 南京 210095)
灵芝孢子(Ganoderma lucidumspore) 是我国著名药用真菌灵芝的有性生殖细胞,灵芝孢子及其提取物具有免疫调节、抗肿瘤、抗氧化、抗衰老、保护神经系统、降血脂、护肝等功能,近年来因其具有比灵芝更强的药理活性而成为国内外学者研究和开发的热点[1-2]。破壁灵芝孢子粉含油量达20%~30%,从中提取的脂质成分即为灵芝孢子油,集中了孢子粉中三萜类化合物、不饱和脂肪酸、甾醇、维生素、挥发油等活性成分;其中不饱和脂肪酸含量大于60%[3],以油酸、亚油酸为主并含有多种奇数碳脂肪酸[4],三萜类化合物药理活性强[5],也是灵芝孢子油中的主要活性成分。植物中挥发性物质不仅决定了其特征性气味,部分挥发性成分还具有一定的保健功能,陈体强等[6]将灵芝孢子油不经衍生化直接通过气相色谱-质谱(gas chromatography-mass spectrometry,GCMS)分析,发现灵芝孢子油中含有萜类等挥发性成分,但未报道相对含量。随着人工栽培灵芝技术的日趋成熟,我国灵芝孢子粉的产量逐年增加,已成为全球最大的灵芝孢子粉产地[7],因此研究孢子粉中油脂的提取工艺及其挥发性物质组成具有重要的理论和实际意义。
超临界CO2萃取技术具有操作温度较低有效保护热敏的活性物质,操作简单萃取效率高,能耗低对环境无污染等优点,已被广泛应用于油脂及三萜等功能性成分的制备[8-9]。Khattab等[10]比较了不同萃取方法对亚麻籽油品质和油脂组成的影响,结果表明超临界CO2萃取油脂得率显著低于快速溶剂提取和传统溶剂提取法,但亚麻籽油品质和化学组成上却显著好于其他方法,熔点和过氧化值较低,碘值、多不饱和脂肪酸和酚酸含量较高,木酚素仅在超临界CO2萃取油脂中检测到。前人多以灵芝孢子油脂得率为考察指标优化超临界CO2萃取灵芝孢子油工艺条件,且优化出的萃取分离条件、油脂得率差异较大,如朱坚等[11]在14MPa、34℃、270min下获得了较高的萃取率34.41%,毛方华等[12]通过响应面法优化得到工艺条件为:萃取压力29MPa、萃取温度35℃、萃取时间3.5h、CO2流量20L/h,最优条件下灵芝孢子油脂得率为26.13%,提取率达到99%。灵芝孢子油与其他功能油脂的主要区别是富含活性成分三萜类化合物,但关于萃取分离条件对灵芝孢子油中三萜类化合物得率的影响研究较少。
近年来国内外研究主要集中在灵芝子实体、菌丝体及其孢子活性成分定性定量[13]、药理活性等方面,对灵芝相关产品挥发性物质关注较少。顶空固相微萃取(headspace solid-phase microextration,HS-SPME)结合气相色谱-质谱(gas chromatography -mass spectrometry,GC-MS),是一种新型样品采集方法,已广泛应用于食品挥发性风味物质鉴定领域,具有样品用量少、不使用有机溶剂、萃取效率高、操作简单、选择性强、重现性好等特点[14]。本研究采用超临界CO2萃取灵芝孢子油,以油脂得率和三萜类化合物得率为考察指标,通过单因素、正交试验优化超临界CO2萃取灵芝孢子油的重要工艺参数,拟获得三萜类化合物含量高、油脂得率较高的工艺条件;采用HS-SPME-GC-MS全面分析超临界CO2萃取的灵芝孢子油中的挥发性物质组成,进一步探讨灵芝孢子油中特征性挥发物质,为工业生产和进一步深入研究提供理论依据。
1 材料与方法
1.1 材料与试剂
破壁赤芝孢子粉(真空包装,破壁率>85%) 四川省农科院土壤肥料研究所;CO2(食品级,纯度>99%)江苏南通华安超临界萃取有限公司;乙酸乙酯、冰乙酸、石油醚(沸程:30~60℃)、浓硫酸、高氯酸均为分析纯 南京化学试剂有限公司;香草醛、熊果酸标准品(纯度98%) 阿拉丁试剂(上海)有限公司。
1.2 仪器与设备
HA121-50-01超临界萃取装置 江苏南通华安超临界萃取有限公司;101-3AS电热鼓风干燥箱 上海苏进仪器设备厂;TE214S电子分析天平 赛多利斯科学仪器有限公司;7890A/5975C气相色谱-质谱联用仪 美国Agilent公司;固相微萃取手动进样手柄、固相微萃取头(50/30 μm DVB/CAR/PDMS)美国Supelco公司;20mL SPME顶空瓶 南京大沪科技仪器有限公司;HH-2数显恒温水浴锅 常州国华电器有限公司;UV1100紫外-可见分光光度计上海美谱达仪器有限公司;硅胶G板(10cm×20cm×0.25 cm)青岛海洋化工厂。
1.3 方法
1.3.1 超临界CO2萃取灵芝孢子油工艺流程
破壁灵芝孢子粉(破壁后室温下放置15d)45℃烘干12h后置于1L萃取釜中,设定仪器参数,循环萃取一定时间后收集分离釜Ⅰ、Ⅱ中油脂去杂质干燥后合并称质量。

1.3.2 灵芝孢子油总三萜化合物含量测定
参照王江海等[15]的薄层色谱-光度法进行测定。
标准曲线的制作:精确称量熊果酸对照品10.0mg置于100mL容量瓶中,乙酸乙酯超声溶解10min,稀释至刻度线,摇匀,制成0.1mg/mL的标准液。分别吸取0.00、0.20、0.40、0.60、0.80、1.00、1.20、1.40 mL对照品溶液于10mL试管中,于100℃水浴上蒸干后,加入新制0.40mL 5%香草醛-冰乙酸溶液和1.00mL高氯酸,摇均,在60℃水浴中加热15min后移入冰水浴中冷却3min,再加入5.00mL冰醋酸,摇匀并置于室温。15min后用分光光度计于548nm波长下测定对照品溶液的吸光度。以熊果酸质量浓度为横坐标、吸光度为纵坐标绘制标准曲线。
灵芝孢子油中三萜类化合物含量测定:称取一定量样品,溶于少量乙酸乙酯中,用微量取样器吸取样品溶液5μL在经过活化的硅胶板上点样,以熊果酸标准品作参比,用石油醚-乙酸乙酯(95∶5,V/V)展开;展开后挥干溶剂,刮取迁移率值0~0.6部分,用乙酸乙酯提取,提取液置于10mL具塞试管;在100℃水浴上蒸干,加入新制0.40mL 5%香草醛-冰醋酸溶液和1.00mL高氯酸,摇均,在60℃水浴中加热15min后移入冰水浴中冷却3min,再加入5.00mL冰醋酸,摇匀并置于室温。15min后用分光光度计于548nm波长下测定样品溶液的吸光度,根据标准曲线计算灵芝孢子油中的三萜类化合物含量。
三萜类化合物得率/(g/kg)=灵芝孢子油脂得率/%×灵芝孢子油中三萜类化合物含量/(g/kg)
1.3.3 超临界CO2萃取灵芝孢子油条件优化
单因素试验:固定投料量100g、CO2流量20L/h、萃取时间2h、分离釜Ⅱ压力、温度和储罐一致分别为4MPa、36℃,考察萃取压力、萃取温度、分离釜Ⅰ压力、分离釜Ⅰ温度对灵芝孢子油脂得率的影响。正交试验:根据单因素研究的基础上,以油脂得率和三萜类化合物得率为指标,进一步优化萃取和分离条件,确定最佳工艺组合并进行方差分析,在最优条件下进行灵芝孢子油萃取验证实验,重复3次取平均值。
1.3.4 顶空固相微萃取
在最优萃取条件下制备灵芝孢子油,萃取后立即进行挥发性成分测定;顶空固相微萃取参数根据本实验前期研究结果进行。将固相微萃取萃取头在气质联用仪的进样口250℃老化30min,称取2.0g灵芝孢子油置于20mL SPME顶空瓶中,盖好瓶盖,然后将顶空瓶放入70℃恒温水浴装置中,将老化好的萃取头插入SPME样品瓶,顶空萃取40min,然后将固相微萃取装置插入GC-MS进样口,推出萃取头,于250℃解吸5min,启动仪器进行GC-MS检测。
1.3.5 GC-MS分析条件
GC条件:色谱柱:HP-5MS 5%苯基甲基氧化硅(30m×0.25mm,0.25μm)弹性石英毛细管色谱柱;升温程序:进样口温度250℃,初始柱温40℃,保持3min,以7℃/min升至120 ℃,保持3min,再以10℃/min升至230℃,保持5min;载气为高纯度氦气(99.99%),流速1mL/min;不分流,进样量1μL。
MS条件:电子电离(electron ionization,EI)源;电子能量70eV;离子源温度230℃;四极杆温度150℃;传输线温度280℃;全谱扫描,质量扫描范围:m/z30~550。
1.3.6 化合物鉴定
采用计算机检索各峰相应的质谱图与NIST08.L、RTLPEST3.L标准质谱数据库匹配,筛选匹配度大于80%化合物,结合人工解析和相关文献报道鉴定化合物,成分定量分析采用峰面积归一化法。
2 结果与分析
2.1 单因素试验
2.1.1 萃取压力对油脂得率的影响
设定萃取温度40℃、分离釜Ⅰ压力10MPa、分离釜Ⅰ温度56℃,考察萃取压力对油脂得率的影响,结果见图1a。可以看出随着萃取压力增大灵芝孢子油脂得率增加,在35MPa时油脂得率最大。萃取压力是影响超临界流体萃取效果的重要参数,相同温度条件下,超临界流体的密度随着压力的增加而增大,进而提高了超临界流体的溶解度;压力的增加还会减少传质阻力,有利于目标成分的萃取,但压力增加到一定程度后,超临界流体的可压缩性小,油脂得率增加缓慢,同时考虑设备成本和安全因素(设备最大压力35MPa),选择30MPa进行进一步研究。
2.1.2 萃取温度对油脂得率的影响
设定萃取压力30MPa、分离釜Ⅰ压力10MPa、分离釜Ⅰ温度56℃,考察萃取温度对油脂得率的影响,结果见图1b。可以看出,45℃时灵芝孢子油脂得率最大,温度低于45℃时,随着萃取温度的升高灵芝孢子油脂得率增加;温度高于45℃时,灵芝孢子油脂得率随着温度升高而下降。温度对超临界流体密度的影响复杂,一方面,温度升高提高了溶剂的挥发度和扩散系数,使超临界流体的溶解度提高,萃取效果提高;另一方面,温度升高使流体的密度下降,导致溶解能力下降,降低提取效果[16]。因此选择45℃进行进一步研究。
2.1.3 分离釜Ⅰ压力对油脂得率的影响
设定萃取压力30MPa、萃取温度45℃、分离釜Ⅰ温度56℃,考察分离釜Ⅰ压力对油脂得率的影响,结果见图1c。可以看出分离釜Ⅰ压力大于9MPa时油脂得率逐渐下降、9MPa时油脂得率最高;适当的分离釜Ⅰ压力有利于油脂完全析出且与杂质有效分离,因此选择分离釜Ⅰ压力9MPa进行进一步研究。
2.1.4 分离釜Ⅰ温度对油脂得率的影响
设定萃取压力30MPa、萃取温度45℃、分离釜Ⅰ压力9MPa,考察分离釜Ⅰ温度对油脂得率的影响,结果见图1d。可以看出48℃时油脂得率最低,56℃时油脂得率最高,60℃时油脂得率下降;在9MPa较低压力下温度升高使CO2溶解度进一步下降,促进油脂析出,但温度过高油脂中杂质含量增多影响油脂品质,因此选择分离釜Ⅰ适宜温度为56℃。

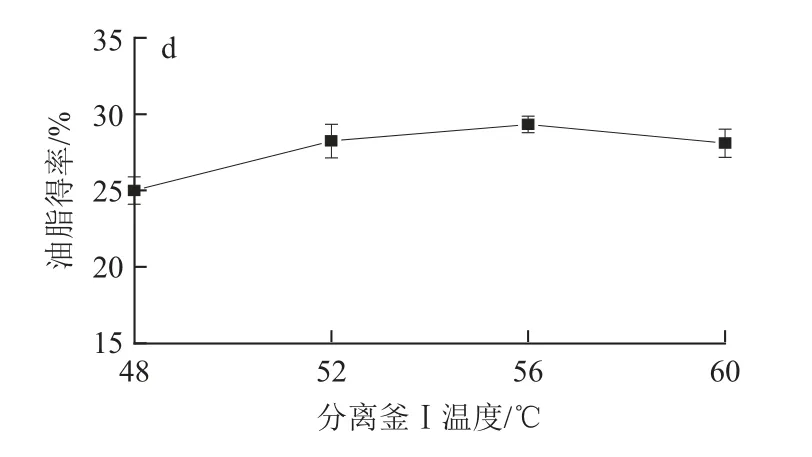
图1 萃取压力(a)、萃取温度(b)、分离釜Ⅰ压力(c)、分离釜Ⅰ温度(d)分别对灵芝孢子油脂得率的影响Fig.1 Effects of extraction pressure (a), extraction temperatur e (b),separation Ⅰpressure (c) and separation Ⅰtemperature (d) on the oil yield from Ganoderma lucidum spore
2.2 正交试验结果
根据单因素试验结果,选取L9(34)正交表进行正交试验,结果与分析见表1。由表1极差直观分析,各因素对油脂得率和三萜类化合物得率影响程度均为萃取压力>萃取温度>分离釜Ⅰ温度>分离釜Ⅰ压力。以油脂得率为指标,综合各因素k值得出A3B1C1D2为最佳工艺组合;以三萜类化合物得率为指标,最佳工艺组合为A2B1C1D2,二者仅萃取压力不同,综合考虑选择A2B1C1D2组合,即萃取压力30MPa、萃取温度40℃、分离釜Ⅰ压力8MPa、分离釜Ⅰ温度56℃。A2B1C1D2组合未出现在正交表中,经验证在最优组合条件下,灵芝孢子油的得率为29.45%,三萜类化合物得率为38.14 g/kg。

表1 LL9(34)正交试验数据结果Table 1 Orthogonal array design matrix and experimental results
采用超临界CO2萃取油脂得率常低于传统溶剂法[10,17],超临界CO2萃取法优点是提取效率高、油脂品质好。灵芝孢子油是珍贵的菌物油脂,灵芝三萜类化合物是除灵芝多糖外最主要的活性成分,超临界状态的CO2对被萃取物具有一定的选择性,不同超临界CO2萃取条件下得到的产物有一定的差异[18],由表1可见,三萜类化合物含量并未随着油脂得率增加而增加,高压下三萜类化合物得率有所下降。通过方差分析,以油脂得率和三萜类化合物为指标,萃取压力、萃取温度F比值均大于F临界值(P≤0.05),表明萃取压力、萃取温度对结果影响显著;分离釜Ⅰ压力、温度F比值均小于F临界值(P≤0.05),表明分离釜Ⅰ压力和温度对结果影响较小,分离釜Ⅰ、Ⅱ压力温度不同,主要影响产物在两萃取釜中的分配情况,分离釜Ⅰ压力较高时,水、游离脂肪酸、杂质等主要在萃取釜Ⅱ中分离得到。
2.3 灵芝孢子油挥发性化合物组成及含量分析
经超临界CO2萃取的灵芝孢子油色泽金黄、具有清香气味,经HS-SPME-GC-MS分析,挥发性成分离子流图见图2(主要10种化合物峰号已标注),通过计算机检索,扣除顶空瓶中不加样品时出现的杂质峰,共检出鉴定65种化合物,占总峰面积83.87%,定性定量结果见表2。由表2可见,灵芝孢子油中挥发性成分可分为7类物质,主要有烃类31种、醇类12种、醛类9种、酯类5种,此外还包括酚类、酮类各1种,杂环化合物2种,其他化合物4种。相对含量最高的为醇类,占总挥发性成分的38.36%,其次为烃类,占29.54%;其他依次为醛类占8.90%、酯类占2.76%,其他类化合物相对含量较低。
顶空固相微萃取在挥发性成分提取分析方面应用广泛,谢婧等[19]采用水蒸气蒸馏法、超临界流体萃取法和顶空固相微萃取法萃取菜籽油挥发性风味成分,结果表明顶空固相微萃取在总峰个数、总峰面积和主峰面积方面均优于其他两种方法。本研究所使用DVB/CAR/PDMS萃取头对极性和非极性物质都具有一定的吸附能力,较田光辉等[20]研究相比,采用HS-SPME提取灵芝孢子油中的挥发性成分比灵芝和灵芝菌丝体挥发油成分复杂的多。其中1-甲基萘、苯乙醇、辛醛、壬醛、苯甲醛、苯甲酸乙酯、棕榈酸乙酯7种物质在灵芝菌丝体挥发性物质中均被检测到[21],但相对含量差异较大。
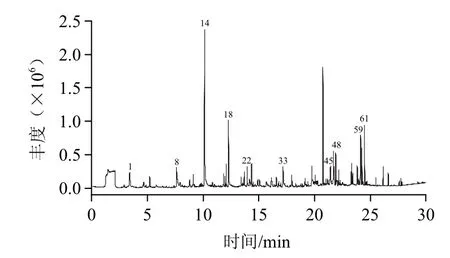
图2 灵芝孢子油中挥发性化合物总离子流图Fig.2 TIC profile of volatile compounds in Ganoderma lucidum spore oil

表2 灵芝孢子油中挥发性物质组成及相对含量Table 2 Composition of volatile compounds in Ganoderma luciidduumm spore oil and their relative contents
灵芝孢子油挥发性成分中烃类物质种类最多,烃类物质中又可分为烷类、萜烯、芳香烃类化合物等。烷类化合物阈值较高,一般认为对食品气味贡献较小。萜烯类化合物是植物挥发油重要组成成分,阈值低为呈香物质,常作为药物和香料的成分,对灵芝孢子油气味有一定贡献。灵芝孢子油挥发性成分中分离出7种萜烯类化合物,占总峰面积6.64%,其中含量较高的为花侧柏烯(2.17%)和β-花柏烯(1.97%),花侧柏烯和β-花柏烯为倍半萜类化合物,在食用菌竹荪[22]和五味子挥发油[23]中均检测到,金针菇培养基中发现的花侧柏烯[24]还具有一定的抑菌作用。芳香烃类化合物共分离10种,占总峰面积的10.43%,相对含量较高的为对二甲苯(2.85%)和萘(1.85%),对二甲苯具有水果甜香气味,萘具有香樟木气味也是亚麻籽油调和油风味物质重要组成成分[25]。
醇类是灵芝孢子油中相对含量最高的组分,灵芝菌丝体中主要挥发性物质也为醇类化合物[21],不饱和醇类阈值较低,对灵芝孢子油气味有较大的贡献,苯甲醇(16.35%)和苯乙醇(5.74%)含量最高,也是总挥发物中相对含量最高的物质,苯甲醇、苯乙醇表现柔和的花香气味,是姬松茸子实体和菌丝体的主要挥发性风味物质[26]。其他相对含量较高的醇类依次为八氢-α,α,4α,-四甲基-2-萘甲醇(3.08%)、α-红没药醇(3.32%)和肉桂醇(2.60%),α-红没药醇香气清淡愉快,具有广谱的抗菌消炎作用[27],肉桂醇具有类似风信子香气。
醛类是脂肪氧化产生的特征挥发性物质,阈值低对气味贡献大。灵芝孢子油挥发醛中苯甲醛含量最高(2.57%),辛醛、壬醛、癸醛等为脂肪的氧化分解产物,含量相对较低。苯甲醛具有苦杏仁味,在褐黄牛杆菌[28]、姬松茸[26]等食用菌中为主要呈香物质。辛醛、壬醛、癸醛具有清香、脂类风味;肉桂醛、香草醛、胡椒醛等都是重要的香料。灵芝孢子油挥发性成分中酯类化合物、酮类、酚类及其他化合物所占的比例相对较小,可能对灵芝孢子油气味贡献较小。
灵芝孢子油挥发性成分中烃类物质种类最多,烃类物质中又可分为烷类、萜烯、芳香烃类化合物等。烷类
3 结 论
超临界CO2萃取灵芝孢子油的最佳工艺条件为萃取压力30MPa、萃取温度40℃、分离釜Ⅰ压力8MPa、分离釜Ⅰ温度56℃;此条件下灵芝孢子油得率为29.45%,三萜类化合物得率为38.14g/kg。萃取压力和温度对三萜类化合物得率影响显著,分离釜Ⅰ压力、温度对萃取结果影响较小,不显著。
HS-SPME-GC-MS对灵芝孢子油中挥发性成分分离效果较好,共鉴定65种化合物,主要为烃类、醇类、醛类和酯类化合物;其中醇类、萜烯、芳香烃和醛类化合物为主要气味贡献物质,协同构成了灵芝孢子油的气味。苯甲醇、苯乙醇相对含量最高,分别为16.35%、5.74%,初步判断为灵芝孢子油特征性挥发性化合物。
[1]胡瞬, 易有金, 熊兴耀, 等. 灵芝孢子油的研究进展[J]. 安徽农业科学, 2010, 38(17): 9214-9215.
[2]WANG Jiahe, ZHOU Yijun, ZHANG Meng, et al. Active lipids ofGanoderma lucidumspores-induced apoptosis in human leukemia THP-1 cells via MAPK and PI3K pathways[J]. Journal of Ethnopharmacology, 2012, 139(2): 582-589.
[3]孟凡冰, 李云成, 钟耕. 灵芝孢子油的提取及其脂肪酸检测方法的研究[J]. 食品科学, 2013, 34(2): 42-45.
[4]GAO Pei, HIRANO T, CHEN Zhiqing, et al. Isolation and identification of C-19 fatty acids with anti-tumor activity from the spores ofGanoderma lucidum(reishi mushroom)[J]. Fitoterapia, 2012,83(3): 490-499.
[5]马林, 吴丰, 陈若芸. 灵芝三萜成分分析[J]. 药学学报, 2003, 38(1):61-68.
[6]陈体强, 吴锦忠. 超微粉碎后超临界CO2萃取灵芝孢子挥发油组分的GC-MS分析[J]. 天然产物研究与开发, 2006, 18(6): 982-985.
[7]陈逸湘, 凌宏通, 曾振基, 等. 无公害室内灵芝栽培技术[J]. 中国食用菌, 2012, 31(5): 20-22.
[8]MITRA P, RAMASWAMY H S, CHANG K S. Pumpkin (Cucurbita maxima) seed oil extraction using supercritical carbon dioxide and physicochemical properties of the oil[J]. Journal of Food Engin eering,2009, 95(1): 208-213.
[9]ANIKO F G, SZABOLCS S, BELA S, et al. Supercritical fluid extraction ofAlnus glutinosa(L.) Gaertn[J]. The Journal of Supercritical Fluids, 2012, 61: 55-61.
[10]KHATTAB R Y, ZEITOUN M A. Quality evaluation of flaxseed oil obtained by different extraction techniques[J]. LWT-Food Science and Technology, 2013, 53(1): 338-345.
[11]朱坚, 李晔, 邓优锦, 等. 超临界CO2萃取灵芝孢子油的工艺研究[J].中国食用菌, 2009, 28(6): 50-52.
[12]毛方华, 陈体强, 王宏雨. 超临界CO2萃取灵芝孢子油工艺条件的响应面优化[J]. 中国粮油学报, 2012, 27(6): 71-75.
[13]SAGRATINI G, MAGGI F, CAPRIOLI G, et al. Comparative study of aroma pro le and phenolic content of Montepulciano monovarietal red wines from the Marches and Abruzzo regions of Italy using H SSPME-GC-MS and HPLC-MS[J]. Food Chemistry, 2012, 132(3):1592-1599.
[14]YUAN Jianping, WANG Jianghai, LIU Xin, et al. Determinatio n of ergosterol inGanodermaspore lipid from the germinating spores ofGanoderma lucidumby high-performance lipid chromatography[J].Journal of Agricultural and Food Chemistry, 2006, 54(17): 6172- 6176.
[15]王江海, 袁建平, 徐世平, 等. 薄层色谱-光度法测定灵芝孢子中的总三萜含量[J]. 中国食品学报, 2004, 4(9): 76-79.
[16]YIN Jianzhong, WANG Aiqin, WEI Wei, et al. Analysis of the operation conditions for supercritical fluid extraction of seed oil[J].Separation and Purification Technology, 2005, 43(2): 163-167.
[17]NISHA A, SANKAR K U, VENKATESWARAN G. Supercritical CO2extraction ofMortierella alpinasingle cell oil: comparison with organic solvent extraction[J]. Food chemistry, 2012, 133(1): 22 0-226.
[18]JULIO M A A, DELCIO S. Extraction of coffee diterpenes and coffee oil using supercritical carbon dioxide[J]. Food Chemistry, 2007,101(3): 1087-1094.
[19]谢婧, 徐俐, 张秋红, 等. 顶空固相微萃取法提取菜籽油挥发性风味成分[J]. 食品科学, 2013, 34(12): 281-285.
[20]田光辉, 林娟, 陈文强, 等. 野生与栽培灵芝挥发油成分的分析[J].中国食用菌, 2003, 22(2): 47-48.
[21]陈志杰, 杨振东, 顾振新. 顶空固相微萃取气质联用检测灵芝菌丝体挥发性风味物质[J]. 食品研究与开发, 2010, 33(2): 132-135.
[22]陈曦, 黄明泉, 孙宝国, 等. 同时蒸馏萃取-气相色谱-质谱联用分析长裙竹荪挥发性成分[J]. 食品科学, 2012, 33(14): 129-135.
[23]史琳, 王志成, 冯叙桥. 五味子化学成分及药理作用的研究进展[J].药物评价研究, 2011, 34(3): 208-212.
[24]ISHIKAWA N K, FUKUSHI Y F, YAMAJI K, et al. Antimicrobial cuparene-type sesquiterpenes, enokipodins C and D, from a mycelial culture ofFlammulina velutipes[J]. Jounal of Natural Products, 2001,64(7): 932-934.
[25]邓乾春, 黄庆德, 黄凤洪, 等. 亚麻籽油调和油的热稳定性研究[J].食品科学, 2012, 33(5): 88-92.
[26]邢增涛, 郭倩, 冯志勇, 等. 姬松茸中挥发性风味物质的GC-MS分析[J]. 中药材, 2003, 26(11): 789-791.
[27]FORRER M, KULIK E M, FILIPPI A, et al. The antimicrobial a ctivity of alpha-bisabolol and tea tree oil againstSolobacterium moorei, a Gram-positive bacterium associated with halitosis[J]. Archives of Oral Biology, 2013, 58(1): 10-16.
[28]李巍巍, 吴时敏, 徐婷. 褐黄牛肝菌挥发性风味物质组成研究[J]. 上海交通大学学报: 农业科学版, 2009, 27(3): 300-304.
