DBSA/环己烷/水微乳体系中脂肪酶催化合成正辛酸甲酯
2014-01-16谈忠琴宋乐莲韩晓祥励建荣
杜 欢 谈忠琴 宋乐莲 韩晓祥 励建荣
(浙江工商大学食品与生物工程学院应用化学系1,杭州 310035)(渤海大学辽宁省食品与安全重点实验室2,锦州 121013)
正辛酸甲酯是一种具有酒、水果、甜橙香气的无色至浅黄色澄清液体,常用于食品工业和化妆品的香料配料,此外,还用于染料、香料、医药的合成,也可用于酸性蛋白质的沉淀,在蛋白纯化中有较广泛的应用。目前工业制备辛酸甲酯的方法有很多,最主要的是用正辛酸与甲醇在硫酸催化下进行酯化反应,但硫酸催化时存在活性低、选择性差、易发生副反应、产物不易提纯、腐蚀性强、污染环境严重等缺点,不符合当今可持续发展的要求[1]。采用固体酸、金属盐类、碱性脂肪酶等催化剂[2-10],虽然在一定程度上解决了传统催化剂存在的一些缺点,但它们仍存在相对活性低、表面易积碳、酸性位密度低和酸强度分布不均等缺陷[11],从而限制了它们的应用。
微乳体系是指由油、水、表面活性剂和助剂按照一定比例自发形成的热力学稳定的、外观透明或半透明的高度分散体系,其分散相胶束粒径为10~100 nm,具有超低的界面张力,稳定的热力学特性及对难溶液体的强溶解性,且价格廉价,广泛用于纳米材料制备、有机化学反应、聚合反应、酶催化、分离等领域[12-16]。微乳体系作为反应介质时可克服试剂不相溶性,改善反应物局部浓度,增强区域选择性,提高酶的稳定性等,从而提高反应速率。脂肪酶作为一种生物催化剂,在合成反应中具有很高的区域选择性和立体选择性,在微乳体系中进行脂肪酶催化反应已有研究报道[17-20]。
在十二烷基苯磺酸(DBSA)/环己烷/水微乳体系中分别进行了有无脂肪酶PPL催化下香料正辛酸甲酯的合成研究,同时考察微乳体系中含水量、反应温度、反应时间、缓冲溶液pH值、醇酸物质的量比、加酶量等因素对正辛酸甲酯转化率的影响,并采用响应面分析法对正辛酸甲酯的合成反应条件进行优化。
1 材料与方法
1.1 材料与试剂
DBSA:日本Tokyo Kasei Kogyo有限公司;猪胰脂肪酶(PPL):Sigma-Aldrich公司;环己烷、正辛酸、甲醇、氢氧化钠、酚酞及其他试剂:迈瑞化学试剂公司。
1.2 微乳体系的制备
将一定质量的DBSA与环己烷混合,在磁力搅拌器上边搅拌边滴加去离子水,当混合溶液变澄清时,所加水量记作第一相变点,继续滴加,当溶液变浑浊时,所加水量记作第二相变点,中间一段澄清的溶液称为微乳液。改变DBSA与环己烷的比例,重复上述操作,测得一系列相变点数据,根据相变点处DBSA、环己烷、水3个组分的质量分数,用Origin 8.0绘制三相图,确定微乳区与非微乳区。
根据所绘制的三相图,在微乳区中任取几个特殊点,将DBSA、环己烷和水三组分按其对应的质量分数混合,均匀搅拌后即可配成澄清透明的微乳体系,以作为合成正辛酸甲酯的反应体系。酯化反应结束后,用气相色谱法检测正辛酸的转化率,根据转化率的大小,确定微乳区的最大反应点,并将此最大反应点作为研究正辛酸酯化反应单因素影响的反应点。
1.3 微乳体系中正辛酸甲酯的合成
在圆底烧瓶中分别加入形成微乳体系的3个组分,磁力搅拌30 min,形成均匀澄清透明的微乳体系。向微乳体系中加入正辛酸和甲醇,在水浴条件下进行酯化反应。酯化反应产物在Agilent 689 0N气相色谱仪上进行定量分析,FID 检测器,HP-5毛细管柱,月桂酸甲酯为内标物。
2 结果与讨论
2.1 含水量w0对酯化反应的影响
图1为DBSA/环己烷/水体系的三组分相图。由图1可以看出,微乳区域较小,多相体系(即非微乳区)较大;在微乳区内,DBSA与环己烷在少量水存在下即可互溶,形成均匀澄清的反应体系。

图1 DBSA/环己烷/水体系的三组分相图
微乳体系中,水的含量用w0表示,它是指水与表面活性剂DBSA的物质的量之比。w0对DBSA/环己烷/水微乳体系中正辛酸甲酯的产率有着重要影响,具体反应结果见图2。由图2可见,有无脂肪酶存在条件下,微乳体系水的含量w0和正辛酸甲酯产率的变化关系均像钟形轮廓形状,并在w0=3时有最大转化率。一般来说,微乳体系中,酯化反应发生在相界面处,相界面处的面积越大,底物分子间的接触越充分,从而增加反应速度,提高反应产率。随着w0值(1~3)的增加,界面增加,同时反应过程中生成的水参与微乳体系的形成,有利于反应平衡进一步向右移动,正辛酸甲酯的收率增加。对于有酶体系来说,低w0时,水主要与表面活性剂结合,而使酶保持活性构象所需的自由水较少,从而抑制酶的活力,随着w0的增大,自由水增多,酶的活性增大,反应速度加快,酯化率增加。当w0值增加到一定程度时,过量水的存在可使微乳体系转变为乳浊液或者不稳定体系,相接触面积减少,反应速度降低,对有酶体系来说,过量的水还使得酶分子周围的水壳太厚, 不利于酶与底物的充分接触, 从而影响酶活性的充分发挥。另外过量水将使酯化反应平衡向逆反应方向进行,促进水解反应,降低转化率,因此,试验中选择微乳体系中含水量w0=3为宜。
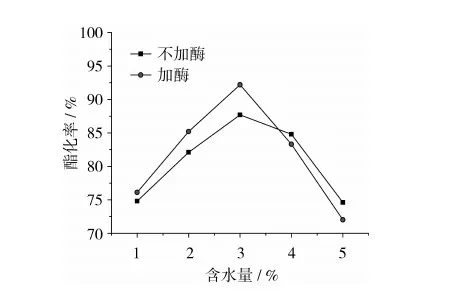
图2 含水量w0对酯化反应的影响
2.2 反应温度对酯化反应的影响
正辛酸0.5 mmol,醇酸物质的量比10∶1,w0=3,反应4.0 h条件下,考察DBSA/环己烷/水微乳体系中不同反应温度对酯化反应的影响,结果见图3。由图3可见,无论在不加酶微乳体系和加酶微乳体系中,随着反应温度的升高,转化率均呈现增大趋势,在40 ℃以后转化率趋于平缓下降,与通常动力学反应规律相同。这是因为在低温时,温度的升高有利于DBSA的酸催化作用,当T=40 ℃时,反应基本达到平衡,正辛酸甲酯收率达到最高为87.7%,进一步增加反应温度,即T>40 ℃时,此时虽然DBSA的酸催化作用增强,但是随着温度的升高,微乳体系越来越不稳定,同时酯水解反应活性增强,表现为酯化率并没有随温度的升高而增强,反而呈现下降趋势。因此,无酶存在时反应温度控制在40 ℃为宜。由图3亦知,低温酶存在时,酶催化反应活力随温度的升高而增强,40 ℃时酶催化反应活性达最大,辛酸甲酯收率最高为92.1%。进一步增加反应温度,即温度超过40 ℃时,酶催化反应酯化率有下降趋势。由于高温常使酶难以保持活性构象,从而降低酶活力,导致反应速率随温度身高而降低,而高温提高了DBSA 的酸催化作用,两者相互作用的结果,使得辛酸甲酯的收率并未出现明显降低。进一步增加反应温度,酶活力进一步降低,此时DBSA催化的酯水解副反应活性增加,从而酯化率降低。
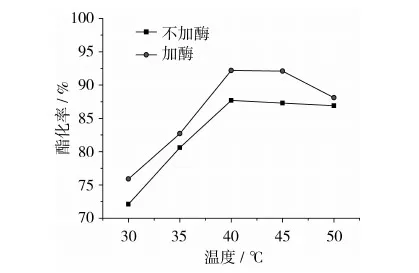
图3 反应温度对酯化反应的影响
2.3 反应时间对酯化反应的影响
正辛酸0.5 mmol,醇酸物质的量比为10∶1,w0=3,反应温度40 ℃条件下,考察DBSA/环己烷/水微乳体系中反应时间对酯化反应的影响,结果见图4。

图4 反应时间对酯化反应的影响
由图4可见,有无脂肪酶存在时,该微乳体系进行酯化反应时均具有较好的催化活性,说明该微乳体系中,DBSA具有双重作用,除作为表面活性剂与环己烷、水形成微乳体系外,还可作为Brönsted酸对酯化反应具有一定的催化能力。脂肪酶存在下,反应3.0 h时,酯化率即达到86.5%,无酶存在时酯化率为77.4%。随着反应时间的延长,酯化率逐渐升高,无酶存在时酯化反应速率增加更明显。当反应时间为4.0 h时,酯化率达到最大值。延长反应时间,酯化率基本保持不变。由于酯化反应为可逆反应,过长的反应时间使得正辛酸甲酯的水解反应活性增加,因此反应时间以4.0 h为宜。
2.4 醇酸物质的量比对酯化反应的影响
酯化反应是一个可逆反应,常通过增加反应物的量来提高反应转化率,图5为正辛酸0.5 mmol,w0=3,反应温度40 ℃,反应4.0 h条件下,DBSA/环己烷/水微乳体系中醇酸物质的量比对酯化反应的影响。由图5可见,有无脂肪酶存在条件下醇酸物质的量比对酯化反应的影响均较大。在所考察的范围内,随着甲醇用量的增加,酯化率逐渐上升,当醇酸物质的量比超过10∶1时,酯化率分别达到92.1%和87.7%,且酶存在时,醇酸物质的量比对正辛酸甲酯酯化率的影响更明显。进一步增加甲醇用量,酯化率基本保持不变。这是因为增大甲醇的用量,有利于反应向生成酯的方向移动而提高酯化率,但当酸醇摩尔比提高到一定程度后,增加醇的量,此时反应溶液体积增加较大,催化剂浓度相对变稀,反应速度变慢,酯化率有所下降,综合结果,辛酸甲酯的收率基本保持不变,因此,醇酸物质的量比选为10∶1。

图5 醇酸物质的量比对酯化反应的影响
2.5 脂肪酶用量对酯化反应的影响
正辛酸0.5 mmol,w0=3,反应温度40 ℃,反应4.0 h条件下,考察DBSA/环己烷/水微乳体系中酶用量对酯化反应的影响,结果见图6。由图6可见,加酶量小于6 mg时,酯化率随着酶用量的增加迅速上升,当加酶量等于6 mg时,酯化率最大达92.1%,进一步增加酶用量,酯化反应的产率趋于稳定,不再上升。这可能是因为当酶的浓度在一定范围内增加时,随着酶量的增加,酶分子中有越来越多的活性部位与底物接触[21],从而使酯化反应的产率快速增加,但当酶的活性部位增加到一定程度时,可能会由于蛋白质的聚集作用而不再与底物接触,反应速率不再增加。因此选择加酶量为6 mg。
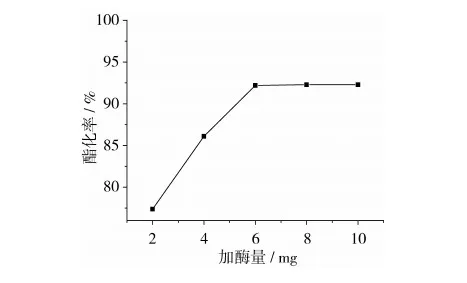
图6 加酶量对酯化反应的影响
2.6 缓冲液pH值对酯化反应的影响
酶分子上有许多酸性、碱性氨基酸的侧链基团, 这些基团在不同pH氛围中常具有不同的解离状态,或与反应底物间存在一定的相互作用,进而影响酶的结构,改变酶催化反应活性。试验中考察了不同缓冲体系对酯化率的影响,见图7。由图7可见,体系中酶催化酯化反应的转化率随pH值呈先增加后减少的趋势,pH=7.0时,酯化率最高为92.1%,这可能由于PPL酶作为生物催化剂,比较适合中性环境。酸性和碱性条件下都会使酯化率有不同程度降低,且酸性条件下降低更明显。这表明酸性对酶活力有较大影响,同时酸性增强增加了酯水解反应活性,从而酯化反应收率大大降低。

图7 缓冲溶液pH值对反应的影响
2.7 采用响应面法优化正辛酸甲酯的合成
2.7.1 分析因素的选取及分析方案
根据 Box-Benhnken 的中心组合试验设计原理,综合单因素试验结果,选取含水量、反应时间、醇酸物质的量比、加酶量这4个因素,采用四因素三水平响应面分析方法确定正辛酸甲酯制备最佳工艺条件,试验因素和水平设计见表1。

表1 响应面分析法的因素与水平表
以A、B、C和D为自变量,以正辛酸甲酯酯化率为响应值(Y),试验方案及结果见表2,29个试验点可分为两类:一是析因点,自变量取值在各因素所构成的三维顶点,共有24个析因点;二是零点,为区域中心点,零点试验重复5次,用以估计试验误差。
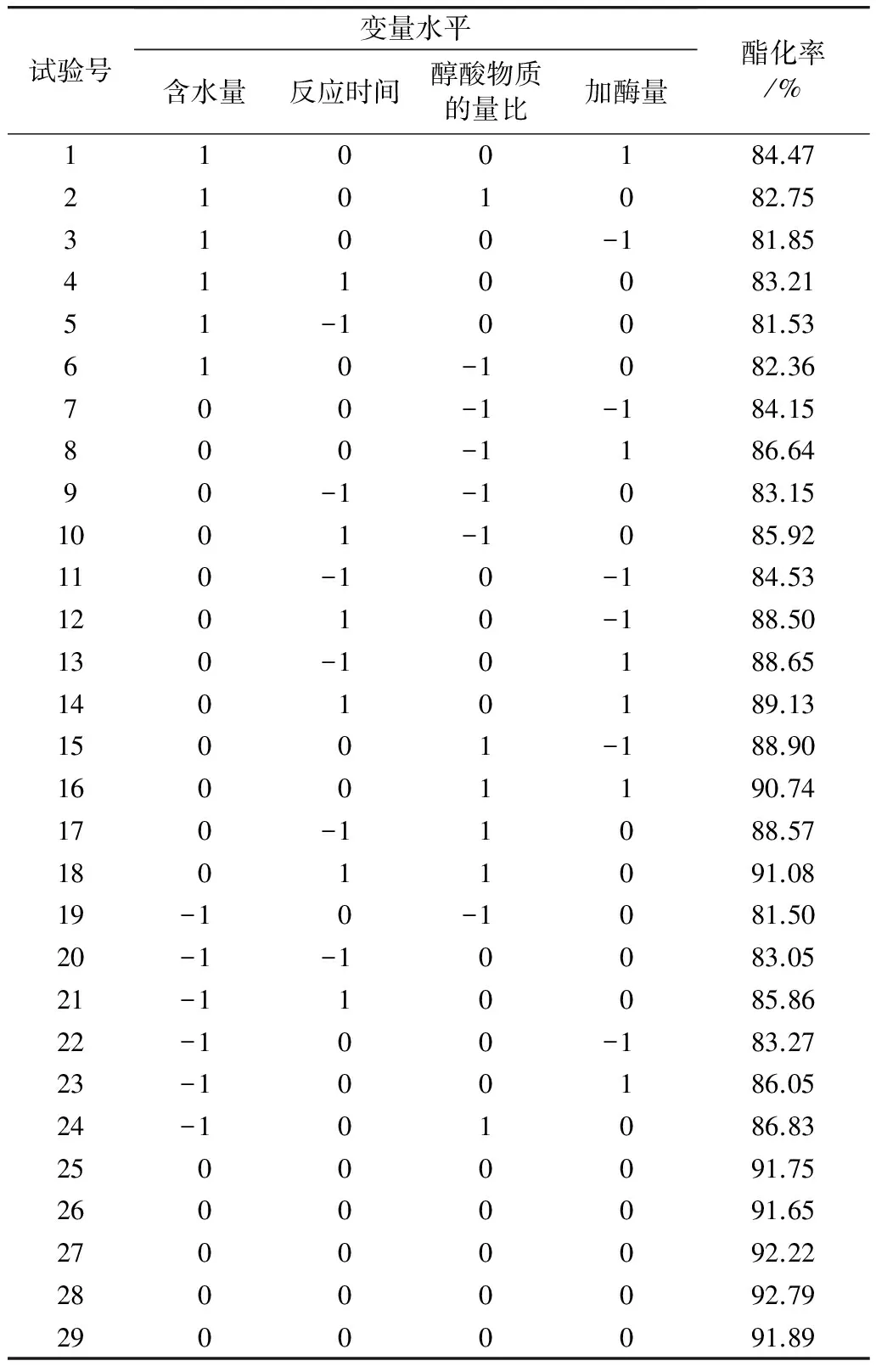
表2 响应面分析结果
2.7.2 模型的建立与显著性检验
以酯化率为响应值,通过RSM软件对其进行方差分析,其结果见表3。由表3可知,模型F值为57.50,F>F0.01(14,14)=3.70。模型显著水平远小于0.01,表明二次回归模型高度显著。实测值与预测值的相关系数为0.982 9,说明自变量与响应值之间线性关系显著,模型的预测值和实验值拟合较好。回归方差显著性检验结果表明,该模型回归显著,失拟项不显著。另外,该模型的变异系数(C.V)为0.78%,在可接受范围。变异系数是衡量每个平均值偏离情况的参数,其值越小,重复性越好。综合各参数,该实验方法可靠,各因素水平区间设计较合理,因此可用该回归模型预测正辛酸甲酯的酯化率。
含水量、醇酸物质的量比和加酶量一次项均达到极显著水平(P<0.01)。含水量、反应时间、醇酸物质的量比和加酶量二次项也均达到极显著水平(P<0.01)。各因素(含水量、反应时间、醇酸物质的量比和加酶量)对酯化率的影响经拟合得到二次多项回归方程如下:

表3 微乳体系中猪胰脂肪酶催化合成正辛酸
注:*表示该项具有显著性效应;**表示该项具有极显著效应。
Y=+91.91-0.87A+1.18B+2.10C+1.21D-6.14A2-2.33B2-2.41C2-1.87D2-0.28AB-1.23AC-0.040AD-0.065BC-0.87BD-0.16CD
2.7.3 不同因素间的交互影响
借助 Design Expert软件,依据回归方程式来绘制分析图。RSM的图形是响应值对各试验因子构成的等高线图和曲面图,分别见图8和图9。响应面等高线可以较直观地反映各因素相互作用对响应值的影响。等高线若呈圆形,则交互作用不显著;若呈椭圆形,则交互作用显著[22-23]。
从图8a~图8c中看出,横向的等值线较疏,纵向的等值线较密,这说明含水量对酯化率的影响较大,反应时间、醇酸物质的量比和加酶量这3个因素对正辛酸甲酯收率的影响则相对较小。从图9a~图9c中看出,反应时间、醇酸物质的量比和加酶量分别一定时,正辛酸甲酯产率随着含水量的增加先增加后逐渐减少。在图8b和图8e中,等高线呈斜椭圆形, 说明图中的两因素交互作用显著,与表3方差分析显著性相符;而其他等高线趋向圆形,两因素交互作用不明显,也与方差分析显著性相符。


图8 不同因素交互作用影响正辛酸甲酯酯化率的等高线图
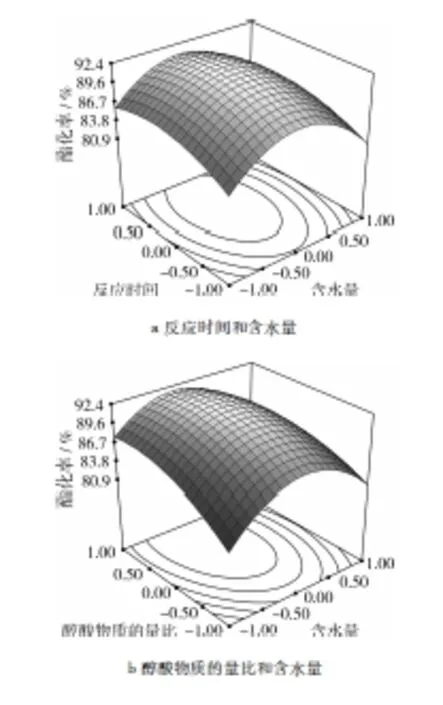

图9 不同因素交互作用影响正辛酸甲酯酯化率的响应面图
2.7.4 最佳工艺条件
结合回归模型的数学分析可知,制备正辛酸甲酯最佳工艺参数为:w0=3,反应时间4.01 h,醇酸物质的量比11.09,加酶量为6.77 mg,正辛酸甲酯的收率为93.2%。考虑到实际操作的方便,将最佳反应条件修正为:w0=3,反应时间为4.0 h,醇酸物质的量比为11,加酶量为6.5 mg,在此条件下进行3次平行验证试验,测得的平均产率为92.8 %,与理论预测值基本相符,这说明回归方程能够真实地反映各因素对酯化率的影响。
3 结论
3.1 有无脂肪酶存在时,DBSA/环己烷/水微乳体系中制备正辛酸甲酯时均具有较好的催化活性,PPL脂肪酶存在更有利于反应的进行。微乳体系中DBSA起双重作用:一是作为表面活性剂,参与稳定微乳体系的形成,增大反应物之间的接触,加快反应速率;二是作为Brönsted酸催化酯化反应,提高酯化反应转化率。
3.2 DBSA/环己烷/水微乳体系中PPL脂肪酶催化合成正辛酸甲酯的较佳工艺条件为:w0=3,反应温度40 ℃,反应时间4.0 h,醇酸物质的量比11,加酶量6.5 mg,缓冲液pH=7。在此条件下,酯化率为92.8%。
[1]张毓瑞, 赵承卜, 韩丽君. 用固体酸H101催化辛酸酯化反应[J]. 化学世界, 1986(7): 299-300
[2]王秋莹, 杨青山, 许学翔, 等. 固体超强酸SO42-/TiO2对酯化反应的催化作用[J]. 应用化学, 1988(4): 76-78
[3]饶蔚兰, 潘志权, 向守信. 稀土固体超强酸的制备及其对硬脂肪酸酯化反应的催化[J]. 应用化学, 2011, 28(8): 907-912
[4]张富捐, 张翔宇, 盛淑玲. 硫酸氢钠催化合成乙酸异戊酯的研究[J]. 食品工业科技, 2004(1): 116-117
[5]刘春生, 罗根祥. 十二烷基磺酸铁催化合成乙酸异戊酯[J]. 日用化学工业,2004, 34(6): 403-405
[6]卓润生, 周世新. 用钨磷杂多酸作催化剂合成己酸乙酯的研究[J]. 化学研究与应用, 1994, 6(4): 103-105
[7]俞善信, 张鲁西, 石菲菲. 氯化铁催化合成羧酸苄酯[J]. 南都学坛, 2001, 21 (3) : 60-61, 63
[8]Ni J, Meunier F C. Esterification of free fatty acids in sunflower oil over solid acid catalysts using batch and fixed bed-reactors[J]. Applied Catalysis A: General, 2007, 333(1): 122-130
[9]Cramer J F, Dueholm M S, Nielsen S B, et al. Controlling the degree of esterification in lipase catalysed synthesis of xylitol fatty acid esters[J]. Enzyme and Microbial Technology, 2007, 41(3): 346-352
[10]Nakamura R, Komura K, Sugi Y.The esterification of glycerine with lauric acid catalyzed by multi-valent metal salts. Selective formation of mono-and dilaurins[J]. Catalysis Communications, 2008, 9(4): 511-515
[11]寇元, 杨雅立. 功能化的酸性离子液体[J]. 石油化工, 2004, 33(4): 297-302
[12]Jadhav K R, Shaikh I M, Ambade K W,et al. Applications of microemulsion based drug delivery system[J]. Current Drug Delivery, 2006, 3(3): 267-273
[13]Honore H S. Recent applications of microemulsion electrokinetic chromatography[J]. Electrophoresis, 2003, 24(22-23): 3900-3907
[14]Paul B K, Moulik S P. Uses and applications of microemulsions[J].Current Science, 2001, 80(8): 990-1001
[15]王延平, 孙新波, 赵德智. 微乳液的结构及应用进展[J]. 辽宁化工, 2004, 33(2) : 96-98, 116
[16]周国伟, 李干佐, 郑立强, 等. 不同微乳液体系和微乳液凝胶中的酶催化反应[J]. 日用化学工业, 2001, 31 (3) : 35-39
[17]Xu Y, Zhao C M, Zhang K C. A kinetic study on enzymatic synthesis of ethyl hexanoate by immobilized lipase form Mucor miehei in heptane partially supported by the open project program of the state key laboratory of bioreactor engineering[J]. Chinese Journal of Biotechnology, 1999, 15(4): 533-536
[18]Wu W H, Akoh C C, Philips R S. Lipase-catalyzed stereo selective esterification of DL-menthol in organic solvents using acid anhydrides as acylating agents[J]. Enzyme and Microbial Technology, 1996, 18(5): 536-539
[19]周国伟, 黄锡荣, 李越中, 等. 脂肪酶在微乳液和微乳液凝胶中催化辛酸辛醇的酯化反应[J]. 生物工程学报, 2001, 17(2): 224-227
[20]刘俊康, 刘瑛, 殷福珊. 微乳凝胶固定化脂肪酶及其催化酯化反应的研究[J]. 日用化学工业, 2000, 30(5): 9-11
[21]Ghamgui H, Miled N, Reha A, et a1. Production of monoolein by immobilized Staphy lococcus simulans lipase in a solvent-free system: optimization by response surface methodology[J]. Enzyme and Microbial Technology, 2006, 39: 717-723
[22]王允祥, 吕凤霞, 陆兆新. 杯伞发酵培养基的响应曲面法优化研究[J]. 南京农业大学学报, 2004, 27(3):89-94
[23]张豪, 乙引, 洪鲲, 等. 响应面法优化酶促脂肪酸甲酯化工艺条件[J]. 农业工程学报, 2011, 27(14): 125-130.
