草酸辅色黑豆种皮花色苷的光热降解动力学分析
2014-01-16蒋新龙蒋益花蔡成岗李文夏
蒋新龙 蒋益花 蔡成岗 李文夏
(浙江树人大学生物与环境工程学院,杭州 310015)
应用安全无毒的天然食用色素代替合成食用色素是大势所趋。花色苷是一类具一定营养和药理作用的高附加值的天然色素[1-2]。花色苷是2-苯基-苯并吡喃阳离子结构的衍生物,因其苯并吡喃环上缺电子,具有高度活性[3],而限制了其使用范围。花色苷的稳定性受到温度、光、pH、O2、辅助色素及本身浓度等因素的影响[4]。一般高温、见光、高pH易使花色苷降解[5]。花色苷的降解不仅影响了色泽,而且会产生对食品安全带来危害的有害物质[6]。因此,提高花色苷的稳定性已成为研究热点。目前提高花色苷稳定化技术主要有分离精制技术、添加辅色剂、结构改性、微胶囊化技术等[7]。笔者团队前期选用其他学者研究较少但较常见且安全无毒价格便宜的草酸、柠檬酸、丁二酸、丙二酸、乙酸等有机酸为辅色剂,以富含花色苷的黑豆种皮为原料,对其花色苷进行辅色效应试验,发现草酸的辅色效果最好。本试验主要以黑豆种皮花色苷为研究对象,进行草酸辅色花色苷的制备及其光热降解动力学研究,为黑豆种皮花色苷的进一步综合利用提供理论依据。
1 材料与方法
1.1 材料与仪器
材料:供试黑豆品种为“黑豆1号”,种皮由安徽黑粮农业种植推广专业合作社提供。取其种皮,烘干,过60目筛,备用。
仪器:UV-2450PC紫外可见分光光度计:岛津;UV-9100紫外可见光谱仪:北京瑞利;AL204电子分析天平:上海垒固仪器有限公司;pHS-3B型精密pH计:上海精密科学仪器有限公司;HH-2数显恒温水浴锅:上海乔跃电子有限公司;RE-52旋转蒸发仪:上海亚荣生化仪器厂。
大孔吸附树脂AB-8(净品级):天津海光化工有限公司。所用试剂为分析纯,所用水为蒸馏水。
1.2 试验方法
1.2.1 花色苷母液的制备
根据李莉蓉等[8]制备方法并稍做改动:称取黑豆种皮1 000 g用60%乙醇液按1∶4的料液比,用1 mo1/L盐酸调至pH 3,避光下浸提2 d。滤纸过滤,收集滤液,于50 ℃下减压浓缩,浓缩液用等体积的石油醚萃取3次后过AB-8大孔树脂,再用70%酸性乙醇液洗脱,将所得洗脱液于50 ℃下减压浓缩,得花色苷母液。真空干燥后得黑大豆花色苷(black soybean anthocyanin,简称BSA,下同),呈粉末状,深黑色。
1.2.2 花色苷浓度定量方法
根据朗伯比尔定律,溶液的吸光值A与其浓度C成正比,故该实验以吸光度作为花色苷浓度指标。
1.2.3 辅色花色苷制备及效果评价
草酸对黑大豆花色苷的辅色属于分子间辅色。辅色剂草酸与花色苷分子以氢键和非共价结合可形成“花色苷-辅色剂”复合物。辅色剂与花色苷的辅色反应方程式[4]:AH++L ≒ AHL+
式中:L为辅色剂,AHL+为“花色苷-辅色剂”复合物。
花色苷在水溶液中存在的2-苯基苯并吡喃阳离子、醌型碱、假碱、查耳酮的4种形式随溶液的pH变化而相互转化。在pH大于2的酸性介质中,花色苷开始由2-苯基-苯并吡喃阳离子水解为无色醇型假碱[9]。从辅色剂与花色苷的反应方程式可知,当AH+含量较少时,辅色剂L对辅色作用贡献度较大。Bobbio[10]研究也表明,在2-苯基苯并吡喃阳离子含量低时,辅色剂对花色苷的辅色作用较有效。辅助成色作用的关键在于pH,在较高pH条件下辅色剂更有利于花色苷烊阳离子的方向进行[11]。所以需要确定2-苯基苯并吡喃阳离子与无色醇型假碱水解平衡常数进行辅色试验。花色苷的水解平衡常数pKn是吸光值为最大吸光值1/2时的溶液pH值[4]。参考励建荣等[4]试验方法来确定花色苷水解平衡点。试验结果表明:黑豆种皮花色苷水解平衡点约为pH 3.5。
吸取一定量pH 3.5的已纯化花色苷浓缩液10份,加入0.01 mol/L的草酸作为辅色剂,使溶液中草酸浓度为0.0、0.5、1.0、2.0、3.5、4.0、5.0、6.0、7.0、8.0 mmol/L,测定450~580 nm范围内最大吸收峰(λmax)及最大吸光值(Amax)。辅色效果的评价以每摩尔每升草酸引起的花色苷吸光值增加量I表示[12]:
I=A-A0/C草酸
(1)
式中:C草酸为草酸浓度/mol/L;A为加入草酸后溶液的吸光值;A0为纯花色苷溶液的吸光值。
1.2.4 热降解动力学参数确定
将辅色前后花色苷先用极少量50%乙醇溶解,用pH 1.0、3.5、4.5的缓冲液配制色素液稀释至适当浓度(A=0.45~0.80)用作热光降解试验[13]。
将降解用花色苷溶液分别置于50、60、70、80、90 ℃恒温水浴中10 h,每隔2 h测定吸光度值。重复3次。许多学者研究表明,辅色反应符合一级反应[12,14]。假设草酸对黑豆种皮花色苷进行辅色处理的反应也符合一级反应动力学,则可根据下式计算热降解反应速率常数(k)、热降解活化能(E0)、热降解半衰期(t1/2)、温度系数(Q10)等参数。
k、E0由Arrhenius方程确定[3,12]:
ln(c/c0)=-kt
(2)
lnk=lnk0-E0/RT
(3)
式中:c0为色素加热前的最初浓度/mol/L;c为色素加热后的终浓度/mol/L;t为反应时间/h;k0为频率常数;E0为活化能/kJ/mol;T为绝对温度/K;R为气体常数[8.314×10-3kJ/(mol·K)]。
根据朗伯比尔定律,溶液的吸光值A与其浓度c成正比,故(2)式可表示为ln (A/A0)=-kt。热降解半衰期t1/2=0.693/k,热降解率P:
P=(1-A/A0)×100%
(4)
Q10为温度系数,k1、k2分别为温度t1、t2℃时的速率常数。Q10值越大,表示热降解反应速率对温度变化越敏感[15]。
Q10=(k2/k1)10/(t2-t1)
(5)
1.2.5 光降解动力学参数确定
将降解用花色苷溶液分别置于24 ℃恒温室内自然光(平均光强4 000 lx)、强日光(平均光强85 000 lx)和避光条件下进行对照试验,每隔2 d测吸光度值。重复3次。计算k和t1/2,方法同1.2.4。
1.2.6 数据分析方法
试验数据以平均数表示。数据分析采用DPS统计软件,均值的多重比较采用Bonferronj法,P<0.05为差异显著。
2 结果与分析
2.1 辅色效果的评价
根据1.2.3方法,试验结果如表1。由表1可知,添加草酸后,花色苷的吸光度增大,且随草酸浓度增大,溶液最大吸光值逐渐增大,说明有辅色作用[11,16]。最大吸收波长基本不变,没有明显的红移效应,这与许多学者研究结果不同[11-12],但与杨振东[17]研究结果相似。从每摩尔每升草酸吸光值增加量看,草酸浓度为5.0 mmol/L时,I值最大,辅色效应最高。此时黑豆种皮花色苷原始吸光度A为0.655,与草酸物质的量之比为131。

表1 草酸对花色苷辅色作用/mmol/L
2.2 花色苷热降解动力学参数
已有大量研究表明,花色苷对光、热表现出不稳定的特性[18]。根据1.2.4方法,图1为辅色前后不同pH的花色苷色素液热稳定性A~t的对应试验数据。再根据-ln(A/A。)-t作图并进行线性回归,结果见表2。结果表明线性关系良好(相关系数R>0.95),辅色前后花色苷热降解均符合动力学一级反应规律,与许多学者研究结果相符[19-20]。

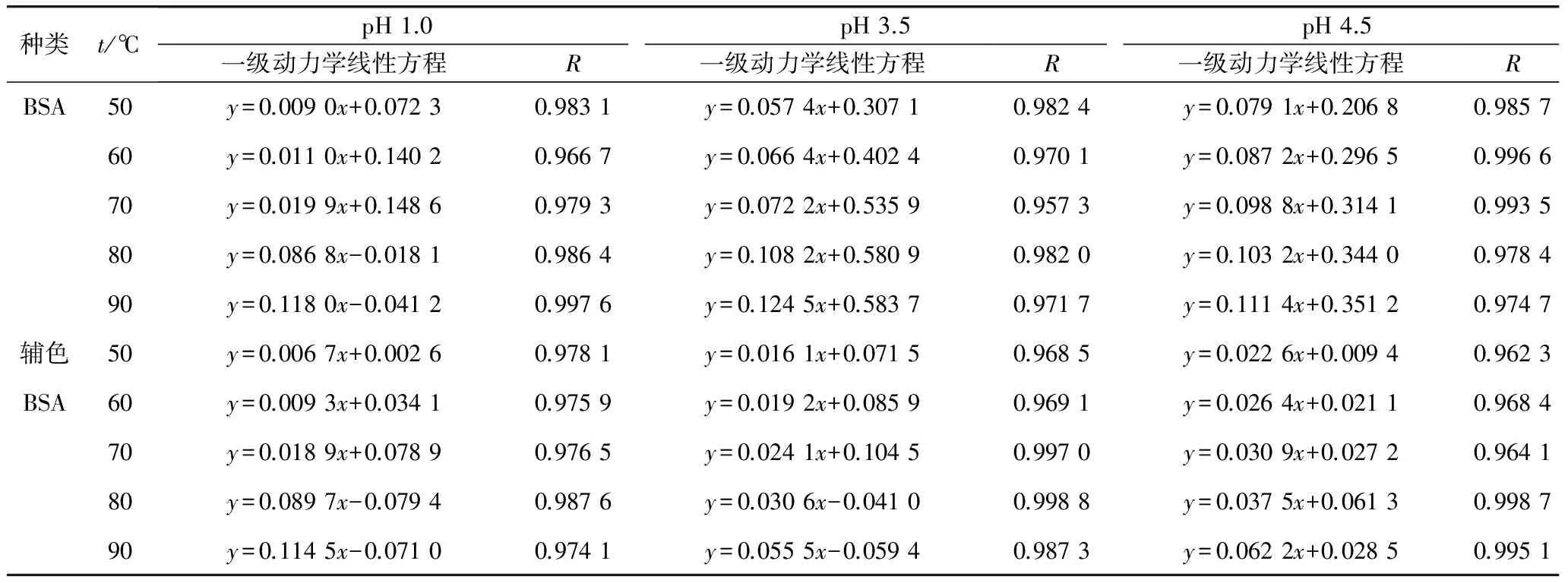
注:图中每条曲线对应的温度自上而下依次为50、60、70、80、90 ℃。
注:y为-ln (A/A0);x为t。
表3显示,辅色前后的花色苷的热稳定性不同。在一定温度下,以活化能计,草酸辅色BSA>未辅色BSA,说明辅色花色苷的热稳定性较好,有利于色素在热处理条件下的应用及保存。Dangles 等[11]认为,富电子的辅色剂和带正电荷的花色苷烊阳离子通过氢键等分子间作用力,可形成辅色剂-花色苷电子转移复合物,该复合物的形成使得花色苷烊阳离子光谱特性发生改变,其表现为增色效应和最大吸收波长的改变。其次,该复合物使平衡向更有利于花色苷烊阳离子的方向进行,增加了其稳定性,同时也增加了红色调花色苷的比例。辅助成色作用是改善富含花色苷食品颜色的一种十分有价值的、纯天然的方法[21]。
表3还表明,在不同的pH 条件下,花色苷的热稳定性不同。总体来说,在一定温度下,以活化能计,pH 1.0>pH 3.5>pH 4.5,说明低pH值条件下,花色苷的热稳定性较好。在低pH环境下,辅色前后的花色苷热降解的半衰期变化不大;在较高pH环境下,辅色后的花色苷热降解的半衰期大大延长,辅色前后的花色苷热降解的半衰期有显著差异(P<0.05)。
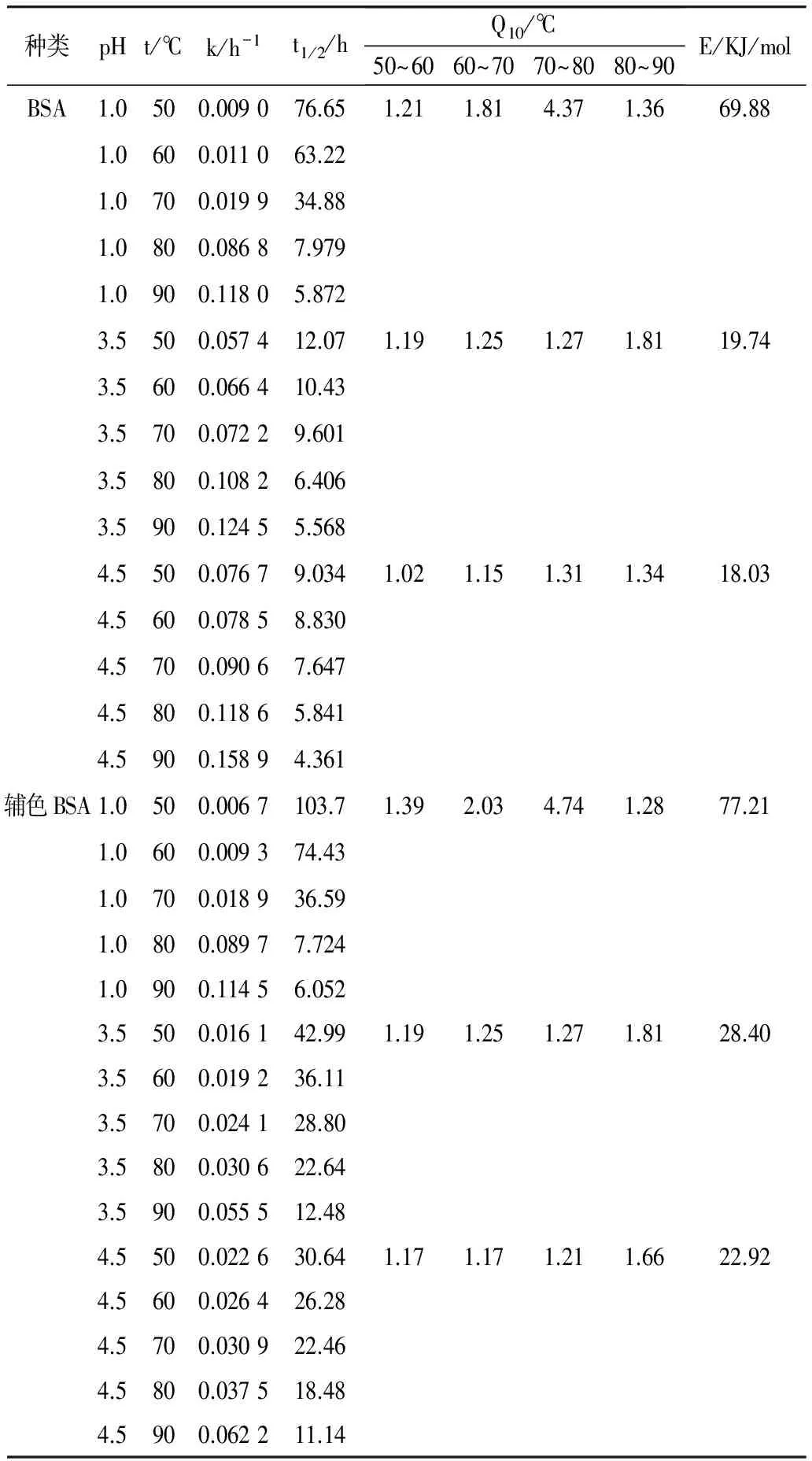
表3 不同pH值条件下花色苷热降解参数
究其原因,在低pH环境下所有的花色苷本身都能转变为花色苷烊阳离子,而在较高pH条件下,转变为花色苷烊阳离子的相对较少,辅色作用有利于向花色苷烊阳离子的方向进行。
辅色前后花色苷热降解的温度系数Q10呈现相似的规律。从温度系数Q10还可看出,pH 1.0条件下,花色苷在70~80 ℃的Q10值明显大于其他温度范围内的Q10值,说明当热处理温度从70 ℃提高到80 ℃时,花色苷降解速率迅速加快,而80~90 ℃时,降解速率变化不敏感。所以在食品加工时,花色苷尽量低温处理避开敏感区。pH 3.5和pH 4.5条件下,花色苷降解速率对温度反应最敏感的区域均发生在80~90 ℃范围内。
2.3 花色苷光降解动力学参数
图2显示,辅色前后花色苷的光稳定性不同。相同pH条件,辅色BSA-暗处>BSA-暗处>辅色BSA-自然光>BSA-自然光>辅色BSA-强光>BSA-强光,光照强度和光照时间对花色苷的稳定性影响较大,光照强度越高,时间越长,花色苷降解程度越高;不同pH条件,pH 1.0>pH 3.5>pH 4.5。辅色花色苷的光稳定性优于未辅色花色苷。这也与形成辅色剂-花色苷电子转移复合物有关[11]。
不同花色苷色素液光稳定性根据-ln(A/A0)-t作图并进行线性回归,表4表明线性关系良好(R>0.96),花色苷光降解符合动力学一级反应规律,与许多学者研究结果相符[22]。表5显示,相同pH的色素液,光照强度大的稳定性差,表现为降解速率大、半衰期短;相同光照强度,pH值大的稳定性差。草酸辅色花色苷的半衰期比对应未辅色的都要长,但差异并不显著(P>0.05)。用草酸辅色处理后能提高花色苷光稳定性,有利于色素在光处理条件下的应用及保存。
花色苷的光降解与光照强度、光照持续时间等因素有关,其机制是基态的花色苷吸收光能后转变为激发态的花色苷,激发态的花色苷再发生水解等降解反应[6]。因此该色素在处理和贮藏过程中,应尽量避免强光照射,长期保存应避光。Attoe等[23]认为,光诱导花色苷降解主要是存在分子态氧的原因,草酸辅色处理尽管能通过分子作用力形成辅色剂-花色苷电子转移复合物,但阻挡不了分子态氧的作用。因此,不管是否辅色处理,花色苷在食品中应用时,都应采用真空包装以提高产品稳定性。

表4 不同pH值条件下不同花色苷光降解动力学
注:y为-ln (A/A0);x为t。

注:图中每条曲线对应的光照条件由上到下依次为避光、自然光和强光。

种类光照条件pH1.0pH3.5pH4.5k/d-1t1/2/dk/d-1t1/2/dk/d-1t1/2/dBSA强日光0.07699.0070.11925.8150.14544.766自然光0.010764.740.025027.750.041816.59避光0.0051136.90.009870.660.019435.80辅色强日光0.07149.7000.09747.1130.11126.233BSA自然光0.008482.670.022031.550.032321.44避光0.0039176.00.007690.800.016043.30
3 结论
以草酸对黑豆种皮花色苷进行辅色处理,添加草酸后,花色苷的吸光度明显增大,说明草酸对花色苷有辅色作用。黑豆种皮花色苷原始吸光度与草酸物质的量浓度之比为131时,辅色效果最佳。
草酸辅色黑豆种皮花色苷的光热降解动力学符合动力学一级反应规律,且线性关系良好(R>0.95)。在低pH环境下,辅色前后的花色苷热降解的半衰期变化不大;在较高pH环境下,相对未辅色黑豆种皮花色苷,半衰期显著延长,热降解活化能显著增大,辅色效果较显著(P<0.05)。草酸辅色处理有利于黑豆种皮花色苷在光热处理条件下的应用及保存。
黑大豆种皮中的花色苷主要是矢车菊-3-半乳糖苷[24]、飞燕草-3-葡萄糖苷、矢车菊-3-葡萄糖苷和牵牛花-3-葡萄糖[25],至于辅色前后的结构变化及增强花色苷稳定性的机制,有待进一步研究探索。
[1]Timberlake C F, Henry B S. Anthocyanins as natural food colorants[J]. Progress in Clinical and Biological Research,1988, 280: 107-121
[2]Tamura H,Yamagami A. Antioxidative activity of monoacylated anthocyanins isolated from muscat bailey a grape [J]. Food Chemistry, 1994, 42(8): 1612-1615
[3]斐尼马.食品化学[M].北京:中国轻工业出版社,1991:464-468
[4]励建荣,岑沛霖,蒋志刚,等.单宁对杨梅汁花色苷稳定性的影响[J].科技通报,2001,17(6):1-6
[5]Pericles M. Anthocyanins as food colors[M].New York: Academic Press Inc, 1982. 10-21
[6]孙建霞,张燕,胡小松,等.花色苷的结构稳定性与降解机制研究进展[J].中国农业科学,2009,42(3):996-1008
[7]何兰,姜志宏.天然产物资源化学[M].北京:科学出版社,2008:528-546
[8]李莉蓉,张名位,刘邻渭,等.三种黑色粮油作物种皮花色苷提取物抗氧化能力的稳定性比较[J].中国农业科学,2007,40(9):2045-2052
[9]Giris E F, Ferreira E A, Falcao L D, et a1. Caffeic acid copigmentation of anthocyanins from Cabernet Sauvignon grape extracts in model systems[J].Food Chemistry, 2007, 100(3): 1289-1296
[10]Bobbio F O. Effect of light and tannic acid on the stability of anthocyanin in DMSO and in water[J].Food Chemistry, 1994, 51(2): 183-185
[11]Dangles O, Brouillard R. Polypbenols interactions. The copigmentation case: thermodynamic data from temperature and relaxation kinetics. Medium effect[J]. Canadian Journal of Chemistry, 1992, 70: 2174-2189
[12]朱洪梅,韩永斌,顾振新,等.单宁对紫甘薯花色苷的辅色作用研究[J].南京农业大学学报,2006,29(3):98-102
[13]邓洁红.刺葡萄皮色素的研究[D].长沙:湖南农业大学,2007
[14]彭常安,姜雯翔,袁哗,等.外源绿原酸对黑莓汁花色苷的辅色效果[J].江苏农业学报,2011,27(6):1357-1362
[15]任玉林,李华,邴贵德,等.天然食用色素花色苷[J].食品科学,1995,16(7):22-27
[16]王锋,邓洁红,谭兴和,等.花色苷及其共色作用研究进展[J].食品科学,2008,29:472-476
[17]杨振东.紫玉米芯花色苷提取工艺与组分分析及稳定性研究[D].南京:南京农业大学,2008
[18]Dyrby M, Westergaard N, Stapelfeldt H. Light and heat sensitivity of red cabbage extract in soft drink model systems[J]. Food Chemistry, 2001, 72: 431-437
[19]Kirca A, Cemeroglu B. Degradation kinetics of anthocyanins in blood orange juice and concentrate[J]. Food Chemistry, 2003, 81:583-587
[20]Gradinaru G, Biliaderis C G, Kallithraka S, et a1. Thermal stability of Hibiscus sabdariffa L. anthocyanins in solution and in solid state: effect of copigmentation and glass transition[J]. Food Chemistry, 2003, 83(3):423-436
[21]Rein M J. Copigmentation reactions and color stability of berry anthocyanins [D]. Helsinki(Finland):University of Helsinki, 2005: 87
[22]Ochoa M R,Kesseler A G,Michelis A D, et al. Kinetics of colour change of raspberry, sweet(prunus avium)and sour (prunuscerasus)cherries preserves packed in glass containers: light and room temperature effects[J]. Journal of Food Engineering, 2001, 49(1):55-62
[23]Attoe E L, Von Elbe J H. Photochemical degradation of betanine and selected anthocyanins[J]. Journal of Food Science, 1981, 46:1934-1937.
[24]王清滨,陈国良.食品着色剂及其分析方法[M].北京:化学工业出版社,2004:97-99
[25]Kim H J, Tsoy I, Park J M, et al. Anthocyanins from soybean seed coat inhibit the expression of TNF-α-induced genes associated with ischemia/reperfusion in endothelial cell by NF-κB-dependent pathway and reduce rat myocardial damages incurred by ischemia and reperfusion in vivo[J]. FEBS Letters, 2006, 580:1391-1397.
