4种抗性淀粉的主要理化特性
2014-01-16曾红华易翠平
谢 涛 曾红华, 汪 婕, 易翠平
(湖南工程学院化学化工学院1,湘潭 411104)(长沙理工大学化学与生物工程学院2,长沙 410015)
早在20世纪80年代初,国外就开始对抗性淀粉展开了研究,并认为这是一种与膳食纤维功能相似,但口感更优的一种食品配料,其生理功能及加工特征均优良,具有广泛的应用前景[1-3]。抗性淀粉由结晶区和无定形区2部分组成,结晶区主要是由直链淀粉双螺旋相互叠加而成,无定形区则是由无序的淀粉构成,抗性淀粉的抗酶解能力主要源于直链淀粉晶体[4-5]。目前,4种抗性淀粉中,老化或回生淀粉(RS3)研究最多,应用也最广,多通过压热法制备[6-9]。国内外对来源于大米、玉米和小麦等粮食作物的RS3进行了广泛研究,近些年来许多学者将研究的视角转向了非粮淀粉资源。赵力超等[10]采用酸解-微波法制备了慈姑抗性淀粉并测定了它的理化性质,结果表明:抗性淀粉的晶型转变为C型,结晶度为23.63%,溶解度和透明度远远低于原淀粉。Lehmann等[11]研究了香蕉抗性淀粉的聚合度、热特性、发酵特性及益生作用。
本研究采用二次循环压热法制备并纯化得到了绿豆、马铃薯、锥栗、板栗的抗性淀粉,重点研究了4种抗性淀粉的平均聚合度、晶体结构、溶解性、酶解性和热特性等理化性质,为绿豆、马铃薯、锥栗和板栗抗性淀粉的深度开发及广泛应用打下理论基础。
1 材料与方法
1.1 材料与仪器
绿豆、马铃薯淀粉:四川友嘉食品有限公司;锥栗、板栗淀粉实验室自制;直链淀粉、支链淀粉标准品:Fluka公司;耐热α-淀粉酶、人唾液 α-淀粉酶、糖化酶:Sigma公司;其余试剂均为分析纯。
UV-1800型紫外可见分光光度计:日本岛津公司;S-570型扫描电子显微镜:日本日立公司;D/max2500全自动X射线衍射仪:日本理学株式会社;DSC200型差示扫描量热分析仪:德国NETZSCH公司。
1.2 抗性淀粉制备
制备[12]:用蒸馏水配制30%的淀粉乳液,调节pH为6.0,沸水浴30 min后,121 ℃高温高压处理40 min。冷却,4 ℃放置24 h。重复高温高压和冷却步骤,80 ℃烘干,粉碎过100目筛得粗抗性淀粉。
纯化[13]:取粗抗性淀粉用耐热α-淀粉酶在70 ℃水解1 h,加入过量糖化酶,55 ℃水解2 h,离心(3 000 r/min,30 min),水洗离心多次,最后用95%乙醇清洗,干燥,粉碎,过200目筛,得纯抗性淀粉,供试验用。
1.3 检测方法
平均聚合度测定采用碘吸收法[14];扫描电子显微分析和酶解率按参考文献[15]的方法测定;X-射线衍射分析与差示扫描量热分析采用参考文献[16]的方法;溶解度按参考文献[10]的方法进行。
所有数据为3个平行试验的平均值,且采用SPSS 20.0 for windows进行方差分析。
2 结果与分析
2.1 几种抗性淀粉的平均聚合度
直链淀粉-碘络合物在600 nm左右出现最大光吸收λmax,且与直链淀粉分子质量密切相关,因而可以在一定程度上反应淀粉的分子特征[17]。表1为4种原淀粉及其抗性淀粉的最大吸收波长λmax、平均聚合度DP及其直链淀粉含量。由表1可以看出,每种抗性淀粉中直链淀粉含量比其原淀粉中直链淀粉含量都增加了1倍以上,相反它们的λmax和DP值都比其原淀粉的小,特别是DP值发生了显著变化。这是由于在制备过程中,高温、高压使部分直链淀粉分子断裂,支链淀粉的部分支链断裂转化为直链淀粉,故而抗性淀粉的分子聚合度要比其原淀粉的小;同时直链淀粉分子越大,越容易断裂,这就是绿豆原淀粉DP明显较大而其抗性淀粉DP显著变小的原因。
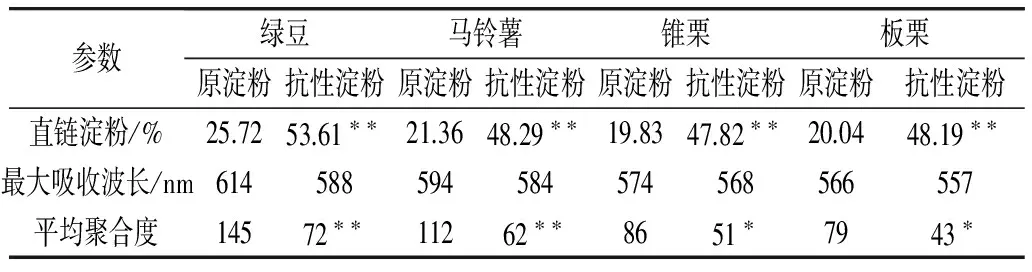
表1 几种原淀粉和抗性淀粉的平均聚合度
注:*表示影响显著,0.01 绿豆、马铃薯、锥栗和板栗原淀粉及其抗性淀粉的微观结构如图1所示。从图1可看出,4种原淀粉颗粒完整,呈不规则球形或椭球形,表面光滑,长直径主要分布范围为5~40 μm之间;经压热制备的4种抗性淀粉结构相似,但它们的结构较之原淀粉发生了显著改变,颗粒状结构消失,取而代之为不规则呈片层状堆积的晶体结构,表面有少许坑洼。造成这种变化可由制备过程解释,在糊化过程中,直链淀粉先从原淀粉颗粒中溶出,进入水中,冷却时,直链淀粉分子相互靠近依靠氢键及范德华力形成双螺旋并沉降,形成非常稳定的晶体[18];在纯化过程中,粗抗性淀粉中的无定形部分被酶解,剩下高度结晶的直链淀粉。 图1 几种原淀粉及其抗性淀粉的超微结构(放大3 000倍) 根据X射线衍射图谱,将淀粉分为A、B、C和V几种类型:A型在衍射角15°、17°、18°和23°有较强的衍射峰;B型在衍射角5.6°、17°、22°和24°有较强的衍射峰;C型在衍射角5.7°、15°、17°和23°有较强的衍射峰,是A型晶体和B型晶体的混合;V型在衍射角7.4°、13°和20°有较强的衍射峰[4,14]。图2为4种原淀粉及其抗性淀粉的广角X-射线衍射图谱,其结晶度及各型晶体的质量分数计算列于表2中。由图2和表2可看出,绿豆、马铃薯、锥栗和板栗原淀粉的晶型均为A型。4种抗性淀粉都发生了晶型变化,绿豆、马铃薯抗性淀粉的晶型由A型转变为B型晶体,结晶度升高;锥栗、板栗抗性淀粉的晶型由A型转变为V型,结晶度降低。从表2还可看出,尽管绿豆、马铃薯抗性淀粉中A型晶体仍占有较大比例,且较之相应的原淀粉稍有减少,但B型晶体所占比例显著增加;锥栗、板栗抗性淀粉中A型晶体所占比例较之原淀粉明显减少,B型晶体也有一定减少,而V型晶体则出现极显著的增加。由此可以说明,这4种原淀粉在制备抗性淀粉的过程中,其分子链通过断裂、重组,形成了更为稳定的晶体结构[5],且B型晶体相对比V型晶体更为稳定[19],也即绿豆与马铃薯抗性淀粉的晶体结构比锥栗和板栗抗性淀粉的牢固,这在溶解性、酶解性和热特性等方面都得到了很好的体现。 图2 几种原淀粉及其抗性淀粉的X-射线衍射图谱 晶体类型绿豆马铃薯锥栗板栗原淀粉抗性淀粉原淀粉抗性淀粉原淀粉抗性淀粉原淀粉抗性淀粉A14.9512.7915.0612.0217.083.19∗∗17.224.85∗∗B7.9915.10∗∗8.1015.97∗∗12.519.51∗12.637.88∗V2.782.492.861.151.5415.63∗∗1.9215.45∗∗结晶度25.7330.38∗26.5229.14∗31.1328.3431.7728.19 图3a反映了绿豆、马铃薯、锥栗和板栗的原淀粉及其抗性淀粉在水中的溶解度。从图3a可知,绿豆、马铃薯、锥栗和板栗原淀粉的溶解度相差不大,但后2种抗性淀粉的溶解度达到前2种抗性淀粉的2倍多,说明前2种抗性淀粉的结晶结构更为稳固,这与2.3中的结论一致。另外,4种抗性淀粉的溶解度明显要小于相应原淀粉的溶解度。这是由于在压热-冷却循环法制备RS3过程中,直链淀粉先从淀粉颗粒中游离出来,同时因高温作用,部分支链淀粉发生降解,增加了淀粉乳液中直链淀粉的含量,在冷却阶段,直链淀粉分子又重新取向、排列,形成致密的结晶结构[4-5]。 图3b为人唾液α-淀粉酶对抗性淀粉的酶解作用。由图3b可看出,经α-淀粉酶消化6 h后,4种原淀粉的酶解率都大于90%,说明淀粉中可消化成分已基本消耗掉,继续延长消化时间酶解率也不会有大的增幅;4种抗性淀粉的消化率均未达到10%,远低于相应的原淀粉。因此,4种抗性淀粉对人唾液α-淀粉酶具有较强抗性。从图3b还可看出,4种原淀粉的酶解率相差无几,但锥栗和板栗抗性淀粉的酶解率则为绿豆与马铃薯抗性淀粉的2倍多,这进一步说明绿豆与马铃薯抗性淀粉的结晶结构比锥栗和板栗抗性淀粉的更为稳固。 注:A1-绿豆原淀粉,A2-绿豆抗性淀粉,B1-马铃薯原淀粉,B2-马铃薯抗性淀粉,C1-锥栗原淀粉,C2-锥栗抗性淀粉,D1-板栗原淀粉,D2-板栗抗性淀粉。 图3 几种原淀粉及其抗性淀粉的溶解度和酶解率 图4为绿豆、马铃薯、锥栗和板栗的原淀粉及其抗性淀粉的差示扫描量热图,其糊化参数见表3。从图4及表3可以看出,绿豆、马铃薯、锥栗和板栗4种原淀粉的TP、Tc相差无几,尽管前2种原淀粉的TO比后2种原淀粉的略高,但后2种原淀粉的ΔH则明显高于前2种原淀粉的ΔH,这是由于锥栗和板栗原淀粉的结晶度比绿豆与马铃薯原淀粉的高,且其中结合最为牢固的B型晶体所占的比例更大。另外,绿豆与马铃薯抗性淀粉的TO、TP、Tc值均高于锥栗和板栗抗性淀粉的TO、TP、Tc值,但4种抗性淀粉的ΔH值差别不大,这可能是绿豆与马铃薯抗性淀粉中A型晶体仍然占有更大比例的缘故。由图4还可看出,绿豆与马铃薯抗性淀粉的TO、TP、Tc、ΔH值比其原淀粉的TO、TP、Tc、ΔH值高得多,这是由其晶体结构中结合更为紧密的B型晶体比例显著增加所致;锥栗与板栗抗性淀粉的TO、TP、Tc值较之原淀粉的TO、TP、Tc值有明显增高,但ΔH值几无变化。4种抗性淀粉的糊化温度之所以增高,是因为抗性淀粉在制备过程中直链淀粉形成更为致密的结晶结构,导致破坏该晶体结构需要的温度更高[9,19]。 图4 几种原淀粉及其抗性淀粉的差示扫描量热图谱 表3 几种原淀粉及其抗性淀粉的融化参数 [1]Rodríguez-Cabezas M E, Camuesco D, Arribas B, et al. The combination of fructoologosaccharides and resistant starch shows prebiotic additive effects in rats [J]. Clinical Nutrition, 2010, 29: 832-839 [2]Fuentes-Aaragozae E, Riquelme-Navarrete M J, Sánchez-Zapata E, et al. Resistant starch as functional ingredient: a review[J]. Food Research International, 2010, 43: 931-942 [3]郭秀兰, 唐仁勇. 抗性淀粉营养特性及生物学作用的研究进展[J]. 食品研究与开发, 2011, 32 (10): 165-169 [4]Lopez-Rubio A, Flanagan B M, Gilbert E P. Molecular rearrangement of starch during in vitro digestion: toward a better understanding of enzyme resistant starch formation in processed starches [J]. Biomacromolecules, 2008, 9 (7): 1951-1958 [5]Mutungi C, Onvango C, Doert T, et al. Long-and short-range structural changes of recrystallised cassava starch subjected to in vitro digestion[J]. Food Hydrocolloids, 2011, 25 (2): 477-485 [6]Jiranuntakul W, Puttanlek C, Rungsardthong V, et al. Microstructural and physicochemical properties of heat-moisture treated waxy and normal starches [J]. Journal of Food Engineering, 2011, 104: 246-258 [7]Sankhon A, Yao W R, Wang H Y, et al. The yield of improvement of resistant starches from Africa Locust (Parkiabiglobosa): the influence of heat-moisture, autoclaving-cooling and cross-linking treatments [J]. American Journal of Food Technology, 2012, 7(7): 386-397 [8]别同玉, 许加生, 别同德. 我国抗性淀粉制备工艺研究进展[J]. 高分子通报, 2011, 23(5): 34-40 [9]Li S L, Ward R, Gao Q Y. Effect of heat-moisture treatment on the formation and physicochemical properties of resistant starch from mung bean (Phaseolusradiatus) starch[J]. Food Hydrocolloids, 2011, 25 (6): 1702-1709 [10]赵力超, 杜征, 刘欣, 等. 慈姑抗性淀粉的理化特性研究[J]. 食品科学, 2010, 31(7): 55-59 [11]Lehmann U, Jacobasch G, Schmiedl D. Characterization of resistant starch type III from banana [J]. Journal of Agricultural and Food Chemistry, 2002, 50(18): 5236-5240 [12]曾红华, 谢涛, 杨莉, 等. 几种薯类与豆类抗性淀粉的的抗消化性及其益生效应[J]. 中国粮油学报, 2012, 27(11): 30-34 [13]Perera A, Meda V, Tyller R T. A review of analytical protocols for determining resistant starch and of factors affecting the resistant starch content of foods [J]. Food Research Interntational, 2010, 43: 1959-1974 [14]Takeda C, Takeda Y, Hizukuri S. Physicochemical properties of lily starch[J]. Cereal Chemistry, 1983, 60 (1): 212-216 [15]Sushil D, Ashok K S, Michael J G. Effect of cryo-milling on starches: functionality and digestibility [J]. Food Hydrocolloids, 2010, 24 (1): 152-163 [16]谢涛, 张淑远, 王美桂, 等. 重结晶红薯淀粉体外消化前后益生作用与结构变化[J]. 农业机械学报, 2013, 44 (8): 203-208 [17]邬应龙, 王瑶. 抗性淀粉的结构及生理功能研究[J]. 中国粮油学报, 2009, 23(3): 63-72 [18]Zou X, Yang J Z, Su D P, et al. The high-temperature resistant mechanism of α-starch composite binder for foundry[J]. Journal of Materials Processing Technology, 2009, 209: 5394-5398 [19]Mutungi C, Rost E, Onyango C, et al. Crystallinity, thermal and morphological characteristics of resistant starch type Ⅲ produced by hydrothermal treatment of debranched cassava starch[J]. Starch-Starke, 2009, 61 (11): 634-645. Main Physicochemical Properties of 4 Resistant Starches Xie Tao1Zeng Honghua1,2 Wang Jie1,2Yi Cuiping2 (College of Chemical Engineering, Hunan Institute of Engineering, Xiangtan 411104) (College of Chemistry and Biology Science, Changsha University of Science & Technology, Changsha 410015)2.2 几种抗性淀粉的超微结构

2.3 几种抗性淀粉的结晶特性


2.4 几种抗性淀粉的溶解度与酶解率

2.5 几种抗性淀粉的热特性
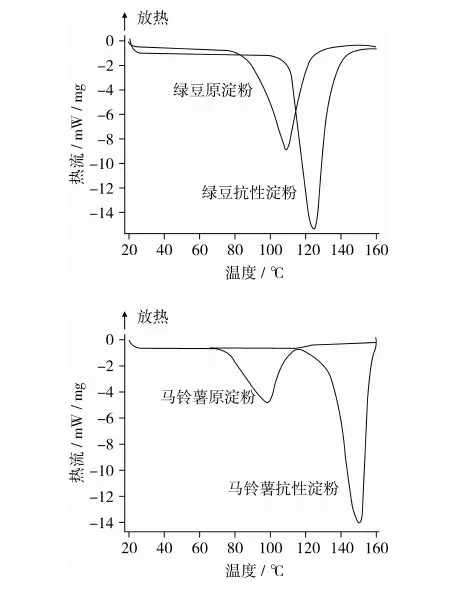

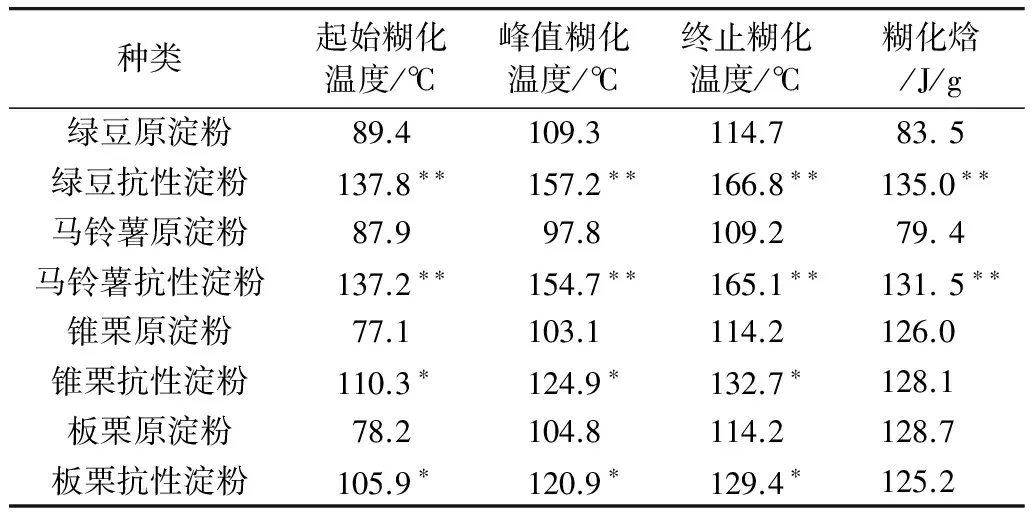
3 结论
3.1 4种抗性淀粉的λmax和DP值都比其原淀粉的小,特别是DP值发生了显著变化。4种抗性淀粉的结构相似,为不规则片层状堆积结构,且表面有少许坑洼。
3.2 4种抗性淀粉均发生了晶型转变。绿豆、马铃薯抗性淀粉颗粒为B型晶体,结晶度升高,特别是B型晶体所占比例显著增加;锥栗、板栗抗性淀粉颗粒为V型晶体,其中V型晶体显著增加。
3.3 4种抗性淀粉的溶解率/溶解度较之原淀粉的显著降低,且绿豆、马铃薯抗性淀粉的溶解率/溶解度比锥栗和板栗抗性淀粉的低。4种抗性淀粉对人唾液α-淀粉酶具有较强的抗性,且绿豆与马铃薯抗性淀粉具有更好的酶抗性。
3.4 4种抗性淀粉的ΔH值差别不大,但绿豆与马铃薯抗性淀粉的TO、TP、Tc值均要高于锥栗和板栗抗性淀粉的TO、TP、Tc值。绿豆与马铃薯抗性淀粉的TO、TP、Tc、ΔH值比其原淀粉的TO、TP、Tc、ΔH值要高得多,而锥栗与板栗抗性淀粉的TO、TP、Tc值较之原淀粉的TO、TP、Tc值稍有增高,但ΔH值几无变化。
