一株筛选自高寒草地木聚糖酶产生真菌的鉴定及酶学特性研究
2014-01-14芦光新陈秀蓉王军邦吴楚
芦光新 陈秀蓉 王军邦 吴楚
(1.青海大学农牧学院,西宁 810016;2.甘肃农业大学草业学院,兰州 730070;3.中国科学院地理科学与资源研究所,北京 100094;4.长江大学园艺园林学院,荆州 434025)
半纤维素是自然界中含量仅次于纤维素的第二丰富的多聚糖[1]。木聚糖是一种由 β-1,4-木糖苷键连接形成并带有多种取代基的多聚糖,结构中含有许多葡萄糖醛酸、乙酰基、阿拉伯糖、阿魏酸、香豆酸等侧链基团,是植物细胞壁半纤维素的主要成分[2],其完全降解需要多种酶的协同作用[3]。木聚糖 酶(endo-1,4-β-D-xylanohydrolase,EC3.2.1.8)以内切方式作用于木聚糖主链,产生不同链长的寡糖及少量的木糖,是一类能特异降解木聚糖的酶类,对半纤维素降解起着关键作用[3],在自然界各种微生物、植物、动物瘤胃等环境均有分布[4,5]。木聚糖酶大多为单亚基蛋白,分子质量 8-145 kD,根据催化域氨基酸序列及结构的相似性,木聚糖酶多被划分为糖苷水解酶第10 家族或第 11 家族,另外,第5 家族、第7 家族、第8 家族或第43 家族的木聚糖酶也有报道[6]。不同来源的酶,氨基酸组成差异较大,酶学性质也有所不同,酶的最适反应 pH 值多为偏酸性,最适反应温度 40-75℃[7],木聚糖酶的酶学性质决定了其在应用上的潜力及应用领域。木聚糖酶的工业化应用始于20 世纪80 年代,可用作纸浆和造纸工业中的生物漂白剂[8,9]、食品工业的改良剂[10]等,还可用来制备低聚木糖[11]。随着生物技术在工业中的发展,在食品加工、饲料生产、制浆造纸、能源工业等行业对木聚糖酶的需求越来越多[12,13]。无论其经济价值还是应用前景,对产木聚糖酶的资源的研究尤为重要。
在我国北方大部分农牧区,农作物秸秆的利用主要以燃料为主[14],也有部分经粉碎后用于饲料。但由于农作物秸杆细胞壁的结晶度较高,木质素、纤维素和半纤维素之间镶嵌形成坚固的酯键结构[15]和富含戊聚糖[16],降低了动物的采食率,同时也影响动物对脂肪和蛋白质的消化和吸收[17],这些因素均限制了农作物秸秆在饲料资源化方面的利用。研究发现,木聚糖酶可以作为饲料工业的添加剂[18],能够改善农作物饲料的性能,降解可溶性多糖,降低黏度,提高动物内源性消化酶活性的发挥,促进营养物质的消化吸收率[19]。因此,筛选产木聚糖酶的微生物资源,选育优良产酶菌株进行农作物秸秆的处理,无疑对提高农作物秸秆的利用效率提供了一个新的思路,并且对促进循环农业经济具有重大意义。
目前在农作物秸秆饲料化资源利用方面的研究较多,有学者也提出采用物理化学和生物处理相结合的方法,但由于生物处理过程中采用的菌株对产木聚糖酶的量、酶活性、营养条件、温度以及pH环境的要求较为苛刻,处理效果并不理想。尽管国内外对产生木聚糖酶的微生物资源方面做了大量的研究工作,但由于在工业化利用过程中,对木聚糖酶的活性及反应条件要求不同,目前得到的产木聚糖酶的菌种资源无法满足市场需求。从自然环境中分离筛选产木聚糖酶的微生物资源,仍然是相关学者努力突破的方向。为此,从提高秸秆饲料利用率的角度出发,以本课题组前期从高寒草地土壤中筛选出具有降解纤维素功能且能够高效产木聚糖酶活性的菌株为研究对象,对其分类地位进行鉴定,并对其液体培养过程中发酵粗酶液的酶学性质和主要生物学特性进行研究,旨在探索其在农作物秸秆饲料化利用的可行性和应用价值,为寻找高效降解农作物秸秆的菌种资源提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试菌株 由本课题组从东祁连山高寒草地土壤中分离获得,具有分解纤维素物质的能力,菌株编号为24d。
1.1.2 培养基[20]马铃薯葡萄糖培养基(PDA),用于供试菌株的转接和活化。马铃薯蔗糖培养基(PS),用于供试菌株菌丝的培养。察氏培养基,用于供试菌株在不同温度条件下生长速度的测定。
供试碳、氮源培养基:在察氏培养基中,分别按培养基总体积的1%配置不同碳源培养基,5 种碳源分别为糊精、可溶性淀粉、麦芽糖、葡萄糖和蔗糖;分别按培养基总体积的0.25%配置不同氮源培养基,5 种氮源分别为蛋白胨、尿素、硫酸铵、磷酸胺和硝酸钠。pH 调至6.0-7.0,每组设3 个重复,用于研究供试菌株对不同碳、氮源的利用程度。
液体产酶培养基[21]:NaNO32.5 g,KH2PO41.0 g,CaCl2·6H2O 0.1 g,MgSO40.3 g,NaCl 0.1 g,FeCl30.01 g,秸秆(粉)0.5 g,蒸馏水1 000 mL,pH 用稀盐酸调制6.0-7.0,用于测定供试菌株产木聚糖酶的酶活力。
1.2 方法
1.2.1 菌株活化 将保存的供试菌种接种于PDA 平板培养基,25℃恒温培养7-8 d 后,连续转接2-3 次,纯化、复壮。
1.2.2 菌株鉴定 经活化、纯化的菌株挑取少量菌丝接种于PS 液体培养基中,于25℃,150 r/min 摇床振荡培养,过滤后收集菌丝体,采用试剂盒法提取基因组DNA。以基因组DNA 为模板,利用一对rDNA-ITS 通用引物(ITS-1、ITS-4)进行PCR 扩增,扩增产物纯化后,送样测定DNA 序列。将测序获得的ITS 序列通过与GenBank 中的核酸数据库序列进行Blastn 分析,采用CLUSTAL 软件进行多重序列比对[22],并用MEGA 4.0 软件采用Neighbor-Joining 法 和UPGMA 法构建系统发育树[23,24]。ITS-1:5'-GTAGGTGAACCTGCGG-3',ITS-4:5'-TCCTCCGCTTATTGATATGC-3'。PCR 反应程序:95℃预变性5 min;95℃变性1 min,50℃复性1 min,72℃延伸1 min,35 个循环;72℃延伸10 min。基因组DNA 提取试剂盒(SK1375)、引物合成、序列测定均由上海生工生物工程有限公司完成。
1.2.3 生物学特性 参照Li 等[25]、曹春蕾等[26]的方法,在PDA 平板上将培养7-10 d 的供试菌株用直径6 mm 的打孔器切取菌饼,分别转接于测定不同内容的培养基中,25℃黑暗条件下培养(除温度处理试验),3 次重复,用十字交叉法测定菌落直径,以第7 天测定的菌落直径作为评定菌株生长速率的依据。温度对真菌生长的影响:分别于15℃、20℃、25℃、30℃、35℃和40℃等6 个温度培养。碳、氮源对真菌生长的影响:分别转接于含1%的不同碳源和0.25%的不同氮源培养基上培养。试验结束后测定供试菌株的菌落直径。
1.2.4 供试菌株产木聚糖酶特性的研究
1.2.4.1 绘制标准曲线 参照陆文清等[27]的方法,以吸光值(OD540)作横坐标,分别以对应的标准木糖溶液含糖的毫克数为纵坐标,列出直线回归方程,制作标准曲线(图1)。
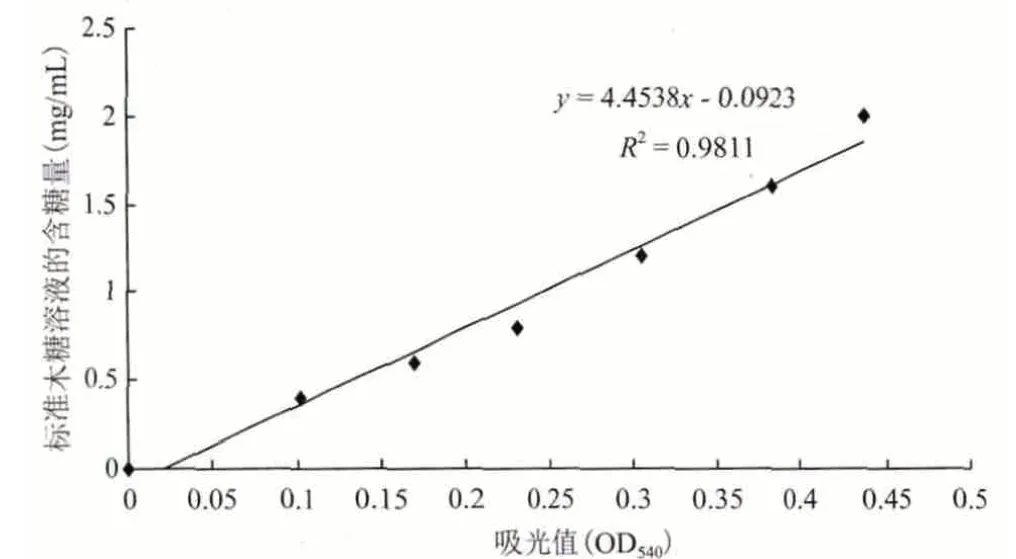
图1 以木糖为底物的标准曲线
1.2.4.2 粗酶液的制备 将活化的菌株分别接种于以0.5 g 油菜秸秆粉为底物,盛有50 mL 液体产酶培养基150 mL 的锥形瓶中,以不接菌为对照,每个处理重复3 次。在25℃ 150 r/min 条件下,置于摇床震荡培养,试验周期为7 d。试验结束后,经尼龙丝网过滤的发酵液,用灭菌的1 mL 移液器枪头,吸取2 mL 上清液,于4℃ 10 000 r/min,离心10 min,取上清液制备粗酶液。
1.2.4.3 木聚糖酶活力测定 木聚糖酶活力测定方法参照文献[28],稍有改进。吸取液体摇瓶发酵粗酶液0.2 mL,以1 mL 含0.5%的桦木木聚糖为反应底物的柠檬酸缓冲液(pH 5.5,终浓度为0.1 mol/L)组成反应体系,在37℃恒温水浴锅中反应30 min,采用DNS 法(3,5-二硝基水杨酸)测定最终反应产物在540 nm 波长下的吸光值[29],空白对照用等体积热变性的粗酶液代替新鲜的粗酶液。酶活力的计算方法参照国际理论应用化学协会(IUPAC)推荐的国际标准方法,分别以每毫升粗酶液每分钟产生1 μmol 木糖为一个国际单位,计IU/mL[30]。
1.2.4.4 木聚糖酶的最适温度、pH 值以及对pH值的稳定性 按照上述酶活力测定的方法,分别在4℃、10℃、15℃、20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃和70℃下测木聚糖酶活力,以温度(T)为横坐标,相对木聚糖酶活力为纵坐标作图(以酶活最高者为100%)。按同样的方法,以酶活力最大时的反应温度为酶催化活性最适温度,分别在pH2.0-10.0 条件下测木聚糖酶活力,以pH 为横坐标,相对木聚糖酶活力为纵坐标作图(以酶活最高者为100%)。以酶活力最大时的pH 值为酶催化活性最适pH。另外,将粗酶液在25℃条件下放置24 h 后,在不同pH 值条件下测定剩余酶活力,测定粗酶液对不同pH 环境的稳定性。1.2.5 数据处理及分析 所有数据均用Microsoft Excel 录入并作图,采用DPS 6.55 进行数据分析[31]。
2 结果
2.1 分子鉴定结果
以提取的供试菌株的基因组DNA 为模板、ITS-1-ITS-4 为引物进行PCR 扩增,扩增产物经0.8%琼脂糖凝胶电泳检测,扩增片段在500-750 bp 之间(图2)。测序结果在GenBank 中进行BLAST 同源性比较,采用Neighbor-Joining 法和UPGMA 法分别构建系统发育树。结果(图3)显示,供试菌株24d 与登录号AF455415、FJ914710、AJ972795 及UD4203 的同源性达100%,其中与菌株UD4203 的亲缘关系最近。UD4203 为Saccharicola bicolor,因此,供试菌株24 d初步确定为(Saccharicola bicolor)。

2.2 温度对菌株生长的影响
温度是影响微生物生长及其产酶的重要因素。由图4 可以看出,温度对供试菌株的生长速度的影响较为明显,在15-40℃温度范围内能够生长,超过此范围的上限(40℃),不能生长。从供试菌株的生长速度随温度变化的曲线来看,在15-35℃范围内,菌落直径随温度升高而逐渐增大,在35-40℃范围内,菌落直径随温度升高而变小,在30℃的生长速度高于40℃条件下的生长速度,其最适生长温度为35℃。
2.3 菌丝对多种碳源、氮源的利用情况
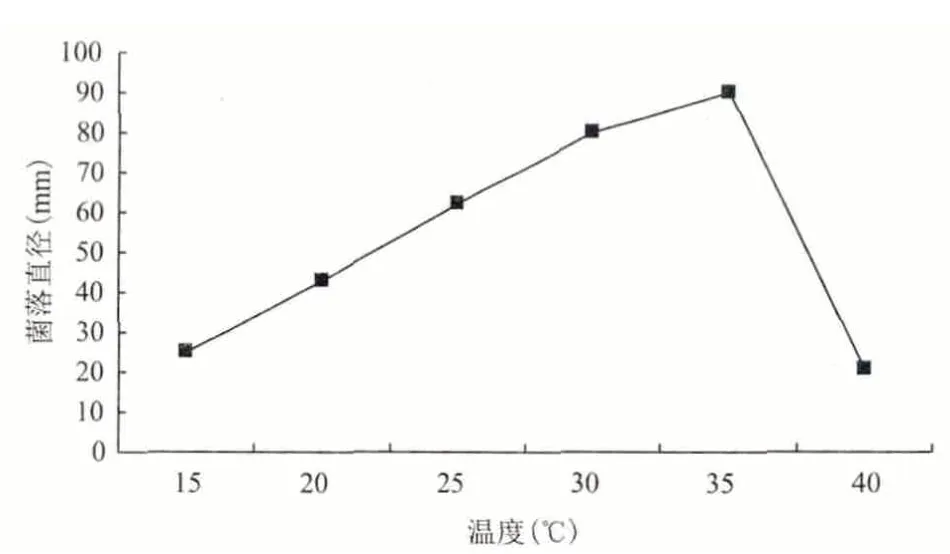
图4 温度对供试菌株生长的影响
碳、氮源是真菌维持生长的重要营养物质,它不仅可以提供能量来源,而且还可提供合成碳水化合物和氨基酸的原料,同时也是诱导真菌产酶的重要的物质。由表1 可以看出,供试菌株在糊精、蔗糖、麦芽糖、葡萄糖、可溶性淀粉等5 种供试碳源的培养基上培养7 d 后,菌落直径大小不尽相同,菌株在不同碳源的培养基上,表现出不同的生长速度。供试菌株对5 种碳源的利用表现为:麦芽糖>淀粉>蔗糖>糊精>葡萄糖。供试菌株在蛋白质、尿素、硫酸胺、磷酸胺、硝酸钠等5 种供试氮源的培养基上培养7 d 后,菌落直径大小不尽相同,菌株在不同氮源培养基上,表现出不同的生长速度。供试菌株对5 种氮源的利用表现为:蛋白质>磷酸胺>硫酸胺>硝酸钠>尿素。试验结果表明,供试菌株在5 种碳、氮源培养基上均可生长,说明供试菌能够利用的碳、氮源较广,不仅能利用单糖、低聚糖等速效碳源,而且还能利用淀粉、糊精等长效碳源,同时可以利用无机氮源,也能利用有机氮源。数据为x-±s(n=3);字母表示列比较;不同字母表示差异显著(P<0.05)
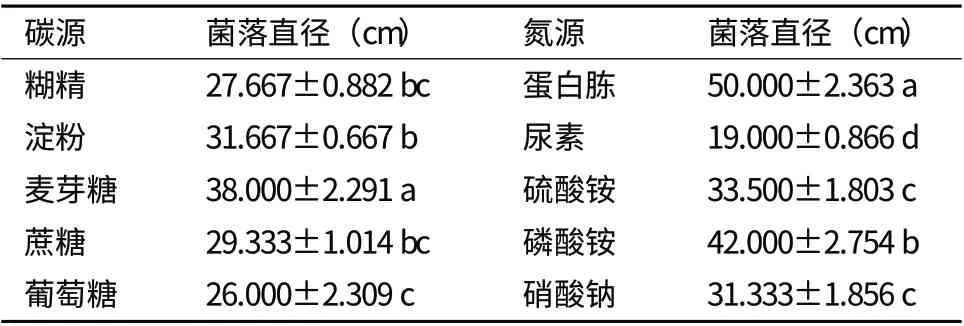
表1 不同碳、氮源对菌落生长速度的影响
2.4 供试菌株产木聚糖酶的酶活力及对温度和pH值的稳定性
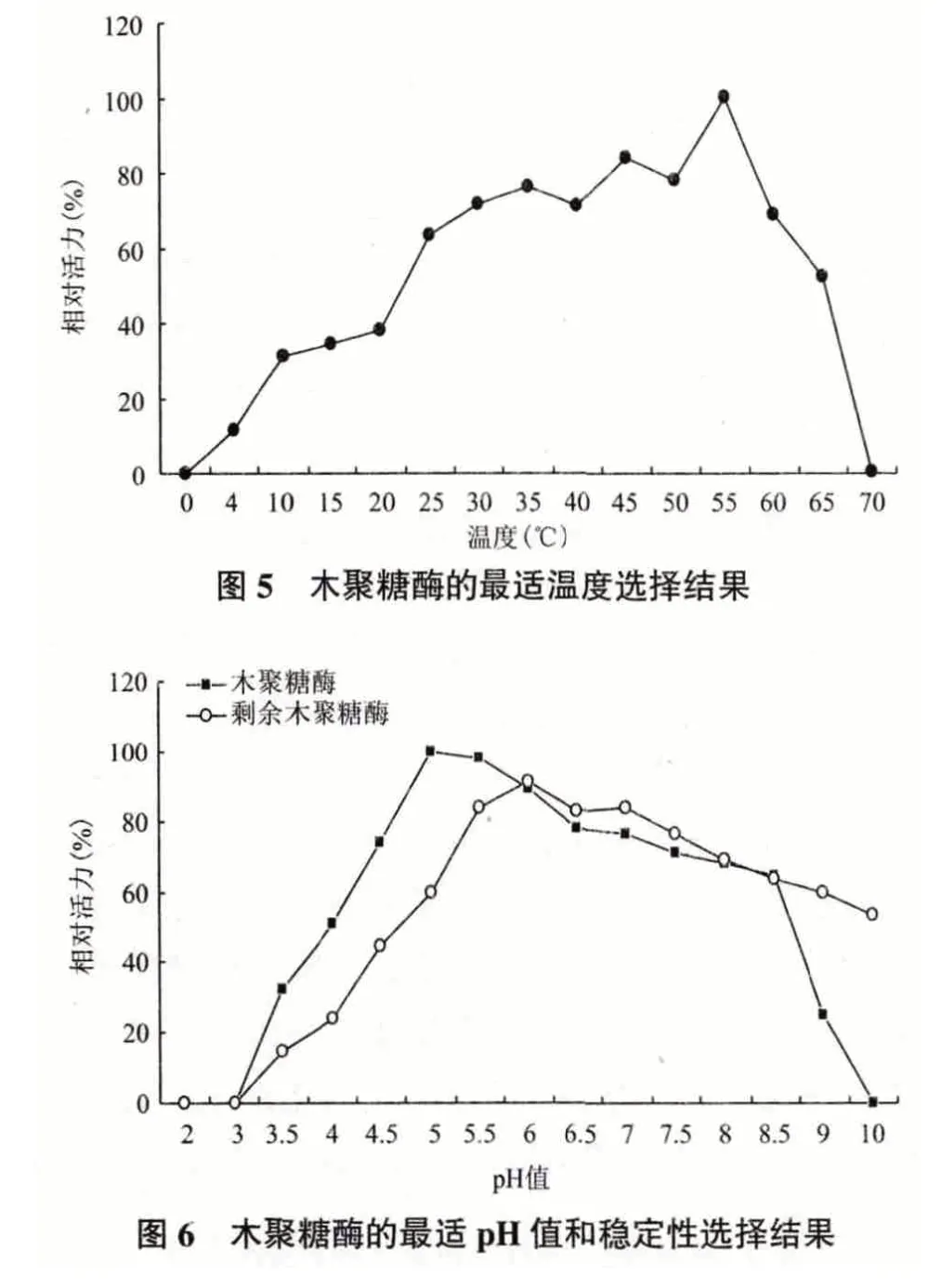
产木聚糖酶菌株24d 在不同温度下的酶活力试验(图5)表明,在40-60℃下有较高的催化活性,55℃时酶的催化活性达到最大值,超过55℃,相对酶活力下降非常明显。供试菌株产木聚糖酶的活性随温度的影响变化较大,供试菌株在温度相对低的条件下,其产生的木聚糖酶的相对酶活力较高。图6 显示,菌株24d 在pH4-8.5 范围内,酶的催化活性较高,酶反应最适pH 值为5.0,在pH3.0-9.5 范围内酶活较稳定,供试菌株产生的木聚糖酶有一定的耐碱性。
3 讨论
研究发现自然界中多种微生物均能够产生木聚糖酶,但不同来源的木聚糖酶的性质和功能具有异质性。从微生物木聚糖酶的最适作用pH 来划分,木聚糖酶可以分为3 类:(1)酸性木聚糖酶;(2)中性木聚糖酶;(3)碱性木聚糖酶。在 1973 年,Horikoshi 等[32]首次报道了产自细菌的木聚糖酶,从碱性细菌 Bacillus sp. No. C-59-2 中纯化出最适pH 为 6.0-8.0 的木聚糖酶。此后,研究得到很多碱性木聚糖酶,这其中大多属于芽孢杆菌属中分离得到的第10 和第11 家族的碱性木聚糖酶[33,34]。近年来细菌产木聚糖酶的研究取得了较大进展,获得了一些不同细菌来源的产耐碱性木聚糖酶菌株,但细菌来源耐碱性木聚糖酶不易分离和纯化,且稳定性较差,这些因素客观上制约了人们对细菌碱性木聚糖酶本质的认识,延缓了对这类酶的开发和利用[35]。相对于细菌产酶而言,真菌分泌的木质纤维素酶的酶系比较齐全,且大多数是胞外酶,其分离纯化相较于胞内酶而言稍显容易,且胞外酶性质稳定,但真菌所产生的木聚糖酶一般为酸性,最适 pH 多在 pH3.0-5.0[12]。目前报道较多的产木聚糖酶的真菌主要有曲霉属(Aspergillus)、木霉属(Trichoderma)、青霉属(Penicillium)、壳霉属(Chaetomium)和镰刀菌属(Fusarium)等[36]。工业化的木聚糖酶菌株多集中于曲霉属和木霉属,除此之外,研究发现,青霉属和镰刀菌属的木聚糖酶在具有极高纤维素酶的情况下也具有较高的木聚糖酶活力。上述有关真菌产木聚糖酶的研究多集中于酸性木聚糖酶[37,38]。
Taneja 等[39]筛选到一株嗜碱真菌Aspergillus nidulans KK299,并部分纯化了其所产的木聚糖酶,最适pH 为 8.0,在 pH4.0-9.5 之间稳定,这是最早报道的在碱性条件下有高活性的真菌来源的木聚糖酶。王坤等[40]从造纸废水中分离得到的耐碱真菌 Pseudallescheria sp. JSM-2,利用同源克隆和TAIL-PCR 的方法,获得了一个碱性木聚糖酶基因 xyl11-1。在毕赤酵母GS115 中重组表达后的酶学性质测定发现,重组XYL11-1 的最适 pH 为6.5,在 pH4.5-9.0 范围有50%以上的酶活,在pH4.5-12.0范围具有良好的pH 稳定性,且对中性和碱性蛋白酶具有极好的抗性。本研究获得的菌株S. bicolor 能够产生木聚糖酶,酶催化反应活性最适pH 值为5.0,但其在pH4.0-8.5 范围内有较高的酶活性,并且在pH3.0-9.5 范围内酶活性较稳定,说明供试菌株S. bicolor 产生的木聚糖酶具有一定的耐受碱性条件的能力。真菌吸收营养的方式主要有两种:(1)活养真菌主要通过菌丝吸收营养,供其自身的生长发育和细胞代谢,但这种类型多见于植物病原菌。(2)营腐生的真菌通过分泌降解酶分解有机物,获取营养物质。栖息于高寒草地土壤环境中的真菌生长速度很慢,通过菌丝吸收营养维持生命的可能性较小,而通过分泌木质纤维素酶降解有机物来吸收营养物质的可能性大。因此,供试菌株以后者来吸收营养的方式的可能性大。真菌分泌的酶的性质和酶活力也可能与栖息环境条件有关,但试验结果显示,供试菌株在低温条件下木聚糖酶的活性并不是很高,可能存在分泌其它耐低温降解酶分解有机质来吸收营养的机制。农作物秸秆主要以植物细胞壁为主,由大量的有机物(80%-90%)和少量的矿物质及水构成的,其有机物主要成分为粗纤维和无氮浸出物,还有少量的粗蛋白和粗脂肪,主要含有纤维素、半纤维素、木质素、多糖类、树胶、其他碳水化合物、蛋白质和其他含氮化合物[41]。采用碱化法和氨化法相结合处理农作物秸秆时会取得更好的效果[42],大量试验也证实添加一定比例的尿素可以提高秸秆干物质的降解率,可消化率和营养价值[43-48]。从本研究结果来看,供试菌株不仅能够利用尿素作为氮源,而且其产生的木聚糖酶在碱性环境下稳定性较好。由此可见,本研究获得的菌株在农作物秸秆饲料化资源利用方面具有一定的应用潜力。
已有的研究发现,用于木质纤维素降解的酶主要有羧甲基纤维素酶、滤纸糖酶等水解酶[49],但由于纤维素通常与木质素紧密链接,只有脱木质化后的纤维素才能够被微生物降解[50,51]。郝杰杰等[52]对马尾松(Pinus massoniana Lamb.)落叶分解的研究中也发现,链格孢(Alternaria sp.)、青霉(Penicillium sp.)、头孢霉(Cephalosporium sp.)、木霉(Tricherderma sp.)、拟盘多毛孢菌(Pestalotiopsis sp.)和烟曲霉(Aspergillus fumigatus)等6 种半知菌前期的降解主要依赖于羧甲基纤维素钠酶和滤纸酶,后期则通过木质素酶和纤维素酶协同作用来降解木质纤维素。曹春蕾等[53]研究发现,桑木层孔菌(Phellinus mori)拥有丰富的胞外酶系,包括淀粉酶、果胶酶、羧甲基纤维素酶和漆酶,各种胞外酶的酶活力随发酵时间而变化,不同酶的产生时间和酶活力有很大差异,认为胞外酶可以直接影响真菌对于营养物质的利用,其活性大小和生长状况密切相关。芦光新等[21]研究发现,多年生黑麦草(Lolium perenne L.)和白三叶(Trifolium repens L.)的凋落物在液体发酵过程中,能够诱导真菌无性腔胞纲真菌Microdochium bolleyi 分泌木质纤维素酶,包括漆酶、纤维素酶、木聚糖酶、邻苯二酚氧化酶和愈创木酚氧化酶,不同的凋落物诱导产酶活力大小不同,真菌分泌酶活力的高低和凋落物细胞壁物质降解率之间在一定程度上存在因果关系。司静和崔宝凯[54]也研究发现绒毛栓孔菌(Trametes pubescens)在发酵过程中胞外酶的活性变化,与菌丝体生长状况密切相关,不同的酶其分泌高峰期可以作为判断菌丝体营养利用情况和培养周期的依据。Atif 等[55]也研究指出,木质纤维素分解后产生的糖,对后续分解有阻遏作用。以上的研究说明,大多数真菌在降解木质纤维素的过程中会产生多种类型的降解酶系,通过这些酶的协同作用将木质纤维素类物质降解成小分子的化合物,并且生成的新的化合物会影响真菌的生长和再次诱导产酶过程,因此,纤维素类物质的组分和真菌的种类与真菌产酶类型和活性密切。
4 结论
筛选自高寒草地产木聚糖酶真菌Saccharicola bicolor 在15-40℃温度范围内能够生长,其最适生长温度为35℃;对5 种碳源利用情况的先后顺序为:麦芽糖>淀粉>蔗糖>糊精>葡萄糖,对5 种氮源利用情况的先后顺序为:蛋白质>磷酸铵>硫酸铵>硝酸钠>尿素。菌株S. bicolor 诱导后分泌的木聚糖酶在40-60℃下有较高的催化活性,55℃时酶的催化活性达到最大值,在pH4.0-8.5 范围内,酶的催化活性较高,酶反应最适pH 值为5.0,且在pH3.0-9.5 范围内酶活性较稳定,供试菌株产生的木聚糖酶有一定的耐碱性。
[1] Prade RA. Xylanases :from biology to biotechnology[J]. Biotechnology & Genetic Engineering Reviews, 1995, 13(12):101-131.
[2] Collins T, Gerday C, Feller G. Xylanases, xylanases families and extremophilic xylanases[J]. FEMS Microbiology Reviews, 2005, 29:3-23.
[3] Subramaniyan S, Prema P. Biotechnology of microbial xylanases:enzymology, molecular biology, and application[J]. Critical Reviews in Biotechnology, 2002, 22(1):33-64.
[4] Henrissat B. A classification of glycosyl hydrolases based on amino acid sequence similarities[J]. Biochemical Journal, 1991, 280(2):309-316.
[5] Kamble RD, Jadhav AR. Isolation, production and characterization of cellulase free-xylanase from Rhizopus sp.[J]. Asian Journal of Microbiology, Biotechnology and Environmental Sciences, 2010, 12(2):385-390.
[6] Henissat B, Bairoch A. New families in the classification of glycosyl hydrolases on amino acid sequence similarities[J]. Biochemical Journal, 1993, 293:781-788.
[7] Kulkarni N, Shendye A, Rao M. Molecular and biotechnological aspects of xylanases[J]. FEMS Microbiology Reviews, 1999, 23(4):411-456.
[8] Wong JG, Nelson SL, Saddler JN. Xylanase treatment for peroxide bleaching of oxygen delignified kraft pulps derived from three softwood species[J]. Journal of Biotechnology, 1996, 48:137-145.
[9] Vicuna R, Escobar F, Osses M. Bleaching of eucalyptus kraft pulp with commercial xylanases[J]. Biotechnology Letters, 1997, 19:575-578.
[10] Rouau X, El-Hayek ML, Moreau D. Effect of an enzyme preparation containing pentosanases on the bread-making quaky of flours in relation to changes in pentosan properties[J]. Journal of Cereal Science, 1994, 19:259-272.
[11] Patrice P, Michele G, Jean PL, et al. Enzymic production of oligosaccharides from corncob xylan[J]. Enzyme and Microbial Technology, 1991, 13(8):617-621.
[12] Polizeli MLTM, Rizzatti ACS, Monti R, et al. Xylanases from fungi:properties and industrial applications[J]. Applied Microbiology and Biotechnology, 2005, 67(5):577-591.
[13] Beg QK, Kapoor M, Mahajan L, et al. Microbial xylanases and their industrial applications:a review[J]. Applied Microbiology and Biotechnology, 2001, 56(3/4):326-338.
[14] 曹国良, 张小曳, 郑方成, 等.中国大陆秸秆露天燃烧清单[J].资源科学, 2006, 28(1):9-13.
[15] 宋新南, 房仁军, 王新忠, 等.油菜秸秆资源化利用技术研究[J].自然资源学报, 2009, 24(16):984-991.
[16] 石军, 陈安国.木聚糖酶生产与应用研究进展[J].饲料工业, 2001, 22(9):40-43.
[17] Teleman A, Tenkanen M, Jacobs A, et al. Characterization of 0-acetyl-(4-0-inethylglucurono)xylan isolated from birch and beech[J]. Carbohydrate Research, 2002, 337(4):373-377.
[18] Classen HL. Cereal grain starch and erogenous enzymes in poultry diets[J]. Animal Feed Science and Technology, 1996, 62:21-27.
[19] Kim JC, Simmins PH, Mullan BP, et al. The digestible energy value of wheat for pigs, with special reference to the post-weaned animal[J]. Animal Feed Science and Technology, 2005, 122(3):257-287.
[20] 方中达.植病研究方法[M].北京:科学出版社, 1996:122-154.
[21] 芦光新, 陈秀蓉, 杨成德, 等.一株纤维素分解菌的鉴定及对两种草坪草凋落物分解活性的研究[J].草业学报, 2011, 20(6):170-179.
[22] Thompson JD, Gibson TJ, Plewniak F, et al. The clustal X windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools[J]. Nucleic Acids Research, 1997, 25:4876-4882.
[23] Tamura K, Dudley J, Nei M, et al. MEGA4:Molecular evolutionary genetics analysis(MEGA)software version 4.0[J]. Molecular Biology and Evolution, 2007, 24:1596-1599.
[24] Larkin MA, Blackshields G, Brown NP, et al. Clustal W and clustal X version 2.0[J]. Bioinformatics, 2007, 23(21):2947-2948.
[25] Li CJ, Nan ZB, Li F. Biological and physiological characteristics of Neotyphodium gansuense symbiotic with Achnatherum inebrians[J]. Microbiological Research, 2008, 163:431-440.
[26] 曹春蕾, 崔宝凯, 戴玉成.桑木层孔菌液体培养条件的研究[J].生物技术通报, 2012(2):176-181.
[27] 陆文清, 何丽花, 曹云鹤.饲料用木聚糖酶活力测定的研究[J].饲料工业, 2009, 30(4):16-20.
[28] Bailey MJ, Biely P, Poutanen K. Interlaboratory testing of methods for assay of xylanase activity[J]. Journal of Biotechnology, 1992, 23(3):257-270.
[29] Miller GL. Use of dinitrosalicylic acid reagent for determination of reducing sugars[J]. Analytical Chemistry, 1959, 31:426-428.
[30] Ghose TK. Measurement of cellulose activities international union of pure and applied chemistry[J]. Chemphere, 1987, 59(2):257-268.
[31] 唐启元, 冯明光.实用统计分析及其DPS 数据处理系统[M].北京:科学出版社, 2002.
[32] Horikoshi K, Atsukawa Y. Xylanase produced by alkalophilic Bacillus No.C25922[J]. Agriculture Biology Chemistry, 1973, 3:2097-2103.
[33] Khasin A, Alchanati I, Shoham Y. Purification and characterization of a thermostable xylanase from Bacillus stearothermophilus T-6[J]. Applied Microbiology and Biotechnology, 1993, 59:1725-1730.
[34] Takami H, Nakasone K, Takaki Y, et al. Complete genome sequence of the alkaliphilic bacterium Bacillus halodurans and genomic sequence comparison with Bacillus subtilis[J]. Nucleic Acids Research, 2000, 28:4317-4331.
[35] Subramaniyan S, Prema P. Cellulase-free xylanases from Bacillus and other microorganisms[J]. FEMS Microbiology Reviews, 2000, 183:1-7.
[36] Dietmar H, Bernd N, Klaus D, et al. Production of fungal xylanases[J]. Bioresouce Technology, 1996, 58:137-161.
[37] Qin Y, He H, Li N, et al. Isolation and characterization of a thermostable cellulase-producing Fusarium chlamydosporum[J]. World Journal of Microbiology and Biotechnology, 2010, 26:1991-1997.
[39] Giselia F, Boer GB, Peralta RM. Production of xylanolytic enzyme by Aspergillus tamari in solid state fermentation[J]. FEMS Microbiology Reviews, 1999, 173:335-339.
[39] Taneja K, Gupta S, Kuhad RC. Properties and application of a partially purified alkaline xylanase from an alkalophilic fungus Aspergillus nidulans KK299[J]. Bioresource Technology, 2002, 85(1):39-42.
[40] 王坤, 罗会颖, 姚斌, 等.来源于耐碱真菌Pseudallescheria sp.JSM-2 的碱性木聚糖酶基因的克隆表达及其性质研究[J].生物技术进展, 2011, 1(1):61-67.
[41] Takashima S, Iikura H, Nakamura A, et al. Over production of recombinant Trichoderma reesei cellulases by Aspergillus oryzae and their enzymatic properties[J]. Biotechnology Letter, 1998, 65:163-171
[42] 石爱霞.农作物秸秆处理技术[J].中国畜禽种业, 2013, 6:73-74
[43] 王凯, 谢小来.农作物秸秆复合处理技术的研究进展[J].饲料博览, 2012, 2:14-17.
[44] 毛华明, 冯仰廉, 邓卫东.复合化学处理与成型加工工艺条件对秸秆营养价值影响的研究[J].中国饲料, 1999(7):8-9.
[45] 贺永惠, 王清华, 李杰.北方地区复合碱化和快速氨化玉米秸秆对羊瘤胃消化的影响[J].中国畜牧杂志, 2003, 39(5):29-30.
[46] 张文举, 薛正芬, 谭守仁, 等.氢氧化钙尿素复合处理芨芨草的效果研究[J].中国草食动物, 2005, 25(2):40-42.
[47] 鲁琳, 王晓霞, 闫贵龙, 等.氢氧化钙与尿素复合处理对小麦秸营养品质的影响[J].新饲料, 2007, 3:28-32.
[48] 曹玉风, 李英, 刘荣昌, 等.复合化学处理秸秆对肉牛生产性能的影响[J].中国草食动物, 2000, 2(1):13-16.
[49] Lee J. Biological conversion of lignocellulosic biomass to ethanol[J]. Journal of Biotechnology, 1997, 56:1-24.
[50] Boominathan K, Reedy CA. Fungal degradation of lignin[A]. In:Arora DS, Elander RP, Mukerji KG, et al. Handbook of applied mycology[C]. Marcel Dekker, New York, 1992, 4:763-782.
[51] Sugiura M, Hirai H, Nishida T. Purification and characterization of a novel lignin peroxidase fromwhite-rot fungus Phanerochaete sordida YK- 6241[J]. FEMS Microbiology Letters, 2003, 224:285-290.
[52] 郝杰杰, 宋福强, 田兴军, 等.几株半知菌对马尾松落叶的分解——木质纤维素酶的活性动力学[J].林业科学, 2006, 42(11):69-75.
[53] 曹春蕾, 崔宝凯, 秦问敏.桑木层孔菌液体培养过程中几种胞外酶活性的变化[J].菌物学报, 2011, 30:275-280.
[54] 司静, 崔宝凯.绒毛栓孔菌液体培养过程中胞外酶活性的研究[J].基因组学与应用生物学, 2012, 31:70-77.
[55] Atif HA, Yasmeen MI. Induction, production, repression and derepression of exoglucanase synthesis in Aspergillus niger[J]. Bioresource Technology, 2004, 94(3):311-319.
