回流法提取银杏叶总黄酮的研究
2014-01-14李新舟张怀宇许友玲
李新舟,张怀宇,许友玲
(福建师范大学闽南科技学院生命科学与化学系,福建 泉州362332)
银杏体内含有许多生物活性物质,可以抵御昆虫、细菌和真菌的侵入,银杏叶在中国作为传统的中草药已经有几千年的历史,受到国内外医学界的高度重视[1]。
早在20世纪60年代初,干银杏叶的丙酮-水(60∶40)提取物被用于治疗脑部供血不足,取得了非常显著的疗效且没有明显的副作用[2]。此后,其它国家相继致力于银杏制品的开发。现代科学研究证明,银杏叶含有200多种药用成分,其中黄酮和萜内酯是银杏叶中两类重要的生理活性物质,具有捕获自由基,抑制血小板活化因子,预防和治疗心、脑血管疾病、老年痴呆,扩张血管、降低血脂、抗衰老等药理作用[3-4]。进一步研究表明,银杏叶提取物还具有较强的抗肿瘤、抗寄生生物、抗病毒活性[5]。
近年来,银杏叶制剂与银杏叶粗提取物越来越多地用于保健食品及饮品。作者用乙醇回流法提取银杏叶总黄酮,考察料液比(g∶mL,下同)、乙醇体积分数、提取时间、提取温度等因素对银杏叶总黄酮提取率的影响,通过正交实验优化了银杏叶总黄酮提取工艺,并进一步研究了微波辅助对银杏叶总黄酮提取的影响。
1 实验
1.1 材料与试剂
银杏叶,山东临沂郯城。
槲皮素对照品;无水乙醇(AR),石油醚,5%亚硝酸钠,4%氢氧化钠,10%硝酸铝,4%盐酸,蒸馏水。
1.2 方法
1.2.1 银杏叶粉末的制备
将银杏叶清洗干净后于70℃烘干5~6h,然后用高速多功能粉碎机粉碎,过40目筛。取适量的银杏叶粉末用石油醚于50℃回流提取,去脂除杂,过滤,将滤渣风干,备用。
1.2.2 标准曲线的绘制
准确称取10mg槲皮素对照品,配制成0.1mg·mL-1的槲皮素标准溶液作为对照溶液。精密量取对照溶液0.5mL、1.0mL、1.5mL、2.0mL、2.5mL、3.0mL分别置于50mL容量瓶中,加30%乙醇至10 mL,加0.5mL 5%亚硝酸钠溶液,摇匀,静置5min后加0.5mL 10%硝酸铝溶液,摇匀,静置6min后加10 mL 4%氢氧化钠溶液,用30%乙醇定容至刻度,摇匀,静置5~10min后测定吸光度,平行测定3次,以吸光度(A)为横坐标、槲皮素质量浓度(c)为纵坐标,绘制标准曲线[6]。
1.2.3 总黄酮含量的测定
银杏叶中总黄酮类活性成分的测定采用NaNO2-A1(NO3)3-NaOH络合-分光光度法。取0.5mL样品于25mL容量瓶中,分别加入0.5mL 5%亚硝酸钠溶液,摇匀,放置5min后加0.5mL 10%硝酸铝溶液,摇匀,放置6min后加10mL 4%氢氧化钠溶液,用30%乙醇定容至刻度,摇匀,放置5~10min后于510 nm波长处测定吸光度,平行测定3次,按下式计算银杏叶总黄酮提取率[[7-8]:

式中:c为总黄酮浓度,g·mL-1;V为提取液体积,mL;n为稀释倍数;m为样品质量,g。
1.2.4 单因素实验
准确称取1.0g样品粉末,置于磨口锥形瓶中,按不同的料液比加入不同体积分数乙醇、在一定温度下回流提取一定时间。抽滤,滤液离心,取上清液0.5mL,按照1.2.3方法测定吸光度,计算银杏叶总黄酮提取率。
1.2.5 正交实验设计
以单因素实验为基础设计正交实验[9]。以料液比(A)、乙醇体积分数(B)、提取时间(C)、提取温度(D)为考察因素,采用4因素3水平进行L16(34)正交实验优化银杏叶总黄酮的提取工艺[10-12],正交实验的因素与水平见表1。
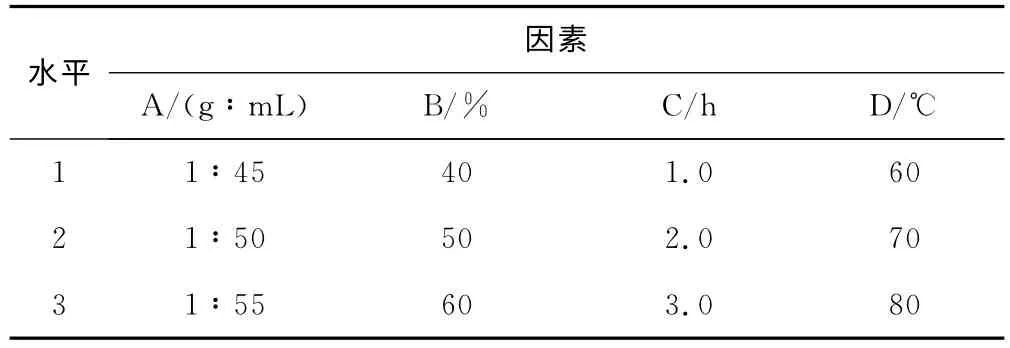
表1 正交实验的因素与水平Tab.1 Factors and levels of orthogonal experiment
1.2.6 微波辅助提取方法
准确称取1.0g样品粉末,置于磨口锥形瓶中,按照正交实验优化的料液比加入相应体积分数的乙醇。选择5种不同微波功率进行间歇式提取15次,每次10s。测定银杏叶总黄酮的含量,考察间歇式微波辅助提取对提取率的影响。
2 结果与讨论
2.1 单因素实验结果
2.1.1 料液比对银杏叶总黄酮提取率的影响
准确称取银杏叶粉末1g,按1∶25、1∶35、1∶40、1∶50和1∶55的料液比加入50%乙醇,在60℃下回流提取3.0h,经纯化后测定吸光度,计算总黄酮提取率,结果见图1。
由图1可知,总黄酮提取率随着料液比的减小(即提取剂用量的增加)而增大,料液比为1∶50时,总黄酮提取率最大,进一步增加提取剂用量,总黄酮提取率反而减小。增加提取剂的用量,物料体系与提取剂体系间的浓度差加大,有利于黄酮类物质的溶出;但过多的提取剂降低了银杏叶总黄酮的浓度,使总黄酮的不稳定性增大从而容易损失,反而导致总黄酮提取率减小。
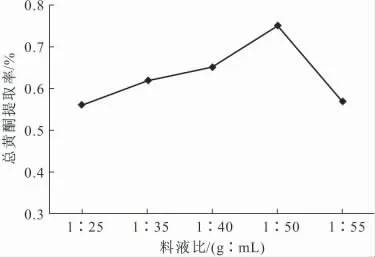
图1 料液比对总黄酮提取率的影响Fig.1 The effect of solid-liquid ratio on the flavonoids extraction rate
2.1.2 乙醇体积分数对银杏叶总黄酮提取率的影响
准确称取银杏叶粉末1g,按1∶50的料液比分别加入体积分数为40%、50%、60%、70%和80%的乙醇,在60℃下回流提取3.0h,经纯化后测定吸光度,计算总黄酮提取率,结果见图2。

图2 乙醇体积分数对总黄酮提取率的影响Fig.2 The effect of volume fraction of ethanol on the flavonoids extraction rate
由图2可知,总黄酮提取率随着乙醇体积分数的增大而增大,乙醇体积分数为50%时,总黄酮提取率最大;当乙醇体积分数超过50%后,总黄酮提取率反而减小,至70%以后保持不变。可能的原因是高体积分数的乙醇更有利于黄酮类物质的溶解,同时高体积分数的乙醇对细胞的破坏性更强,有利于溶液渗透至物料中。然而,过高的乙醇体积分数可能增加脂溶性物质的溶出,导致总黄酮提取率减小。
2.1.3 提取时间对银杏叶总黄酮提取率的影响
准确称取银杏叶粉末1g,在水浴温度为60℃、乙醇体积分数为50%、料液比为1∶50的条件下,分别回流提取1.5h、2.0h、2.5h、3.0h、3.5h,纯化后测定吸光度,计算总黄酮提取率,结果见图3。
由图3可知,总黄酮提取率随提取时间的延长而增大,提取时间为3.0h时,提取率最大,之后提取率反而减小。
2.1.4 提取温度对银杏叶总黄酮提取率的影响
准确称取银杏叶粉末1g,乙醇体积分数为50%、料液比为1∶50,分别在40℃、50℃、60℃、70℃、80℃下回流提取3.0h,纯化后测定吸光度,计算总黄酮提取率,结果见图4。
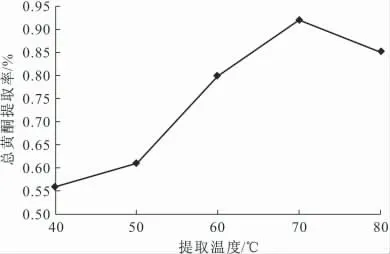
图4 提取温度对总黄酮提取率的影响Fig.4 The effect of extraction temperature on the flavonoids extraction rate
由图4可知,随着提取温度的升高,总黄酮提取率逐渐增大;提取温度为70℃时,提取率最大;提取温度超过70℃后,总黄酮提取率反而减小。这是因为,随着提取温度的升高,溶剂分子的运动加快,黄酮类物质溶出增加,但黄酮类物质作为一类具有抗氧化活性的物质,在高温条件下,其结构被氧化破坏的速度也会加快;同时溶出的部分蛋白质在高温下易变性与黄酮类物质发生共沉淀,导致总黄酮提取率减小。
2.2 正交实验结果与分析(表2)
由表2可以看出,提取温度对银杏叶总黄酮提取率的影响最大,其次是乙醇体积分数,料液比和提取时间的影响最小;最佳组合为A1B2C2D2,即料液比1∶45、乙醇体积分数50%、提取时间2.0h、提取温度70℃,在此条件下,银杏叶总黄酮提取率达到0.918%。
2.3 微波辅助对银杏叶总黄酮提取的影响
2.3.1 微波功率对总黄酮提取率的影响
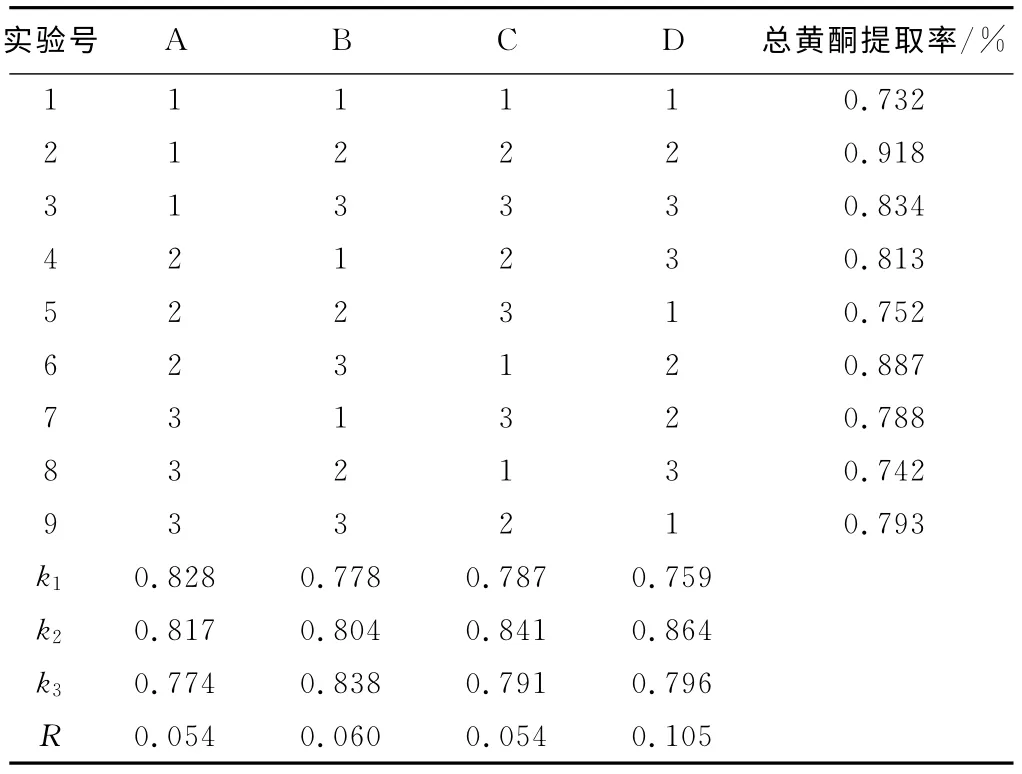
表2 L16(34)正交实验结果与分析Tab.2 The results and analysis of L16(34)orthogonal experiment
准确称取银杏叶粉末1g,在乙醇体积分数为50%、料液比为1∶45的条件下,分别用30W、240W、400W、640W和800W5种不同的微波功率进行微波辅助提取,纯化后测定吸光度,计算总黄酮提取率,结果见图5。

图5 微波功率对总黄酮提取率的影响Fig.5 The effect of microwave power on the flavonoids extraction rate
由图5可知,随着微波功率逐步增大,总黄酮提取率相应增大,在微波功率为640W时,总黄酮提取率最大;之后,总黄酮提取率减小。可能是因为,微波的加热作用使提取液温度升高,或是微波本身对黄酮类物质的破坏。因此,选择最适微波功率为640W。
2.3.2 微波间歇提取时间对总黄酮提取率的影响
准确称取银杏叶粉末1g,在微波功率为640W、乙醇体积分数为50%、料液比为1∶45、采用间歇式提取、每次10s的条件下,分别提取10次、15次、20次、25次、30次,纯化后测定吸光度,计算总黄酮提取率,结果见图6。
由图6可知,随着微波间歇提取时间的延长,提取率逐渐增大;微波间歇提取时间为15×10s时,提取率最大,为0.91%;进一步延长提取时间,提取率快速减小,可能是由于微波产生的高温或微波直接对黄酮的破坏。与传统方法相比,在相同提取条件下,采用微波提取在几分钟内的总黄酮提取率接近传统方法3h的提取率。表明微波辅助提取能大大缩短银杏叶总黄酮的提取时间,缩短提取周期。
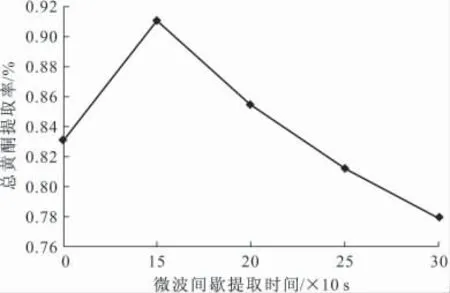
图6 微波间歇提取时间对总黄酮提取率的影响Fig.6 The effect of microwave intermittent extraction time on the flavonoids extraction rate
3 结论
研究了乙醇回流法提取银杏叶总黄酮的工艺条件。通过单因素实验考察了料液比、乙醇体积分数、提取时间、提取温度对银杏叶总黄酮提取率的影响,通过正交实验确定优化的提取工艺条件为:料液比1∶45(g∶mL)、乙醇体积分数50%、提取时间2.0h、提取温度70℃,在此条件下,银杏叶总黄酮提取率为0.918%。同时,本实验研究了微波辅助提取对银杏叶总黄酮提取的影响,在微波功率为640W、用50%乙醇按1∶45的料液比间歇提取15次、每次10s的条件下,银杏叶总黄酮提取率为0.91%,与传统的加热方法提取相比,大大地缩短了提取时间和提取周期。
[1]YOSHIKAWA T,NAITO Y,KONDO M.Ginkgo biloba leaf extract:Review of biological actions and clinical applications[J].Antioxidants & Redox Signaling,1999,1(4):469-479.
[2]SATI S C,JOSHI S.Antibacterial activities of Ginkgo biloba L.leaf extracts[J].The Scientific World Journal,2011,11:2237-2242.
[3]YAO X,SHANG E X,ZHOU G H,et al.Comparative characterization of total flavonol glycosides and terpene lactones at different ages,from different cultivation sources and genders of Ginkgo bilobaleaves[J].International Journal of Molecular Sciences,2012,13(8):10305-10315.
[4]姚渭溪.银杏叶中活性成分的提取工艺、测定及其进展[J].中草药,1995,26(3):157-159.
[5]ATZORI C,BRUNO A,CHICHINO G,et al.Activity of bilobalide,a sesquiterpene fromGinkgo biloba,on Pneumocystis carinii[J].Antimicrobial Agents and Chemotherapy,1993,37(7):1492-1496.
[6]高旗,张竞怡.微波提取陕南名茶中总黄酮的工艺研究[J].河北农业科学,2011,15(1):154-157.
[7]郭育东,马崇坚.苦瓜总黄酮提取工艺研究[J].安徽农业科学,2010,38(12):6501-6502.
[8]杜新,林年丰,张晶,等.黄花草木樨总皂苷提取工艺优化研究[J].特产研究,2013,21(2):35-39.
[9]袁琦,蒲晓辉,崔丽丽,等.回流法提取栾树果皮中总黄酮的正交实验研究[J].河南大学学报,2013,32(2):101-104.
[10]谢蓝华,杜冰,杨公明,等.正交试验优化酶法提取黄芪总黄酮工艺[J].包装与食品机械,2013,31(3):7-12.
[11]黄展,王晶.正交设计优化苦瓜多糖的超声提取工艺研究[J].黑龙江医药科学,2013,36(3):22-23.
[12]郝凤霞,杨敏丽.金银花中绿原酸和黄酮的同时提取分离工艺研究[J].食品科学,2009,30(20):211-214.
