三种马铃薯病毒多重RT-PCR检测体系建立
2014-01-14张威白艳菊罗丽环范国权高艳玲申宇张抒孟宪欣
张威,白艳菊*,罗丽环,范国权,高艳玲,申宇,张抒,孟宪欣
(1.黑龙江省农业科学院植物脱毒苗木研究所,哈尔滨 150086;2.黑龙江省农业科学院作物育种研究所,哈尔滨 150086)
三种马铃薯病毒多重RT-PCR检测体系建立
张威1,白艳菊1*,罗丽环2,范国权1,高艳玲1,申宇1,张抒1,孟宪欣2
(1.黑龙江省农业科学院植物脱毒苗木研究所,哈尔滨 150086;2.黑龙江省农业科学院作物育种研究所,哈尔滨 150086)
马铃薯卷叶病毒(PLRV)、马铃薯Y病毒(PVY)和马铃薯S病毒(PVS)是马铃薯生产田中发生率较高、危害较严重的病毒,通常复合侵染。研究通过综合评价和筛选,确定每种病毒的特异性引物,对PCR部分各试剂用量和反应程序进行优化,在同一体系中对三种病毒复合侵染的马铃薯材料进行多重RT-PCR扩增,得到长度分别为336、447、729 bp的3条特异性条带,建立能同时检测PLRV、PVY和PVS病毒的多重RT-PCR检测体系。应用该体系对田间样品进行检测,检测结果特异性强、灵敏度高,表明该多重RT-PCR体系能够同时检测三种马铃薯病毒。
马铃薯;PLRV;PVY;PVS;多重RT-PCR;检测
马铃薯病毒病严重影响马铃薯的产量和品质,马铃薯必须经过脱毒后才能用于生产。因此,如何通过有效方法快速、准确进行马铃薯病毒检测尤为重要。目前,已报道侵染马铃薯病毒有40余种[1-4],其中PVX、PVY、PVS、PLRV、PVA和PVM是导致马铃薯病毒病退化的重要病毒[5],而PLRV、PVY和PVS单一或复合侵染马铃薯发生比例均较高,分布广泛,导致马铃薯品质退化,产量降低,给马铃薯生产造成重大经济损失[6]。
马铃薯病毒的主要检测方法有传统指示植物方法、电子显微镜技术以及分子生物学方法,其中,RT-PCR技术以其灵敏度高、特异性强、检测速度快等优点而被广泛应用。为了在引进和推广马铃薯脱毒种薯的过程中准确、灵敏、高效地检测多种病毒的复合浸染,需要建立经济、高效的多重RT-PCR检测体系同步检测多种马铃薯病毒。本研究针对马铃薯田间PLRV、PVY和PVS病毒容易复合侵染现象,建立多重RT-PCR检测体系,通过对PCR部分各试剂用量和反应程序进行优化,建立能同时检测PLRV、PVY和PVS病毒的三重RT-PCR检测体系,该体系能同时检测田间复合侵染的三种马铃薯病毒。
1 材料与方法
1.1 材料
1.1.1 毒源材料来源
马铃薯毒源材料分别采自黑龙江、甘肃、山西、陕西、内蒙古、云南等主要马铃薯产区。应用英国Adgen公司生产DAS-ELISA检测试剂盒对样品进行PLRV、PVY和PVS病毒检测,样品存于-70℃冰箱保存备用。三种病毒阴、阳性对照由黑龙江省农业科学院植物脱毒苗木研究所提供。
1.1.2 主要试剂
大肠杆菌Escherichia coliGM109由本实验室保存。TaqDNA聚合酶、RNA酶抑制剂、dNTP、pMD18-T、EcoRⅠ和SalⅠ均购自TaKaRa(大连)公司;M-MLV反转录酶购自Promeger公司;Trizol购自Invitrogen公司;B型质粒小样快速提取试剂盒和B型小量DNA片段快速回收试剂盒均购自北京博大泰克生物基因技术有限责任公司;其他试剂均为分析纯;引物合成及序列测定委托上海生工生物工程有限公司完成。
1.2 方法
1.2.1 引物的查找与筛选
从中、英文文献和国家标准中每种病毒查找多对引物,筛选出在每种病毒外壳蛋白(CP)保守区的引物,用Primer Premier 5.0和Oligo6软件进行评价,筛选可用的引物,再应用单重RT-PCR体系进行扩增,筛选出只能扩增得到特异性条带的引物。
再选择PLRV、PVY和PVS三重RT-PCR体系目的条带能有效区分开的引物,筛选Tm值较一致且兼容性较好的引物,每种病毒筛选一对特异性引物,具体见表1。
1.2.2 总RNA提取
称取0.05~0.1 g马铃薯叶片于-80℃预冷研钵中,加液氮充分研磨,迅速转入到无RNase的无菌1.5 mL离心管中,加入1 mL Biozol Extraction Reagent混匀,放置15 min;加入200 μL氯仿和300 μL苯酚溶液,振荡混匀,4℃,12 000 g,离心15 min;取上清液转移至无菌新1.5 mL离心管中,加入等体积异丙醇,振荡混匀,-20℃放置30 min;4℃,12 000 g,离心15 min,弃上清液,1 mL 75%乙醇洗涤沉淀,4℃,12 000 g,离心5 min,弃上清,自然干燥。加入30 μL DEPC水溶解沉淀,即得到总RNA,-80℃保存备用[12]。
1.2.3 单重RT-PCR
cDNA第一链:用M-MLV反转录酶合成,RNA预变性:取2.5 μL RNA,65℃8 min,冰上放置2 min;再加入1 μL 5×RT buffer,下游引物0.5 μL(100 ng·μL-1),1 μL dNTP(各2.5 mmol·L-1),0.5 μL M-MLV反转录酶(200 U·μL-1),0.125 μL RNase Inhibitor(40 U·μL-1),用DEPC-ddH2O补足至10 μL,混匀,短暂离心。反应程序:42℃水浴1 h,92℃灭活2 min,保存-20℃待用。
PCR反应体系:取2 μL cDNA,再加入2.5 μL 10×buffer,1.5 μL MgCl2(25 mmol·L-1),0.5 μL dNTP(各2.5 mmol·L-1),0.5 μL上游引物(100 ng·μL-1),0.5 μL下游引物(100 ng·μL-1),0.125 μLTaqDNA聚合酶(5 U·μL-1),用DEPC-ddH2O补足至25 μL。PCR反应程序:92℃预变性5 min;92℃变性30 s,55.5℃退火30 s,72℃延伸45 s,循环30次;72℃延伸8 min。取5 μL PCR产物用1.5%琼脂糖凝胶电泳分析结果。

表1 病毒特异性引物Table 1 Specific primers of viruses
1.2.4 多重RT-PCR
反应体系:取PLRV、PVY和PVS病毒的混合病叶提取总RNA,反转录合成cDNA,作为多重RT-PCR反应的模板,加入2 μL,10×buffer 2.5 μL,三种病毒上、下游引物(100 ng·μL-1)各0.5 μL。本研究对dNTPs、TaqDNA聚合酶、Mg2+浓度进行优化:dNTPs浓度选择0.1~0.6 mmol·L-1,TaqDNA聚合酶浓度选择0.01~0.04 U·μL-1,Mg2+浓度选择1.0~3.8 mmol·L-1。
PCR反应程序优化:92℃预变性5 min;92℃变性30 s,55.5℃退火30 s,72℃延伸时间设定(30、35、40、45、50、55 s),循环次数设定(30、35、40、45次);72℃延伸8 min。取5 μL PCR产物经1.5%琼脂糖凝胶电泳分析比较。
1.2.5 PCR产物克隆、序列测定与分析
将PCR扩增产物纯化后连接到pMD18-T载体上,转化到通过CaCl2法制备的GM109大肠杆菌感受态细胞中。挑取抗性单菌落,扩繁后,应用B型质粒小样快速提取试剂盒提取质粒,利用EcoRⅠ和SalⅠ对重组质粒进行鉴定。目的片段委托上海生工生物工程有限公司进行测定,采用DNAstar软件进行序列分析。
2 结果与分析
2.1 总RNA提取质量
本试验提取样品总RNA的OD260/OD280比值均在1.8~1.9范围内,表明植物组织中的酚类物质和蛋白质已基本去除,总RNA纯度较理想。从RNA电泳图可见28S和18S两条清晰的条带(见图1),说明本方法提取的总RNA未降解。
2.2 PLRV、PVY和PVS多重RT-PCR检测体系的初步建立
分别以感染PLRV、PVY和PVS的马铃薯叶片总RNA为模板,应用三种病毒的特异性引物进行单重RT-PCR扩增,分别得到长度为336、447、729 bp的3条特异性条带(见图2)。

图1 总RNA电泳Fig.1 Gel electrophoresis of total RNA
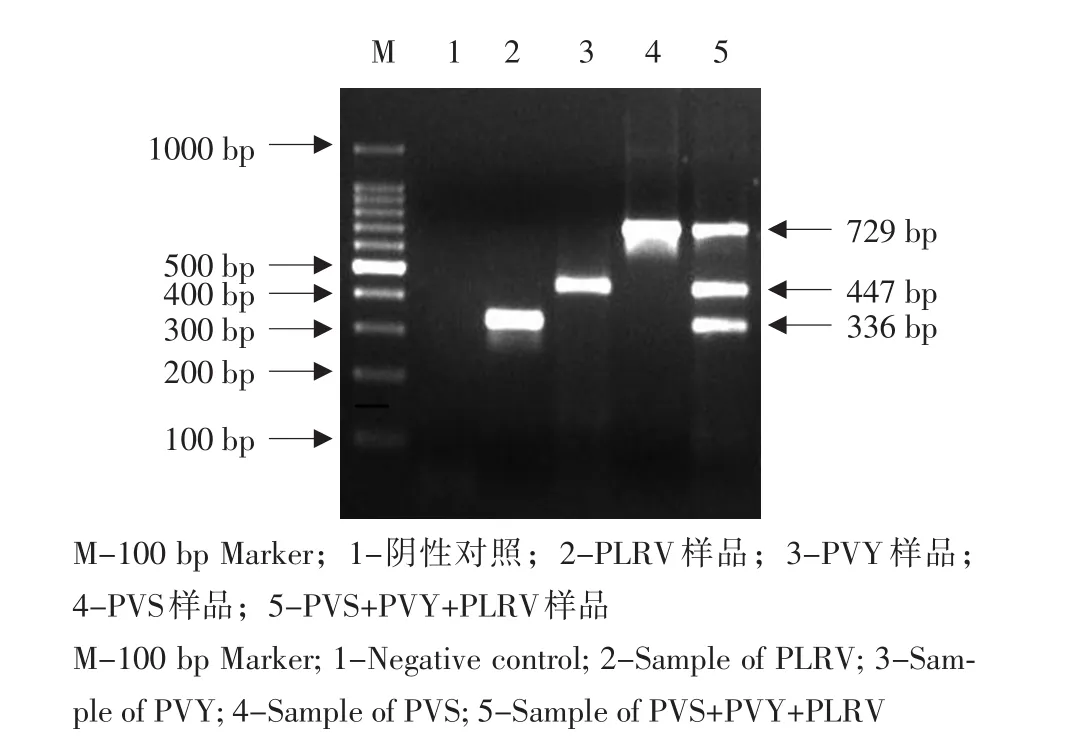
图2 PVY、PLRV和PVS多重RT-PCR检测体系的建立Fig.2 Multiplex RT-PCR detection system establishment of PVY,PLRV and PVS
将三种病毒的cDNA混合作为多重PCR反应的模板,多重PCR体系中dNTPs、TaqDNA聚合酶、Mg2+浓度分别初步选择为0.4 mmol·L-1、0.04 U·μL-1、3.4 mmol·L-1。从图2可以看出,泳道5扩增得到三种病毒的特异性条带,而阴性对照无此特异条带。
2.3 多重RT-PCR检测体系的优化
由于多重RT-PCR检测体系较单重复杂,为使该体系能达到检测稳定且节约成本的目的,本研究对影响多重PCR反应的主要试剂dNTPs、TaqDNA聚合酶、Mg2+浓度以及反应程序中的延伸时间和循环次数进行单因子优化试验。
2.3.1 dNTPs浓度梯度试验
本研究TaqDNA聚合酶浓度选择为0.04U·μL-1,Mg2+浓度选择为3.4 mmol·L-1,dNTPs浓度选择0.1~0.6 mmol·L-1,从图3可以看出,随着dNTPs浓度的增加,目的条带的亮度增加,但非特异性条带的亮度也有所增加,只有当dNTPs浓度在0.1 mmol·L-1时消除非特异性条带。因此,dNTPs浓度选择0.1 mmol·L-1。
2.3.2TaqDNA聚合酶浓度梯度试验
为使PCR扩增效率达到最高,必须保证反应体系中有足够量的TaqDNA聚合酶,本研究Mg2+浓度初步选择为3.4 mmol·L-1,dNTPs浓度选择优化后的0.1 mmol·L-1,将TaqDNA聚合酶浓度选择0.01~0.04 U·μL-1,从图4可以看出,随着TaqDNA聚合酶浓度的增加,目的条带的亮度增加,但当TaqDNA聚合酶浓度在0.03 U·μL-1时,目的条带亮,且基本消除非特异性条带。因此,TaqDNA聚合酶浓度选择0.03 U·μL-1。

图3 dNTP浓度梯度试验Fig.3 Concentration gradient experiments of dNTP
2.3.3 Mg2+浓度梯度试验
本研究dNTPs、TaqDNA聚合酶浓度均选择优化好的0.1 mmol·L-1、0.03 U·μL-1,Mg2+浓度选择1.0~3.8 mmol·L-1,从图5可以看出,当Mg2+浓度为2.6 mmol·L-1时,目的条带的清晰度最高,因此,Mg2+浓度选择2.6 mmol·L-1。
2.3.4 多重RT-PCR反应程序的优化
标准退火温度选择55.5℃,对延伸时间和循环次数进行优化。延伸时间设定30、35、40、45、50、55 s,循环次数设定30、35、40、45次,结果显示:延伸时间在30 s时较好,循环次数对体系无明显影响,综合考虑,延伸时间选择30 s,循环次数选择30次(图略)。
2.4 PCR产物的序列测定与分析
将多重RT-PCR扩增得到的PLRV、PVY和PVS产物纯化后,克隆到pMD18-T载体上,提取质粒,对重组质粒的插入片段进行序列测定,测序结果经DNAstar软件分析显示:PLRV、PVY和PVS扩增产物分别由336、447、729个核苷酸组成,与预期片段大小相同,序列与相应病毒序列同源性均在98%以上,证明多重RT-PCR检测结果的可靠性。
2.5 应用多重RT-PCR检测体系对田间样品进行检测
应用优化体系对黑龙江、甘肃、内蒙古等马铃薯主产区于2011~2013年采集的病叶进行检测,样品检测结果显示:PVY发生率较高,且多为复合侵染,PCR检测结果较DAS-ELISA灵敏度更高(见图6)。

图5 Mg2+浓度梯度试验Fig.5 Concentration gradient experiments of Mg2+
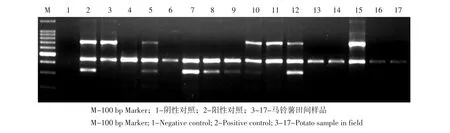
图6 多重RT-PCR检测田间样品结果Fig.6 Multiplex RT-PCR detection results of flied samples
3 讨论与结论
病毒检测技术的发展趋势是鉴定指标逐渐由宏观走向微观,鉴定过程从费工、费时转向快速、简便,鉴定精度由粗放到精确。传统检测方法是生物学检测,但此种方法检测周期长,检测准确性差,易受温度和环境条件影响。近年来DAS-ELISA方法为马铃薯病毒病的准确检测提供了有效手段,可大规模检测马铃薯病毒,但存在局限性,不适用于样品量较小的马铃薯试管苗及病毒浓度较低的马铃薯块茎样品检测。马铃薯试管苗作为源头,其质量重于各级种薯,脱毒是否彻底需要配套更灵敏检测技术。
近年来,RT-PCR检测技术以其灵敏度高、特异性强、检测速度快等特点在病毒检测上得到广泛应用,可弥补DAS-ELISA检测方法不足,对试管苗及薯块等病毒含量较低样品也可进行准确检测。尤其多重RT-PCR技术可同时检测多种病毒,提高检测效率,降低检测成本,多重RT-PCR技术已在多领域应用。代欢欢等应用多重RT-PCR技术检测3种番茄斑萎病毒属病毒[13],范旭东等应用多重RT-PCR技术检测3种苹果潜隐病毒[14]。本研究针对马铃薯生产田中发生率较高且容易复合侵染的PVS、PVY和PLRV病毒建立多重RT-PCR检测体系。
由于多重RT-PCR是在同一反应体系中对多个病毒进行特异性扩增,但并非单一RT-PCR简单混合,其稳定性没有单重RT-PCR高,需要针对引物、反应体系、反应程序进行综合优化和反复试验,才能使多重RT-PCR检测体系达到稳定状态。其中,引物选择对试验的成败起关键作用[15],既要使引物具有特异性,又要避免引物之间的相互影响。为使三种病毒的引物达到最佳组合,本研究PVS查找4对,PVY查找6对,PLRV查找4对;在GenBank上将每种病毒不同分离物的CP基因进行多序列比对,筛选出在保守区的引物,用Primer Premier 5.0和Oligo6软件进行评价,上述引物中可用引物PVS 3对,PVY 4对,PLRV 3对;应用单重RT-PCR体系对筛选出的引物作进一步验证,筛选出只能扩增得到特异性条带的引物,PVS 2对,PVY 3对,PLRV 2对;考虑到建立3重RT-PCR检测体系,目的条带长度要有效区分开,且要选择Tm值较一致且互相兼容的引物,最终每种病毒筛选到一对特异性引物。
为使多重体系达到检测稳定且节约成本的目的,本研究对影响多重PCR反应的主要试剂及反应程序进行单因子优化试验。为使PCR扩增效率达到最高,必须保证反应体系中有足够量dNTPs,当dNTPs浓度在0.1 mmol·L-1时扩增效果最佳,消除非特异性条带干扰。TaqDNA聚合酶是反应体系中费用最高试剂之一,为降低检测成本,在保证扩增效果的同时降低使用量,最终TaqDNA聚合酶浓度选择0.03 U·μL-1。Mg2+浓度影响TaqDNA聚合酶的活性,对PCR扩增效率影响很大,浓度过高可降低PCR扩增的特异性,浓度过低则影响PCR扩增产量甚至使PCR扩增失败而不出扩增条带,由试验可知,当Mg2+浓度选择2.6 mmol·L-1时目的条带清晰度最高。应用单重RT-PCR体系对三种病毒进行退火温度梯度试验,其中55.5℃是三对引物退火温度最佳温度。而延伸时间在30 s时较好,循环次数对体系无明显影响,最终建立稳定多重RTPCR检测体系。本研究应用多重RT-PCR体系对来自中国13个省马铃薯主产区的178份样品进行检测,检测结果与DAS-ELISA吻合,且灵敏度更高。突破以往RT-PCR检测技术只应用于研究领域,经本试验反复验证,该体系可降低检测成本,提高检测效率,完全可用于马铃薯病害田间检测,弥补现有技术不足。
[1]Jansky S,Jin L,Xie K,et al.Potato production and breeding in China[J].Potato Research,2009,52(1):57-65.
[2]Wang Q,Zhang W.An economic analysis of potato demand in China[J].American Journal of Potato Research,2010,87(3): 245-252.
[3]Wang B,Ma Y,Zhang Z,et al.Potato viruses in China[J].Crop Protection,2011,30(9):1117-1123.
[4]Gebhardt C,Valkonen J.Organizatioin of genes controlling disease resistance in the potato genome[J].Annual Review of Phytopathology,2001,39(1):79-102.
[5]李芝芳.中国马铃薯主要病毒图鉴[M].北京:中国农业出版社, 2004.
[6]张威,白艳菊,高艳玲,等.马铃薯主产区病毒病发生情况调查[J].黑龙江农业科学,2010(4):71-74.
[7]Crosslin J M,Hamlin L L.Standardized RT-PCR conditions for detection and identification of eleven viruses of potato and potato spindle tuber viroid[J].American Journal of Potato Research, 2011,88:333-338.
[8]孙琦,张春庆,孟昭东,等.马铃薯X、Y病毒的复合RT-PCR检测体系的建立[J].农业生物技术学报,2009,17(4):737-738.
[9]Nie X,Singh R P.A novel usage of random primers for multiplex RT-PCRdetection of virus and viroid in aphids,leaves,and tuber [J].Journal of Virological Methods,2001,91:37-49.
[10]Singh R P,Nie X Z,Singh M.Duplex RT-PCR:Reagent concentrations at reverse transcription stage affect the PCR performance[J].Journal of Virological Methods,2000,86:121-129.
[11]Nie X Z,Singh R P.Detection of multiple potato viruses using an oligo(dT)as a common cDNA primer in multiplex RT-PCR[J]. Journal of Virological Methods,2000,86:179-185.
[12]侯义龙,张开春,吴禄平,等.果树组织中总RNA提取的新方法[J].沈阳农业大学学报,2002,33(2):122-125.
[13]代欢欢,陈舜胜,杨翠云,等.3种番茄斑萎病毒属病毒多重RT-PCR检测方法的建立[J].上海农业学报,2012,28(3):32-36.
[14]范旭东,董雅凤,张尊平,等.3种苹果潜隐病毒多重RT-PCR检测体系的建立[J].园艺学报,2009,36(12):1821-1826.
[15]郑轩,成巨龙,赵震,等.五种烟草病毒TMV、CMV、TEV、PVY及TVBMV的多重RT-PCR同步检测[J].植物病理学报,2011,41 (2):146-153.
Establishment of multiplex RT-PCR system for detection of three potato viruses
ZHANG Wei1,BAI Yanju1,LUO Lihuan2,FAN Guoquan1,GAO Yanling1,SHEN Yu1,ZHANG Shu1,MENG Xianxin2(1.Institute of Virus-free Seedling Research,Heilongjiang Academy of Agricultural Sciences,Harbin 150086,China;2.Institute of Crop Breeding,Heilongjiang Academy of Agricultural Sciences,Harbin 150086,China)
The higher incidence and more serious viruses in potato field are potato leafroll virus (PLRV),potato virus Y(PVY)and potato virus S(PVS),and sometimes complexly infected.In this study,we found primers from Chinese and English documents,and national standards,through comprehensive evaluation and screening to determine the specific primers of each virus,at the same time,by optimization each reagent and response procedures of PCR,finally,the expected fragments of 336 bp(PLRV),447 bp(PVY)and 729 bp(PVS)were successfully amplified by the multiplex RT-PCR system,and the multiplex RT-PCR detection system of PLRV,PVY and PVS were established.This system was useful for simultaneous detection of these three viruses from field samples.Using the system to detect field samples,the results were specificity and high sensitivity,indicate that the multiplex RT-PCR system can simultaneously detect three potato viruses.
potato;PLRV;PVY;PVS;multiplex RT-PCR;detection
S532;Q944.57
A
1005-9369(2014)05-0013-06
2013-05-10
现代农业产业技术体系专项资金资助(CARS-10-P14);国家科技支撑项目(2012BAD06B02-02C2);黑龙江省自然科学基金项目(C201234);黑龙江省农业科技创新工程重点资助项目(2012ZD015)
张威(1981-),女,助理研究员,硕士,研究方向为分子植物病理学。E-mail:tudoudou2013@163.com
*通讯作者:白艳菊,研究员,硕士,研究方向为分子植物病理学。E-mail:yanjubai@163.com
时间2014-5-12 9:00:50[URL]http://www.cnki.net/kcms/detail/23.1391.S.20140512.0900.012.html
张威,白艳菊,罗丽环,等.三种马铃薯病毒多重RT-PCR检测体系建立[J].东北农业大学学报,2014,45(5):13-18.
Zhang Wei,Bai Yanju,Luo Lihuan,et al.Establishment of multiplex RT-PCR system for detection of three potato viruses[J]. Journal of Northeast Agricultural University,2014,45(5):13-18.(in Chinese with English abstract)
