发芽小麦除草活性物质超声提取及生物活性研究
2014-01-14白靖文陶波杨昱
白靖文,陶波,杨昱
(1.东北农业大学理学院,哈尔滨 50030;2.东北农业大学农学院,哈尔滨 150030)
发芽小麦除草活性物质超声提取及生物活性研究
白靖文1,陶波2*,杨昱1
(1.东北农业大学理学院,哈尔滨 50030;2.东北农业大学农学院,哈尔滨 150030)
为了提取抑制黄瓜萌发及生长的发芽小麦中的活性物质,采用L9(34)正交试验设计,以黄瓜萌发抑制率为跟踪手段,研究超声时间、超声功率、超声温度、液料比对发芽小麦活性物质提取的影响。结果表明,影响发芽小麦活性物质提取的主次因素为超声温度>超声时间>液固比>超声功率;经正交试验确定最佳提取条件为提取温度50℃,超声时间40 min,液固比20,超声功率为400 W,经6次平行试验验证,该试验稳定可靠,与对照试验相比,植物黄瓜萌发抑制率为63.64%。活性物质浓度为4 mg·mL-1时,对黄瓜生长存在不同程度抑制作用,株鲜重和根鲜重抑制作用最强。
发芽小麦;超声辅助提取;黄瓜;萌发及生长;抑制作用
小麦产量和种植面积在全世界居于首位[1],为保证小麦产量和品质,每年向麦田中施用大量农药除草剂,对环境和食品安全产生危害[2]。利用小麦自身向环境中释放植物次生代谢产物达到抑制杂草萌发及生长的异株克生作用(也称化感作用)控制杂草,能达到施用农药的效果又不引起环境变化[3]。具有经济潜力和社会效益。小麦异株克生作用研究始于20世纪40年代[4],Mccallah等报道小麦秸秆覆盖对玉米的发芽和生长抑制作用[5]。后期研究表明,小麦还存在自毒作用[6-8],对宽叶杂草具有较强抑制作用[9],Hisashi等发现燕麦芽中存在抑制莴苣萌发及生长的除草活性物质[10],Reberg-Horton等研究黑麦覆盖抑制杂草[11-15]。Leather和Hiroshi等证实小麦对杂草发芽抑制程度因作物和杂草种类及环境条件不同有差别[16-18],对野燕麦的发芽及幼苗生长存在明显抑制作用[19],野燕麦也会对小麦产生异株克生作用[20]。我国学者从1996年开始对小麦化感作用开始研究[21-26],证实小麦对繁缕、千金子、白茅及水稻具有强烈抑制作用。目前,对小麦生长过程中的根、茎、叶等各组织部分或器官的异株克生作用均有研究报道[27],而对发芽小麦发芽种子异株克生作用研究还鲜有报道。Naumov等最早对种子萌发释放的活性物质进行研究[28]。国内有Bai等对发芽小麦种子释放活性物质进行研究,发现发芽小麦提取物对黄瓜种子萌发及生长具有抑制作用[29-30]。
异株克生活性物质在小麦种子中含量极低,影响活性物质种类和结构鉴定,制约小麦种子异株克生作用。本文采用超声波辅助法提取发芽小麦种子活性物质,利用超声波打碎小麦种子细胞壁,提高活性物质溶出率[31],对提取物进行生物活性测定,确定异株克生物质对指示植物生长发育过程产生抑制作用。
1 材料与方法
1.1 材料与试剂
材料:龙辐18小麦种子(黑龙江省农科院赠送),春心常绿黄瓜种子(购自哈尔滨公滨种子商店)。
试剂:无水乙醇(分析纯)。
1.2 仪器与设备
分析天平(梅特勒-托利多仪器(上海)有限公司;培养箱(上海跃进医疗器械厂);R-205旋转蒸发仪(山海申胜生物技术有限公司);KQ-500E超声波清洗器(昆山市超声仪器有限公司);ZK-82A型电热真空干燥箱(上海实验仪器有限公司)。
1.3 试验流程
小麦种子→培养箱发芽→干燥→超声提取→旋转蒸发→溶解定容→抑制率试验→生长指标测定。
1.4 方法
1.4.1 小麦种子活性物质超声辅助提取
根据预实验结果从40个种小麦品种中选取化感抑制活性较高的龙辐18小麦种子为供试材料,从17个杂草与蔬菜品种中选取敏感黄瓜种子为指示植物。选取超声时间、超声温度、超声功率、液料比等四个超声辅助提取影响因素,进行正交试验设计,根据提取物对指示植物萌发抑制率选取最佳提取条件[12]。结果见表1。
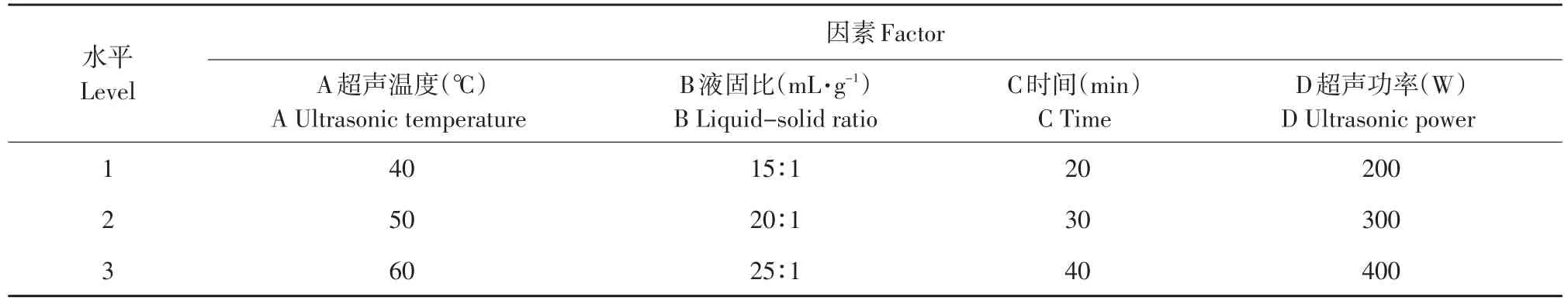
表1 超声提取法正交试验设计表Table 1 Orthogonal factors and levels of ultrasonic extraction method
1.4.2 提取物对黄瓜种子萌发抑制率测定
采用培养皿滤纸法进行黄瓜种子发芽率测定。将超声提取液蒸干,50 mL容量瓶蒸馏水定容,加入到铺有两层定性滤纸的培养皿(直径9 cm)中,每皿均匀摆放饱满的供试种子20粒,以蒸馏水为对照,每份设置3个重复。置于人工智能培养箱中培养4 d,依照公式(1)计算黄瓜萌发抑制率。1.4.3提取物对黄瓜各项生理指标的抑制作用测定

株高、根长、株鲜重、根鲜重、株干重、根干重各项生理指标测定采用砂培法。具体为每个杯子中放6粒发芽黄瓜种子,设置3次重复。每个杯子倒入60 mL提取物溶液,对照杯中则加入60 mL蒸馏水。培养箱中培养7 d后,用水冲掉黄瓜植株表面沾附沙子,滤纸吸干植株表面吸附水分,依次测量种子的株高、根长,株鲜重、根鲜重、株干重及根干重,记录数据,据1.4.2抑制率公式计算分析结果。
2 结果与分析
2.1 发芽小麦超声波辅助提取试验结果
结果见图1。
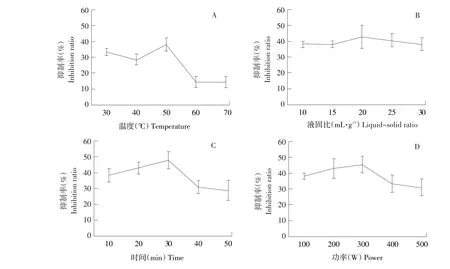
图1 超声提取条件对黄瓜种子萌发抑制率影响Fig.1 Effect of ultrasonic extraction condition on the inhibition rate of cucumber seed germination
如图1所示,超声温度、液固比、超声时间和超声功率四个超声提取影响因素对指示植物种子萌发均产生影响,根据试验结果确定各因素最佳条件分别为:超声提取温度50℃,液固比20,超声时间30 min,超声功率300 W,通过SPSS软件进行四因素三水平正交设计。结果见表2~3。
由表2~3可知,RA>RC>RB>RD,各因素对黄瓜种子的抑制率的影响程度依次为:超声温度>超声时间>液固比>超声功率,温度对黄瓜种子的抑制率影响最为显著,优化得到超声提取小麦种子的最佳条件为:A2B2C3D3,即提取温度为50℃,超声时间为40 min,液固比为20,超声功率为400 W。由于该试验条件不在试验设计范围内,故需做验证试验。
2.2 平行对照试验
按2.1得到的最佳超声提取条件,提取温度为50℃,超声时间为40 min,液固比为20,超声功率为400 W。进行6次发芽小麦种子的超声提取验证试验,得到提取物生测抑制率分别为63.87%、63.89%、62.71%、63.18%、65.04%、62.15%,均值为63.64%,RSD为1.17%,表明所选的最优工艺条件结果理想,试验条件下所得工艺参数稳定可靠。相同提取条件下,进行未超声辅助提取的对照试验,对黄瓜萌发抑制率只有41.29%。与对照试验相比,超声辅助提取最优工艺将黄瓜萌发抑制率提高22.35%。根据最佳试验条件对发芽小麦化感作用物质进行提取,提取物进行化感生物活性测定。
2.3 不同浓度提取物对黄瓜生长活性的影响
结果见图2。
如图2所示,不同浓度提取物对黄瓜株高生长影响不同,在高浓度时产生抑制作用,在低浓度时发生促进作用,随着活性物质浓度升高,抑制呈现变大的趋势。在浓度为4 mg·mL-1时,株高抑制率为28.58%,表明在活性物质高浓度时抑制了黄瓜植株生长,株高变矮,但作用效果不强。

表2 超声提取法正交试验结果Table 2 Orthogonal test results of ultrasonic extraction method

表3 方差分析Table 3 Variance analysis

图2 水溶剂提取物对黄瓜株高影响Fig.2 Effect of active substances from water solvent extraction on the height of cucumber
如图3所示,水溶剂提取物在不同浓度时对黄瓜株重均产生抑制作用,随着活性物质浓度升高,抑制呈上升趋势。在浓度为4 mg·mL-1时,株重抑制率为78.01%。表明发芽小麦水溶剂提取物能显著抑制黄瓜植株含水量。
如图4所示,水溶剂提取物在不同浓度时对黄瓜株干重均产生抑制作用,随着活性物质浓度升高,抑制呈上升趋势。在浓度为4 mg·mL-1时,株干重抑制率为41.84%。表明发芽小麦水溶剂提取物能抑制黄瓜植株干物质含量。
如图5所示,水溶剂提取物在不同浓度时对黄瓜根长均产生抑制作用,随着活性物质浓度升高,抑制呈上升趋势。在浓度为4 mg·mL-1时,根长生长抑制率为50.73%。表明发芽小麦水溶剂提取物能抑制黄瓜植株根生长伸长。
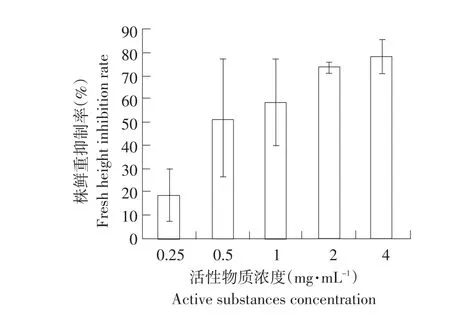
图3 水溶剂提取物对黄瓜株鲜重的抑制率Fig.3 Inhibition rate of active substances of aqueous extract on the cucumber fresh weight

图4 水溶剂提取物对黄瓜株干重的抑制率Fig.4 Inhibition rate of active substances of aqueous extract on the cucumber dry weight
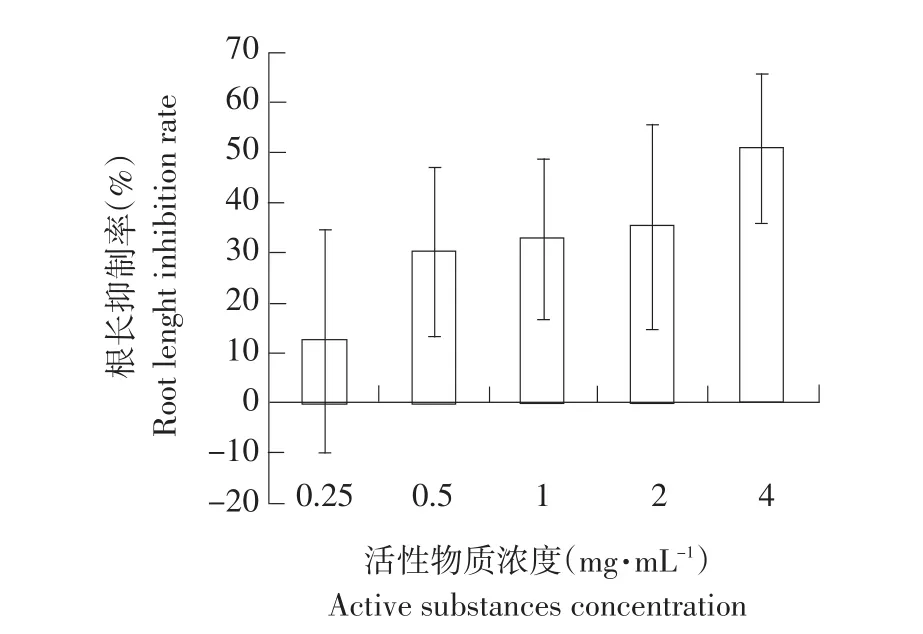
图5 水溶剂提取物对黄瓜根长的抑制率Fig.5 Inhibition rate of active substances of aqueous extract on the cucumber root length
如图6所示,水溶剂提取物在不同浓度时对黄瓜根鲜重均产生抑制作用,随着活性物质浓度升高,抑制呈上升趋势。在浓度为4 mg·mL-1时,根鲜重抑制率为89.36%。表明发芽小麦水溶剂提取物能显著抑制黄瓜植株根含水量。
如图7所示,水溶剂提取物在不同浓度时对黄瓜根干重均产生抑制作用,随着活性物质浓度升高,抑制呈上升趋势,且高浓度抑制率相比低浓度时抑制率增加明显。在浓度为4 mg·mL-1时,根干重抑制率为44.39%。表明发芽小麦水溶剂提取物能抑制黄瓜植株根中干物质含量。
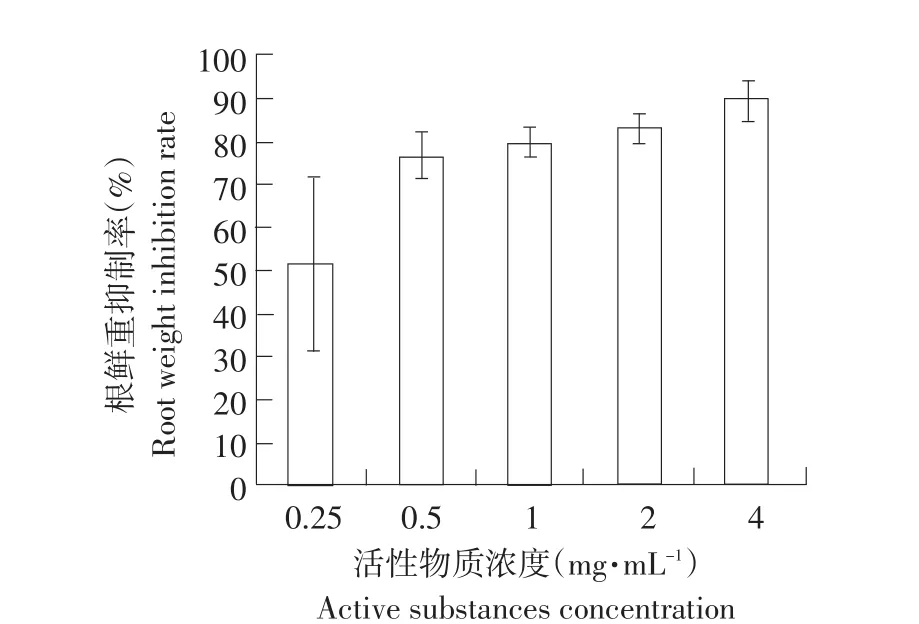
图6 水溶剂提取物对黄瓜根重的抑制率Fig.6 Inhibition rate of active substances of aqueous extract on the cucumber root weight
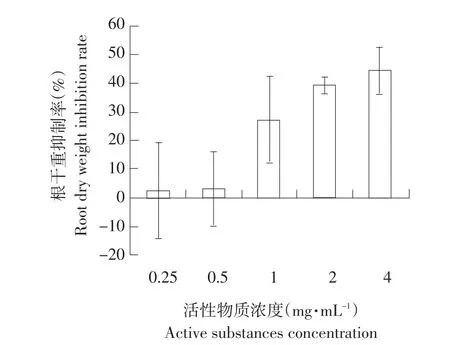
图7 水溶剂提取物对黄瓜根干重的抑制率Fig.7 Inhibition rate of active substances of aqueous extract on the cucumber root dry weight
从表4可以看出,在不同浓度条件下发芽小麦提取物对黄瓜根长、株鲜重、根鲜重、株干重、根干重均表现抑制作用,活性物质浓度为0.25和0.50 mg·mL-1时,对黄瓜的株高出现促进作用。在0.25 mg·mL-1浓度时,对黄瓜根鲜重和株鲜重的抑制作用影响显著,其他浓度对黄瓜生长影响差异均不显著。在活性物质浓度为4.0 mg·mL-1时,对黄瓜各项指标抑制效果最大。

表4 不同浓度活性物质对黄瓜生长影响Table 4 Different concentrations of active substances influence on the growth of cucumber
3 讨论与结论
试验研究因素对黄瓜萌发抑制率影响次序为超声温度>超声时间>液固比>超声功率。以黄瓜萌发抑制率为指标,获得小麦发芽种子提取的最佳条件:提取温度为50℃,超声时间为40 min,液固比为20,超声功率为400 W。经6次平行试验验证,试验稳定可靠。在最佳提取条件下,与对照试验比较,黄瓜萌发抑制率提高22.35%。与一般传统提取方法相比,超声辅助提取法具有提取率较高、提取速度快、效率高、能耗低、后续处理简单等优点,适合发芽小麦抑制萌发活性物质提取。本试验建立的超声辅助提取模型可为发芽小麦活性物质及其他植物中活性物质提取提供理论参考,但提取到发芽小麦活性物质仍为混合物,下一步还需进行分离鉴定试验,确定发芽小麦释放活性物质种类及结构。
本试验研究发芽小麦提取物对指示植物的根长、根鲜重、根干重、株高、株鲜重、株干重等生物活性测定,发现发芽小麦能显著抑制黄瓜种子萌发及根长、根鲜重等生物活性,且抑制程度与发芽小麦提取物浓度正相关。这与Perez等研究小麦秸秆腐解产生活性物质对野燕麦根长及萌发抑制作用结果一致[21,32]。小麦秸秆水提液对裂叶牵牛、小绒毛草等植物具有抑制作用,且抑制能力依次减弱,研究发现小麦对宽叶杂草具有较强的抑制作用[33]。李善林等研究发现抽穗期小麦提取物对反枝苋的抑制率达到82%,用同剂量的提取物处理繁缕的茎叶,30d后76%~85%的繁缕死亡[22]。张晓珂等研究东北地区不同小麦品种对黑麦草根长、苗高、根干重及苗干重的影响,其中四个小麦品系对黑麦草抑制作用较强[1]。Oueslati等研究表明许多小麦对不同指示植物都具有异株克生潜力,并根据不同指示作物成功筛选出异株克生潜力大品种[27]。Mitsunori等研究表明,对种子萌发抑制作用受到多种植物激素调控[34]。Sangmin等对拟南芥、玉米和大麦等研究表明,SA影响种子萌发具有浓度依赖效应[35]。
胁迫条件下,SA在植物种子萌发过程中发挥重要作用,但其确切机制尚不明确,缺乏统一认识,甚至存在相互矛盾结论[36],对小麦秸秆和根系分泌物产生抑制作用的研究很多,但缺少对发芽小麦抑制植物萌发及生长的研究,本试验研究发芽小麦对黄瓜萌发及生长抑制作用,发现发芽小麦释放活性物质显著抑制黄瓜萌发及生长,但对黄瓜抑制作用机理研究仍不清楚,尚需深入研究。
[1]张晓珂,梁文举,姜勇.东北地区不同小麦品种对黑麦草的化感作用[J].应用生态学报,2006,17(7):1191-1195.
[2]苏少泉.生物除草剂的研究与开发[J].农药,2004,43(4):97-100.
[3]Duke S O,Cedergreen N,Velini E D,et al.Hormesis:is it an important factor in herbicide use and allelopathy?[J].Outlooks on Pest Management,2006,17(1):29-33.
[4]Mccalla T M,Haskins F A.Phytotoxic subseances from soil microorganism and crop residues[J].Bacteriological Reviews, 1964,28(2):181-207.
[5]Mccalla T M,Duley F L.Stubble Mulch Studies:III.Influence of soil microorganisms and grop residues on the germination,Growth and direction of root growth and corn seedlings[J].Soil Science Society of America Journal,1950,14:196-199.
[6]Kimber R W L.Phytotoxicity from plant residues.I.The influence of rotted wheat straw on seedling growth[J].Australian Journal of Agricultural Research,1967,18(3):361-374.
[7]Kimber R W L.Phytotoxicity from plant residues.II.The effect of time of rotting of straw from some grasses and legumes on the growth of wheat seedlings[J].Plant and Soil,1973,38:347-361.
[8]Kimber R W L.Phytotoxicity from plant residuesⅢThe relative effect of toxins and nitrogen immobilization on the germination and growth of wheat[J].Plant and Soil,1973(38):543-555.
[9]Donald A,Crutehfield.Effect of winter wheat(Triticum aestivum) straw mulch level on weed control[J].Weed Science,1986,34(1): 110-114.
[10]Hisashi K N,Seiji K,Shosuke Y,et al.Allelopathy of oats.I. Assessment of allelopathic potential of extract of oat shoots and identification of an allelochemical[J].J Chem Ecol,1994,20(2): 309-314.
[11]Reberg-Horton S C,Burton J D,Danehower D A,et al.Changes over time in the allelochemical content of ten cultivars of rye (Secale cereale L.)[J].J Chem Ecol,2005,31(1):179-193.
[12]Francisco J P,Juan O N.Difference in hydroxamic acid content in roots and root exudates of wheat(Triticum aestivum L.)and rye (Secale cereale L.)Possible role in allelopathy[J].J Chem Ecol, 1991,17(6):1037-1043.
[13]Putnam A R,Duke W B.Biological supression of weeds:Evidence for allelopathy in accessions of cucumber[J].Science,1974,185: 370-372.
[14]Hicks R D.Effects of wheat straw on cotton[J].Crop Sci,1989,29: 1057-1061.
[15]Masiunas J B.The impact of rye cover crops on weed populations in a tomato cropping system[J].Weed Science,1995,43:318-323.
[16]Leather G R.Weed control using allelopathic sunflower and herbicides[J].Plant and Soil,1997,98:17-23.
[17]Hiroshi N,Satoshi M,Hideyuki S,et al.Plant growth inhibitory compounds from aqueous leachate of wheat straw[J].Plant Growth Regulation,2006,48:215-219.
[18]Khaliq A,Matloob A,Aslam F,et al.Toxic action of aqueous wheat straw extract on horse e purslane[J].Planta Daninha,2012, 30(2):269-278.
[19]Mahmood K,Khaliq A,Cheema Z A,et al.Allelopathic activity of Pakistani wheat genotypes against wild oat(Avena fatua L.)[J]. Pakistan Journal of Agricultural Sciences,2013,50(2):169-176.
[20]Zhou B,Kong C H,Wang P,et al.Chemical constituents of the essential oils of wild oat and crabgrass and their effects on the growth and allelochemical production of wheat[J].Weed Biology and Management,2013,13(2):62-69.
[21]马瑞霞,刘秀芬,袁光林,等.小麦根区微生物分解小麦残体产生的化感物质及其生物活性的研究[J].生态学报,1996,16(6): 632-639.
[22]李善林,由振国,李孙荣,等.小麦提取物对反枝苋-繁缕生长的化感效应研究[J].中国生物防治,1996,12(4):168-170.
[23]李善林,由振国,梁渡湘,等.小麦化感作用物的提取_分离及其对白茅的杀除效果[J].植物保护学报,1997,24(1):81-84.
[24]董立尧,王鸣华,武淑文,等.小麦对直播稻田千金子的化感作用及化感物质分离鉴定[J].中国水稻科学,2005,19(6):551-555.
[25]孙磊,陈兵林,周治国.麦棉套作系统中小麦根区化感物质对棉苗生长的影响[J].棉花学报,2006,18(4):213-221.
[26]杨世超,李孙荣,杨学军.小麦对白茅化感作用影响研究[J].杂草学报,1992,6(2):23-28.
[27]Oueslati O.Allelopathy in two durum wheat(Triticum durum L.) varieties[J].Agriculture Ecosystems and Environment,2003(96): 161-163.
[28]Naumov G F.Biochemical characteristics of allelopathic activity of germinating seeds[J].Biologia Plantarum,1984,31(6):496-502.
[29]Bai J W,Wang J,Bo Tao,et al.Allelopathy and Preliminary separation of allelopathic substance in the extracts of wheat seed germination[J].Advanced Materials Research,2012:468-471, 565-568.
[30]李承森.植物科学进展(第1卷)[M].北京:高等教育出版社,1998.
[31]刘小平.中药分离工程[M].北京:化学工业出版社,2005.
[32]Perez F J.Allelopathic effect of hydroxamic acids from cereals on Avena sativa and A.fatua[J].Phytochemistry,1990,29(3): 773-776.
[33]Donald A.Crutchfield et al.Effect of Winter wheat(Triticum aestinum)Straw Mulch Level on weed Control[J].Weed Science, 1985(34):110-114.
[34]Mitsunori Seo,Eiji Nambara,Giltsu Choi,et al.Interaction of light and hormone signals in germinating seeds[J].Plant Molecular Biology,2009,69(4):463-472.
[35]Sangmin Lee,Sang-Gyu Kim,Chung-Mo Park.Salicylic acid promotes seed germination under high salinity by modulating antioxidant activity in Arabidopsis[J].New Phytologist,2010,188 (2):626-637.
[36]Ana Alonso-Ramírez,Dolores Rodríguez,David Reyes,et al. Evidence for a role of gibberellins in salicylic acid-modulated early plant responses to abiotic stress in Arabidopsis seeds[J]. Plant Physiology,2009,150(3):1335-1344.
Research on the ultrasonic extraction and inhibiting activity of herbici- dal active substances of germinated wheat
BAI Jingwen1,TAO Bo2,YANG Yu1(1.School of Science,Northeast Agricultural University,Harbin 150030,China;2.School of Agriculture,Northeast Agricultural University,Harbin 150030,China)
Single factor test and L9(34)orthogonal design were used to study the extraction of the active substances inhibiting the germination and growth of cucumber from germinated wheat,and the effects of ultrasonic time,ultrasonic power,ultrasonic temperature and liquid-solid ratio were investigated by the tracking means of germination inhibition rate of cucumber.The results showed that the primary and secondary factors to impact the extraction of active substances from germinated wheat were as follows,ultrasonic temperature>ultrasonic time>liquid-solid ratio>ultrasonic power.The optimum extraction conditions determined through orthogonal tests were extraction temperature 50℃,ultrasonic time 40 min,liquid-solid ratio 20,ultrasonic power 400 W,and the test was stable and reliable by six parallel tests verification,compared with the control experiments,cucumber germination inhibition rate was 63.64%.There were different degrees of inhibition on the growth of cucumber when the concentration of the active substance reached 4 mg·mL-1,and the inhibitory effect were the strongest on fresh weight and root fresh weight of cucumber.
germinated wheat;ultrasonic assisted extraction;cucumber;germination and growth; inhibition
S512.1
A
1005-9369(2014)05-0019-07
2014-04-02
黑龙江省教育厅科研项目(12531044)
白靖文(1978-),男,副教授,博士,研究方向为植物源农药提取及作用机制。E-mail:baijingwen@neau.edu.cn
*通讯作者:陶波,教授,博士生导师,研究方向为农药作用机理、农药新活性物质的开发与应用。E-mail:botaol@163.com
时间2014-5-19 11:24:53[URL]http://www.cnki.net/kcms/detail/23.1391.S.20140519.1124.002.html
白靖文,陶波,杨昱.发芽小麦除草活性物质超声提取及生物活性研究[J].东北农业大学学报,2014,45(5):19-25.
Bai Jingwen,Tao Bo,Yang Yu.Research on the ultrasonic extraction and inhibiting activity of herbicidal active substances of germinated wheat[J].Journal of Northeast Agricultural University,2014,45(5):19-25.(in Chinese with English abstract)
