乙酰乙酰辅酶A还原酶基因phbB克隆及其表达初探
2014-01-14苍晶姜晓娟徐志超林忠平杜娟
苍晶,姜晓娟,徐志超,林忠平,杜娟
(1.东北农业大学生命科学学院,哈尔滨 150030;2.北京大学蛋白质工程及植物基因工程国家重点实验室,北京 100871)
乙酰乙酰辅酶A还原酶基因phbB克隆及其表达初探
苍晶1,姜晓娟1,徐志超2,林忠平2,杜娟2
(1.东北农业大学生命科学学院,哈尔滨 150030;2.北京大学蛋白质工程及植物基因工程国家重点实验室,北京 100871)
从真养产碱杆菌(Alcaligenes eutrophus)中克隆得到PHB合成的关键酶基因,NADPH依赖性的乙酰乙酰辅酶A还原酶基因phbB(GenBank ID:KC191672),其DNA长度为741 bp,编码246个氨基酸(aa),与GenBank数据库中的entrophusPhbB(FJ897462.1)的同源性为70.99%。属于膜蛋白或分泌蛋白,推测该蛋白可能定位在细胞膜上。成功构建原核表达载体pET28a(+)-phbB-HE。经SDS-PAGE电泳检测获得phbB基因表达蛋白,其分子质量为31 ku,为研究乙酰乙酰辅酶A还原酶活性及后期蛋白功能鉴定奠定基础。
聚-β-羟基丁酸酯;重组表达;基因克隆;纯化;表达载体
塑料废弃物造成的环境污染日益严重,日常生活和工业上广为应用的塑料均是以石油为原料经化学合成的石化产品。研制开发可降解塑料以减少环境污染具有重要意义[1-3]。自1962年以来,研究人员将目光投向聚-β-羟基丁酸酯(Poly-β-hydroxylbutyrate,PHB),它是一种理想的生物可降解塑料,以其良好的生物降解性和生物组织亲合性受到关注,其分解产物在自然条件下可被一些微生物完全分解利用,对环境无任何污染,对人体无伤害[4]。虽应用前景广阔,但因成本高于化工塑料而难以推广[5-7]。随着重组DNA技术的发展,为此转基因植物生产生物可降解塑料开辟了新途径。
PHB生物合成由3种性质不同的酶共同催化:3-酮硫解酶、依赖NADPH的乙酰乙酰CoA还原酶和PHB合酶,分别由phbA、phbB和phbC基因编码。Poirier等在拟南芥细胞质中定向合成PHB[8];Nawrath等通过农杆菌介导法对phbA、phbB和phbC基因进行修饰构建3个表达载体,通过杂交使3个关键酶基因共转化在同一株拟南芥中成功表达[9];Houmei等从碱杆菌分离得到3个编码PHB关键酶基因(phbA、phbB和phbC),用种子特异启动子代替35S启动子,在油菜种子中成功表达[10]。在马铃薯、甜菜等植物中相应获得成功[11-14]。
本文以真氧产碱杆菌(Alcaligenes eutrophus)为材料获得PHB生物合成关键酶基因phbB,并构建原核表达系统。实现PHB合成基因在大肠杆菌中的表达以及PHB积累。为研究乙酰乙酰CoA还原酶的生化特性奠定基础。
1 材料与方法
1.1 质粒与菌株
原核表达载体pET28a、大肠杆菌(Escherichia coli)DH5α由本实验室保存;真养产碱杆菌(Alcaligenes eutrophus)由中国科学院微生物所提供;pMD18-T载体购自TaKaRa公司(大连)。
1.2 试剂与设备
质粒纯化试剂盒、T4DNA连接酶、DNA限制性内切酶HindⅢ和EcoRⅠ、pMD18-T载体购自TaKaRa公司(日本);N,N'-亚甲双丙烯酰胺、考马斯亮蓝R-250丙烯酰胺由北京拜尔迪生物技术有限公司提供;引物合成及测序由上海生工生物有限公司完成;台式冷冻离心机均为Thermo公司产品;金属浴与PCR仪为Eppendorf生产。
1.3 phbB基因的克隆及测序
采用优化的CATB裂解法提取真养产碱杆菌基因组DNA[15],根据Alcaligenes eutrophusPhbB(FJ897462.1)基因编码区(CDs)设计特异引物F:5'ATGACTCAGCGCATTGCGTATGTGACC 3',R:5'TCAGCCCATATGCAGGCCGCCGTTGAG 3'。取2 μL DNA作为模板,PCR反应扩增条件:95℃5 min,95℃30 s,55℃30 s,72℃1 min 30 s,共35个循环,72℃延伸10 min。将回收产物连接在pMD18-T载体上,16℃连接过夜,转化大肠杆菌(Escherichia coli)DH5α,涂布于含Kan+的LB固体平板,37℃倒置培养过夜,1.2%琼脂糖凝胶电泳检测,阳性菌株送至上海生工生物公司测序。
1.4 原核表达载体构建
在引物两端引入HindⅢ/EcoRⅠ酶切位点:F:5'CCCAAGCTTTCAGCCCATATG 3',R:5'CC GGAATTCATGACTCAGCGC 3'。目的片段与pMD18-T载体连接后构建pMD18T-phbB质粒,转化工程菌E.coliDH5α。将纯化的pMD18T-phbB质粒和空的pET28a质粒分别由HindⅢ/EcoRⅠ37℃双酶切3 h左右,得到带有相同粘性末端的pET28a和目的基因片段,回收的大小片段用T4DNA连接酶16℃下连接过夜,经1.2%琼脂糖凝胶电泳进行鉴定。
1.5 phbB基因蛋白在E.coli的诱导表达
挑取正确的重组质粒和阴性对照空载体以1:50比例,加入含Kan+的LB液体培养基中,37℃震荡培养2~3 h至OD值达0.6~0.8,加入IPTG(终浓度为0.5 mmol·L-1)分别在不同温度30和16℃下诱导6和24 h,10 000 r·min-1离心1 min,沉淀样品用200 μL冰预冷的磷酸缓冲液(PBS)悬浮,10 000 r·min-1离心1 min,弃上清。加入30 μL PBS和10 μL 4×SDS上样缓冲液,剧烈振荡,沸水浴中保持5 min,立即冰浴冷却,12 000 r·min-1离心1 min,加入200 μL 1×SDS PAGE Loading buffer,15% SDS-PAGE检测参照Schagger等方法[16]。
2 结果与分析
2.1 phbB基因片段的克隆及序列分析
以真养产碱杆菌(Alcaligenes eutrophus)DNA为模板,扩增得到一条约750 bp的DNA片段且条带清晰(见图1)。通过NCBI上的软件ORF Finder(http: //www.ncbi.nlm.nih.gov/gorf/orfig.cgi)分析,phbB基因全长为741 bp,编码246个氨基酸(aa),与GenBank上收录的eutrophus phbB(FJ897462.1)序列比对同源性达70.99%(见图2),多序列比对和系统进化树分析表明该基因属于NADB-Rossmann超家族。并在GenBank数据库进行登陆,登录号为:KC191672。
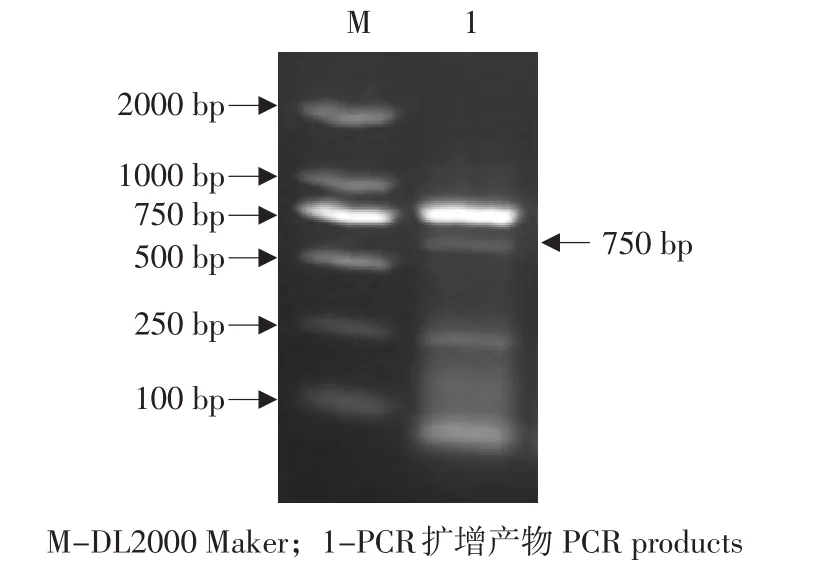
图1 PCR扩增的phbB基因序列Fig.1phbB gene sequence using PCR method

图2 phbB基因与eutrophus phbB核酸序列比对Fig.2 Comparison among phbB gene sequence and eutrophus phbB
2.2 编码蛋白信号肽和亚细胞定位分析
SignalP软件对phbB基因编码蛋白进行信号肽预测该蛋白属于膜蛋白或分泌蛋白,在N-末端具有指导蛋白质跨膜转移(定位)的信号肽(见图3)。PSORT(http://psort.hgc.jp/form.html)对phbB编码的蛋白进行亚细胞定位,其中定位于质膜和外部空间的平均分值分别为0.64和0.428(见图4),从而推断该蛋白可能定位在细胞膜上。
2.3 phbB蛋白三级结构预测
为更进一步了解phbB蛋白的特征,使用SWISS-MODEL方法,得到phbB蛋白的三维模型(见图5A),它以N端一个α-螺旋开始,这个α-螺旋可能含有胞内的定位信号。该蛋白含有>45%的α折叠,<5%的β折叠,和>30%α/β折叠。其等电点(pI)为7.79,N末端下游211~232氨基酸处有一个强信号的跨膜螺旋。该蛋白的晶体结构(见图5B)显示一个与氧化还原酶作用的β片层形式堆叠结构,在N末端含有能够与ND(P)H结合的TGxxxGxG结构,和一个辅助因子TGXXGXXG。这可能是phbB基因表达的乙酰乙酰CoA还原酶的活性中心。
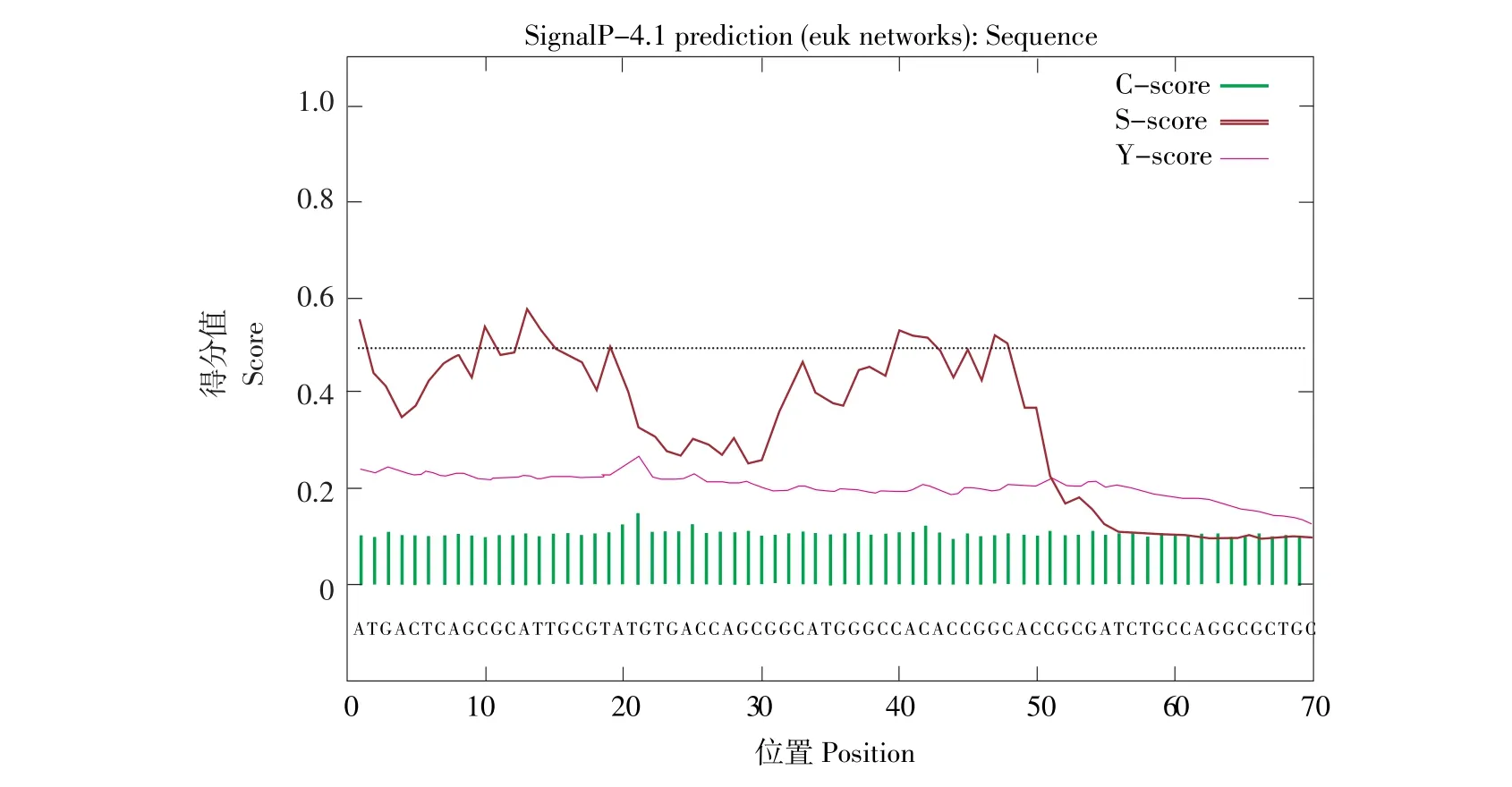
图3 phbB编码蛋白信号肽预测Fig.3Signal peptide prediction of phbB protein

图4 蛋白的亚细胞定位预测Fig.4 Subcellular localization prediction of protein

图5 三维结构和晶体结构预测Fig.5 Three-dimensional structure and crystal structure prediction
2.4 pET28a(+)-phbB-HE质粒构建和分析
以T7作为启动子,选择HindⅢ和EcoRⅠ为酶切位点设计特异性引物。经DNA测序,证明两个酶切位点已成功引入该片段(见图6A)。将已得到phbB基因连接到经同样限制性内切酶双酶切的pET-28a载体(见图7),转化至E.coliBL21(DE3)。PCR检测结果显示质粒pET28a(+)-phbB-HE已完全转入E.coliBL21(DE3)(见图5)。最终通过对阳性克隆的测序,证明phbB基因已正确连接到pET32a(+)表达载体上,并且核苷酸序列未发生任何碱基突变,即质粒pET28a(+)-phbB-HE构建与连接成功(见图6B)。
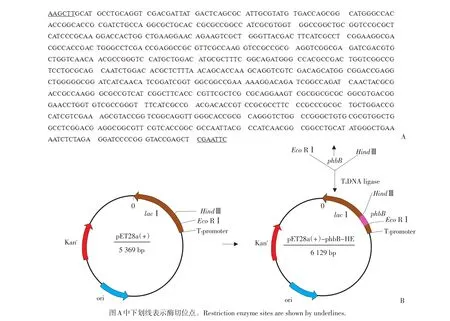
图6 PhbB基因序列(A)和重组质粒pET28a(+)-phbB-HE构建图Fig.6 PhbB gene sequence(A)and construction of recombinant plasmid pET28a(+)-phbB-HE(B)

图7 重组质粒pET28a(+)-phbB-HE的酶切鉴定Fig.7 Enzyme identification of recombinant plasmid pET28a(+)-phbB-HE
2.5 phbB基因表达蛋白在E.coli的诱导表达
含重组表达质粒pET28a(+)-phbB-HE的工程菌E.coliBL21(DE3)在含Kan+的LB培养液中,37℃摇床培养至OD值达0.6~0.8。经0.5 mmol·L-1IPTG诱导后,在37℃培养12 h后,分别对IPTG诱导前后的菌体和上清液处理。
经SDS-PAGE检测显示,与诱导前对照样品比较,该工程菌株诱导后的样品在约31 ku处条带明显(见图9),其分子质量和理论值吻合,而在阴性对照组中无任何表达,说明成功表达phbB基因蛋白。另外,使用(终浓度为0.5 mmol·L-1)IPTG对含pET28a(+)-phbB-HE重组质粒的E.coliBL21(DE3)菌株进行不同条件下处理,并选出最佳诱导条件为30℃/6 h。

图8 质粒pET28a(+)-phbB-HE转入E.coli BL21(DE3)结果Fig.8 Plasmid pET28a(+)-phbB-HE transformed into E.coli BL21(DE3)result
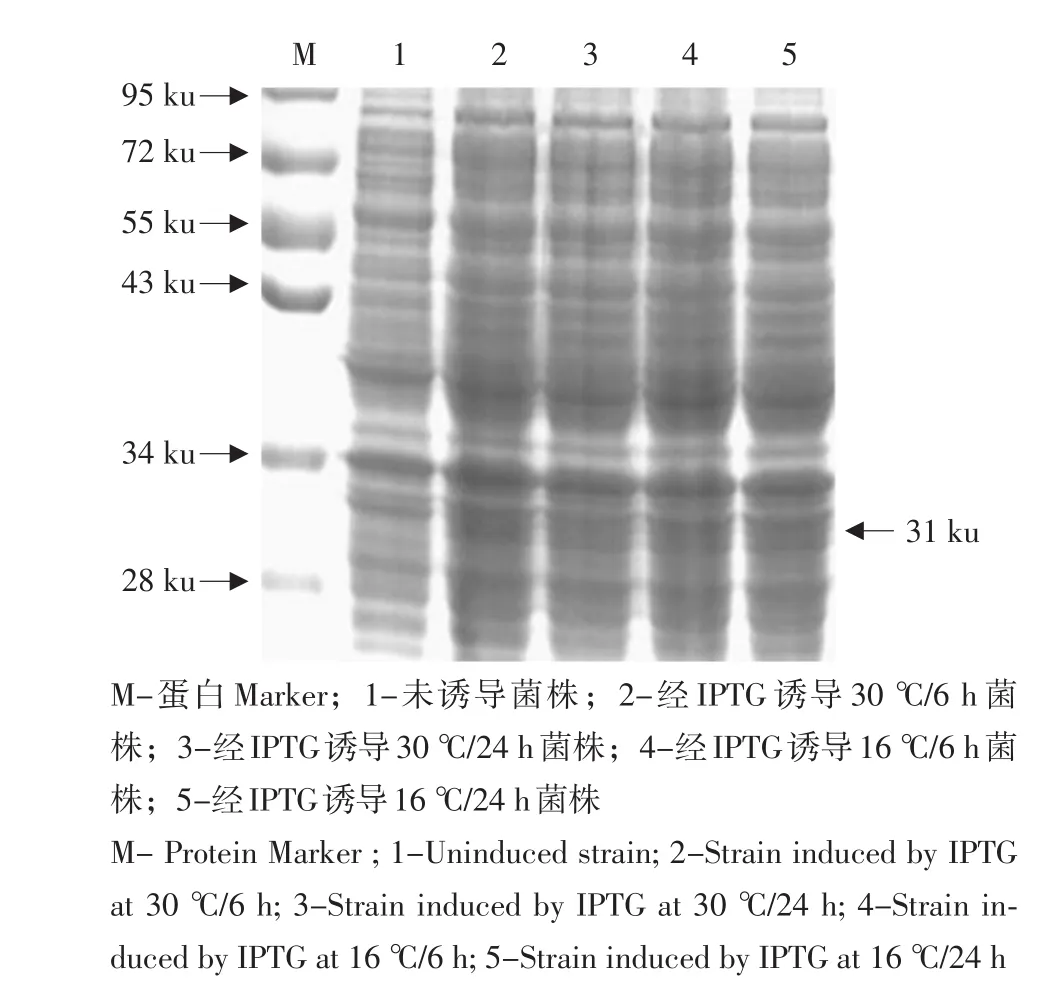
图9 重组质粒在E.coli BL21(DE3)表达蛋白的SDS-PAGE检测Fig.9 SDS-PAGE analysis for proteins expressed in E.coli BL21(DE3)
3 讨论与结论
PHB是一种自然界中存在的可降解性高分子聚合物,由其合成途径可知,两个乙酰辅酶A分子在β-酮硫解酶作用下缩合成乙酰乙酰辅酶A,在乙酰乙酰辅酶A还原酶作用下生成β-羟丁酰辅酶A,最后经PHB合成酶合成聚-β-羟基丁酸。因此,编码β-酮硫解酶、乙酰乙酰辅酶A还原酶及PHB合成酶的基因phbA、phbB和phbC在PHB生物合成途径起到至关重要作用[17-18]。本文以真养产碱杆菌(Alcaligenes eutrophus)DNA为模板,参考GenBank上收录的eutrophus phbB(FJ897462.1)全长DNA序列,成功克隆获得编码乙酰乙酰辅酶A还原酶的phbB基因序列,同源性比对及系统进化树分析表明该基因属于NADB-Rossmann超家族。该研究为最终实现商品化生产PHB提供可能。但该基因的表达蛋白乙酰乙酰辅酶A还原酶的生物学活性及其导入植物反应器后对聚-β-羟基丁酸酯(PHB)合成的调控作用,有待进一步研究。
为验证该基因功能,本文选择pET28a(+)作为表达质粒,它所携带的T7启动子是一种专一性很强的启动子,完全受控于T7RNA聚合酶。大肠杆菌作为外源性基因表达的宿主菌,是获得大量重组蛋白较为理想的表达系统[19-21]。其本身不含T7RNA聚合酶,在IPTG诱导下,溶源菌体内的lacUV5启动子解阻遏,生成T7RNA多聚酶能快速转录外源基因,在一定情况下可大量表达相应的靶蛋白,高活性的T7RNA聚合酶合成mRNA的速度比大肠杆菌RNA聚合酶快5倍。因此,通过控制诱导条件控制T7RNA聚合酶量,可实现调控phbB基因在大肠杆菌中的产物表达量。在本试验条件下,筛选出最佳诱导条件为30℃/6 h,但此条件下的phbB蛋白表达量并未达到理想水平,仍有待对诱导条件和菌株作进一步的摸索和纯化,为最终实现商品化生产PHB奠定基础。
[1]刘西文,杨中文.植物合成生物降解塑料的研究进展[J].塑料制造,2007(12):90-94.
[2]梁世强,傅和青.生物降解包装塑料研究进展[J].包装工程, 2006,27(2):16-17.
[3]于浩强,张艳梅.生物降解塑料的研究现状与发展前景[J].上海塑料,2012(1):1-5.
[4]胡晓兰,梁国正.生物降解高分子材料研究进展[J].化工新型材料,2002(3):7-10.
[5]Poirier Y.Production of polymeric compounds in plants[J].Curr Opin Biotechnol,1999,10(2):181-185.
[6]Scheller J,Conrad U.Plant-based material,protein and biodegradable plastic[J].Curr Opin Plant Biol,2005(8):188-196.
[7]Poirier Y,Nawrath C,Somerville C.Production of polyhydroxyalkanoates,a family of bioegradable plastics and elastomers inbacteria and plants[J].Bio Technology,1995,13:142-150.
[8]Poirier Y,Dennis D E,Klomparens K,et al.Perspectives on the production of polyhydroxyalkanoates inplants[J].FEMS Microbiol Rev,1992,103:237-246.
[9]Nawrath C,Poirier Y,Somerville C.Targeting of the polyhydroxybutyrate biosynthetic pathway to theplastids of Arabidopsis thaliana results in higher levels of polymer accumulation[J].Proc Natl Acad,1994,91:12760-12764.
[10]Houmiel K L,Slater S,et al.Poly(β-hydroxybutyrate)production in oil seed leukoplasts of Brassica-napus[J].Planta,1999,209 (4):547-550.
[11]John M E,Keller G.Metaqbolie pathway engineering in cotton: Biosynthesis of polydroxybutyrate in fiber cell[J].Proc Natl Acad sel USA,1996,93:12768-12773.
[12]Zhang J Y,Ye L,Song Y R.Obtainment of transgenic tobacco harboring phbA,phbB and phbC genes by twice transformation [R].Acta Bot Sin,2001,43(1):59-62.
[13]Menzel G,Harloff H J,Jung C.Expression of bacterial poly (3-hydroxybutyrate)synthesis genes in hairy roots of sugar beet (Beta vulgaris L.)[J].Applied Microbiology and Biotechnology, 2003,60(5):571-576.
[14]谢安勇,崔晓江,宋艳茹,等.phbB、phbC基因克隆、序列分析及植物表达载体的构建[J].植物学报,1995,37(8):581-588.
[15]萨姆布鲁克.分子克隆实验指南[M].第2版.金冬雁等译.北京:科学出版社,1992:1647-1653.
[16]Schagger H,Von Jagow G.Tricine-sodium dodecyl sulfatepolyacrylamidegel electrophoresis for the separation of protein inthe range from 1 to 100 ku[J].Analytical Biochemistry,1987,166: 368-379.
[17]Ye L,Li C,Song Y R.Cloning and sequencing of phbA gene of poly-β-hydroxybuty rate synthesis and its expression analysis[J]. Chin Sci Bull,1999,15(44):398-402.
[18]路子显,魏晓丽.一种简单有效的T7RNA聚合酶调控的植物基因表达系统[J].自然科学进展,2002(7):32-37.
[19]Der F W,Rosenberg A H,Dunn.use of T7RNA polymerase to direct expression of cloned genes[J].Methods Enzymol,1990,185: 60-89.
[20]聂新民,肖炳一,李小玲,等.新克隆的硝基还原酶基因NOR1的表达及其产物的纯化[J].癌症,2003,22(2):136-139.
[21]高闪电,常惠芸,独军政,等.一种高效、稳定的可溶性原核表达载体的构建及应用[J].华北农学报,2009,24(6):46-49.
CANGJing1,JIANGXiaojuan1,XUZhichao2,LIN Zhongping2,DU Juan2(1.School of Life Sciences,Northeast Agricultural University,Harbin 150030, China;2.National Laboratory of Protein Engineering and Plant Genetic Engineering,Peking University,Beijing 100871,China)
The full-length cDNA sequence of NADPH-dependent acetyl-CoA enzyme reductase gene namedphbB(GenBank ID:KC191672)as the key enzymes of PHB synthase gene were cloned fromAlcaligenes faecalis(Alcaligenes eutrophus).According toentrophusPhbB(FJ897462.1)sequences that has been speculated.The gene homology was 70.99%,with the length of 740 bp encoded 246 aminoacids(aa).The recombinant plasmid named pET28a(+)-phbB-HE were constructed successfully.The products were identified by SDS-PAGE analysis,it confirmed that high efficiency expression of the phbB protein fragments(ca.31 ku)were demonstrated.It laid a solid foundation for further study of phbBgene activity and late protein identification.
poly-β-hydroxyl butyrate;recombinant expression;gene clone;purification;expression vector
Q785
A
1005-9369(2014)05-0037-07
2013-03-04
国家863计划项目(2008AA05Z402)
苍晶(1963-),女,教授,博士,博士生导师,研究方向为植物生理生化。E-mail:cangjing2003@163.com
时间2014-5-19 11:25:10[URL]http://www.cnki.net/kcms/detail/23.1391.S.20140519.1125.004.html
苍晶,姜晓娟,徐志超,等.乙酰乙酰辅酶A还原酶基因phbB克隆及其表达初探[J].东北农业大学学报,2014,45(5):37-43.
Cang Jing,Jiang Xiaojuan,Xu Zhichao,et al.Molecular cloning and primary expressed exploration of acetoacetyl-CoA reductase gene(phbB)[J].Journal of Northeast Agricultural University,2014,45(5):37-43.(in Chinese with English abstract)
Molecular cloning and primary expressed exploration of acetoacetyl- CoA reductase gene(phbB)
