瓜叶菊Mlo基因的克隆、分析及VIGS载体构建
2014-01-14王金刚吕远达李声影杨涛白丁段然刘岩
王金刚,吕远达,李声影,杨涛,白丁,段然,刘岩
(东北农业大学园艺学院,哈尔滨 150030)
瓜叶菊Mlo基因的克隆、分析及VIGS载体构建
王金刚,吕远达,李声影,杨涛,白丁,段然,刘岩
(东北农业大学园艺学院,哈尔滨 150030)
试验以瓜叶菊(Pericallis hybrida B.Nord.)为试验材料,采用RT-PCR和RACE方法获得白粉菌调控相关Mlo基因的cDNA全长序列,通过VIGS技术构建载体,进行基因沉默并转入到农杆菌GV3101中。序列分析表明,该基因cDNA全长包含1个1 296 bp的开放阅读框,编码431个氨基酸。荧光定量结果表明,Mlo基因在瓜叶菊的根、茎、叶中都有表达,叶片中表达量最高,根中表达量最低。根据PCR结果和双酶切鉴定结果表明载体构建成功。通过PCR结果显示载体已成功转入农杆菌GV3101中。该研究为下一步分析基因沉默后瓜叶菊中Mlo基因变化提供依据。
瓜叶菊;Mlo基因;RACE克隆;序列表达分析;载体构建
瓜叶菊(Pericallis hybridaB.Nord.)是菊科(Compositea)多年生草本植物,观赏盆栽早春花卉。白粉病(Powdery mildew)是瓜叶菊重要病害之一。瓜叶菊白粉病传统化学方法使病原产生抗药性,造成环境污染等问题[1-5]。利用基因工程手段培育具有广谱抗白粉病的瓜叶菊种质资源具有重要意义。
Mlo对植物的抗病过程起负调控作用,在一定程度上相当于植物“感病”基因。而mlo基因介导的抗性明显不同,mlo基因几乎能抗所有己知的白粉病病原菌生理小种,具有广谱抗病性,任何感病的野生型(Mlo)都可以通过诱变获得mlo抗性[6]。因此,这类基因在改善植物抗性方面具有更大的潜力和应用前景。病毒诱导的基因沉默技术(Virus induced gene silencing,VIGS)就是通过DNA重组技术,在病毒基因组中插入一段目标基因或其核苷酸片段,受侵染的寄主植物不仅对病毒产生抑制作用,可抑制与插入片段同源的寄主内源基因表达,会特异性降解与插入片段同源的寄主植物本身RNA,可诱导植物内源基因沉默,引起表型变化,根据表型变异研究目标基因功能[7-8]。通常构建VIGS病毒载体及观察被侵染植物的表型仅需数星期。因此,VIGS一经建立,即被视为研究植物基因功能强有力工具,得到深入研究和广泛应用。
本研究以瓜叶菊(Pericallis hybridaB.Nord.)为试验材料,通过RT-PCR和RACE方法克隆Mlo基因的cDNA全长序列[9-10],通过VIGS技术构建载体进行基因沉默并转入到农杆菌GV3101中,采用生物信息学方法对其编码蛋白结构、进化地位及其在瓜叶菊根、茎、叶组织中和生物胁迫下表达模式进行预测和分析[11-12],为进一步研究瓜叶菊Mlo基因的功能和表达提供理论依据,为该基因应用于抗病基因工程育种奠定基础。
1 材料与方法
1.1 材料与试剂
瓜叶菊(Pericallis hybridaB.Nord.)由东北农业大学园艺实验站提供,取样液氮速冻保存于-80℃冰箱中备用。
烟草脆裂病毒(Tobacco rattle virus,TRV)载体pBINTRA6与pTV00,由英国Sainsbury实验室Baulcombe教授惠赠。
Trizol(Invitrogen)、M-MLV Reverse Transcriptase、各种限制性内切酶(MBI)、TaKaRa ExTaq®、DNA凝胶回收试剂盒(全式金)等,以及各种实验室常规试剂。
1.2 Mlo基因的克隆、序列分析及定量表达分析
Trizol法提取瓜叶菊叶片总RNA,反转录合成cDNA,使用Primer Premier 5.0根据Mlo基因同源序列保守区设计兼并引物Mlo-F和Mlo-R,PCR扩增中间片段。根据中间片段测序结果设计GSP3-1、GSP5-1和GSP5-2等3条巢式引物,进行RACE克隆。扩增产物链接pMD®18-T Vector载体,转化大肠杆菌感受态Trans5α,筛选阳性克隆,经菌落PCR鉴定后测序。拼接测序结果后设计cDNA全长引物MloORF1和MloORF2,TaKaRa LATaqDNA聚合酶扩增全长后测序,并用生物信息学软件进行序列分析(见表1)。
Trizol法分别提取接种白粉菌0、1、3、5、7 d的瓜叶菊根、茎、叶的总RNA并进行质量检测,反转录合成cDNA模板,备用。以内参Actin为对照,在Bio-Rad iQ5荧光定量PCR仪上进行PCR扩增,检测基因的相对表达量。每个样品重复测4次,平均值为最终测定结果。
1.3 烟草脆裂病毒载体pTV00与pBINTRA6载体连接大肠杆菌感受态
将-80℃中保存的病毒载体在4℃冰箱中进行解冻,时间为1 d。第2天连接大肠杆菌DH5α感受态,涂板过夜,蓝白斑筛选,挑取白色单菌落摇菌,提取质粒检测。
1.4 目的片段与病毒载体pTV00连接
提取Mlo中间片段质粒,将进行酶切的片段克隆,在引物两端加上酶切位点以及保护碱基,引物为:正向引物:5'-HindⅢ-3'5'gggAAGCTTccCTCTA AGACATGGTTTTATC 3';反向引物:5'-BamHⅠ-3' 5'cgcGGATCCgcgATGACTTGTAGTTTTGCTC 3'。以中间片段为模板进行PCR扩增。取PCR扩增产物5 μL,1%琼脂糖凝胶电泳检测,用DL2000作参照判断扩增产物大小。得到酶切片段Mlo-1连接大肠杆菌,涂板过夜,摇菌。之后用质粒提取试剂盒进行质粒提取。将目的基因质粒与病毒载体质粒用HindⅢ和BamHⅠ对其进行双酶切处理,将双酶切之后的产物进行胶回收处理。将胶回收后的产物T4连接酶连接,转化大肠杆菌。菌液PCR鉴定及双酶切鉴定为重组子。
1.5 重组病毒载体向农杆菌导入
首先制备农杆菌感受态:从LB平板上挑取新鲜的GV3101单菌落,接种于含50 mg·L-1Rif的10 mL LB液体培养基中,28℃震荡培养过夜。取上述菌液,以1∶50或1∶100稀释比接种于20 mL液体LB中,继续培养至OD600约0.4。菌液置于冰上20 min,转入经灭菌的1.5 mL Ep管中,4℃,5 000 r·min-1离心10 min,收集沉淀菌体。将菌体重悬于800 μL冰预冷的0.05 mol·L-1无菌CaCl2中,冰浴30 min。4℃,5 000 r·min-1离心10 min。弃上清,收集菌体,向每管中加200 μL冰预冷的0.05 mol·L-1无菌CaCl2,用枪头轻轻吹吸菌体,重悬沉淀细胞,4℃保存,24~48 h后使用。将重组病毒载体、pBINTRA6载体以及pTV00空载体分别向农杆菌GV3101感受态中导入,进行菌液PCR检测。

表1 引物序列Table 1 Primers and their sequence
2 结果与分析
2.1 Mlo基因的克隆和序列结构分析及Mlo基因的表达分析
以叶片总RNA反转录得到的cDNA为模板,利用兼并引物PCR扩增得到1个812 bp的片段(见图1)。根据所得到的瓜叶菊Mlo基因的中间片段,分别从5'端和3'端扩增出586和372 bp的序列。根据拼接结果,设计特异引物Mlo-特异F和Mlo-特异R,扩增得到1个1 296 bp的的开放阅读框,编码431个氨基酸,经NCBI数据库BLAST分析结果显示,该序列属于Mlo基因超家族。
用CLASTALW2软件进行序列比对,结果表明,Mlo基因核苷酸序列同源性为75%~85%,氨基酸序列同源性为85%~100%,其中与拟南芥Mlo12的氨基酸完全同源。
通过2-ΔΔCt法对Mlo基因在瓜叶菊根、茎、叶以及在白粉菌诱导不同时间后的荧光相对定量数据进行处理分析。结果表明,叶片中Mlo基因的相对表达丰度高,根、茎中Mlo基因的相对表达丰度有所减少,且在根中最低;Mlo基因在白粉菌诱导1 d时相对表达丰度最高,7 d最低,而3~5 dMlo基因的相对表达丰度稍有提高(见图2)。
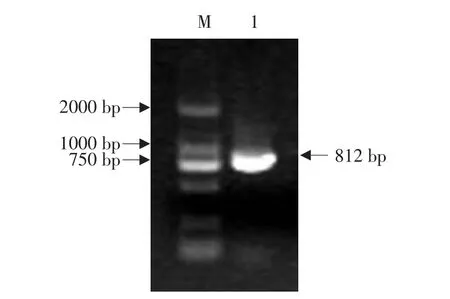
图1 Mlo基因的RT-PCR扩增结果Fig.1 PCR amplification of Mlo gene
由图2可见,瓜叶菊在白粉菌诱导时极易感病,且Mlo基因表达量较高。所以,Mlo基因可能参与瓜叶菊白粉病的调控过程,需要将Mlo基因进行沉默来验证Mlo基因对瓜叶菊白粉病的调控机制。
2.2 瓜叶菊中Mlo-1片段的克隆
以Mlo基因中间片段为模板,利用兼并引物PCR扩增出的Mlo-1片段,琼脂糖凝胶电泳显示在313 bp处出现扩增条带(见图3)。
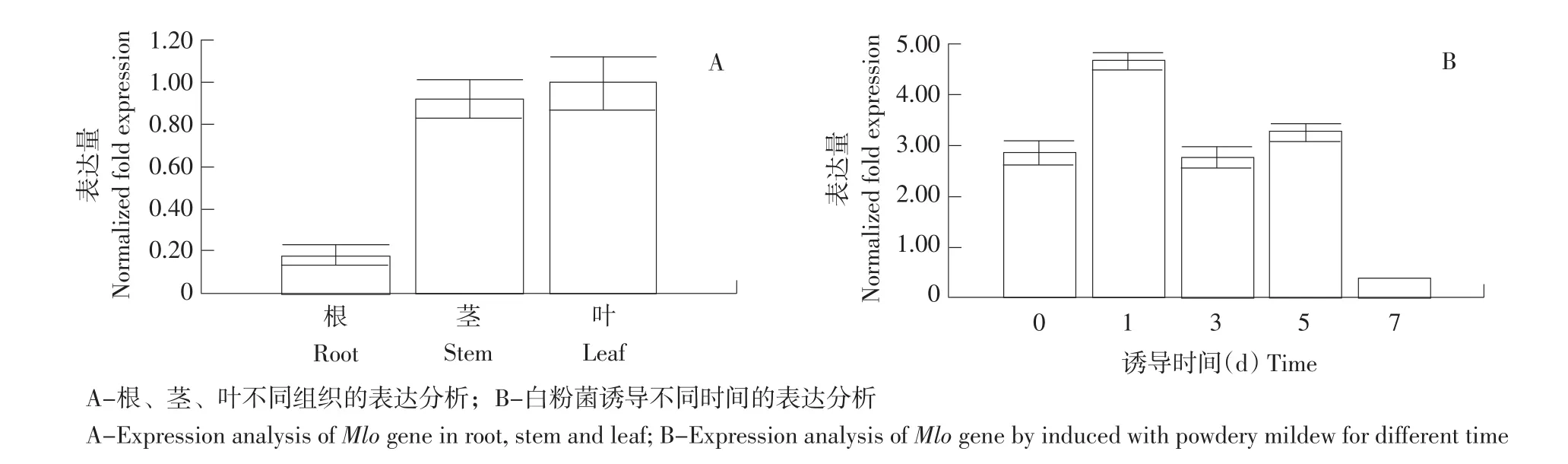
图2 Mlo基因的Real-Time PCR表达分析Fig.2 Real-Time PCR analysis of the expression of Mlo gene

图3 Mlo-1序列扩增电泳结果Fig.3 PCR amplification of Mlo-1 gene
2.3 重组病毒载体的构建
将Mlo-1基因片段连接大肠杆菌感受态,涂板过夜,提取质粒,与病毒载体质粒用限制性内切酶HindⅢ和BamHⅠ进行双酶切,T4连接酶连接。
然后将重组病毒载体质粒转化大肠杆菌,经菌液PCR以及限制性内切酶HindⅢ和BamHⅠ双酶切鉴定与预期结果一致为阳性克隆(见图4)。

图4 重组质粒的PCR鉴定及双酶切鉴定Fig.4 PCR identification and double digestion identification of recombinant virus plasmid
2.4 重组病毒载体转化农杆菌
PCR鉴定转化到农杆菌GV3101的重组病毒载体,PCR结果表明,以重组农杆菌阳性菌落为模板均扩增出313 bp的片段。转化到农杆菌的重组病毒载体符合预期特异条带大小,证实重组病毒载体转化农杆菌GV3101成功(见图5)。

图5 含重组病毒载体的农杆菌菌液PCR鉴定Fig.5 PCR identification of the recombinant virus plasmid in bacterium Agrobacterium
3 讨论与结论
本研究首次从瓜叶菊中成功克隆Mlo基因,序列分析证明该基因是拟南芥Mlo基因的同源基因。序列分析表明,该基因与其他外源植物核苷酸序列同源性均在75%以上,氨基酸序列同源性均在85%以上。
荧光定量分析表明,Mlo基因具有组织特异性表达模式。研究显示野蔷薇的叶片、花瓣和花中,RmMlo基因都有表达,但根不表达;拟南芥根、茎、叶、花序和芽中,AtMlo基因都有表达[13-14];而瓜叶菊Mlo基因表达模式却有所差异,根、茎和叶片中,Mlo基因都有表达。瓜叶菊叶片中Mlo基因表达量有较高的水平,根、茎中Mlo基因表达量有所减少,且根中Mlo基因表达量最低。该差异产生原因是由于双子叶植物类群的功能分化及木本和草本植物不同抗性进化调控模式。
白粉菌诱导对Mlo基因表达有一定影响。在白粉菌诱导处理下,瓜叶菊Mlo基因在0 d时存在相应表达,之后逐渐提高,在1 d时表达量达到最高峰,3~5 dMlo基因表达量有所减少,但仍比未诱导前有所提高,7 d后,表达量开始下降。这与已报道的拟南芥和甜瓜Mlo基因表达模式相似[6],说明Mlo基因可能参与瓜叶菊白粉病的调控过程,并在瓜叶菊白粉病的防治中发挥一定作用,但其调控机制还有待进一步研究。
本文利用PCR方法从瓜叶菊中克隆Mlo基因的部分序列。将克隆的Mlo-1克隆转入pTV00载体,并成功转化入农杆菌GV3101。准备用这些携带有重组病毒载体的农杆菌侵染健康瓜叶菊。
重组载体可沉默瓜叶菊中的Mlo基因,预计瓜叶菊植株内Mlo基因合成会大量减少。通过测定有沉默现象的瓜叶菊和对照组瓜叶菊中Mlo基因含量,即可证明Mlo基因对瓜叶菊白粉病影响,为未来从分子层面调控瓜叶菊白粉病奠定基础。
[1]刘继成,张玉英,李小燕.瓜叶菊主要病虫害及其防治[J].现代园艺,2010(2):43-44.
[2]Pryor T,Ellis J,Dodds P.Structure,function and evolution of plant disease resistance genes[J].Current Opinion in Plant Biology,2000(3):278-284.
[3]Bonnema G,Bai Y,Huang C C,et al.QTLs for tomato powdery mildew resistance(Oidium lycopersice)in Lycopersicon parviflorum G1.160 co-localize with two qualitative powdery mildew resistance genes[J].Mol Plant-Microbe Interact,2003,16:169-176.
[4]何树海,武瑛.瓜叶菊白粉病的发生与防治[J].中国农村小康科技,2003(10):11.
[5]鲁红.早春佳卉──瓜叶菊[J].河北农业,2000(4):25.
[6]程鸿.甜瓜APX和Mlo基因的克隆与功能分析[D].泰安:山东农业大学,2009:343-360.
[7]芦亮亮,傅达奇,刘海萍.番茄中维生素E合成相关基因的VIGS载体构建及侵染[J].北方园艺,2011(16):139-142.
[8]马红珍,裴冬丽,耿慧霞.病毒诱导番茄的基因沉默[J].西北植物学报,2009,29(8):1531-1537.
[9]谢文杰.小麦Tamlo基因家族成员片段的克隆[D].杨凌:西北农林科技大学,2001:101-110.
[10]田振东,柳俊,谢从华.cDNA文库与RACE方法结合克隆一个马铃薯病程相关蛋白基因cDNA[J].遗传学报,2003,30(11):996-1002.
[11]陈润生.生物信息学及研究进展[J].医学研究通讯,2002,31(12): 2-5.
[12]Pazos F,Stemberg M.Automated prediction of protein function and detection of functional sites from structure[J].Proe Natl A ead Sci,2004,101:14754-14759.
[13]Dietz K J,Rudloff S,Ageorges A,et al.Subunit E of the vacuolar H+-ATPase of Hordeum vulgare L:cDNA cloning,expression and immunological analysis[J].The Plant Journa,1995,18:521-529.
[14]Chen Z Y,Andreas H H,Wu M J,et al.Expression analysis of the AtMlo gene family encoding plant-specific seven-transmembrane domain proteins[J].Plant Molecular Biology,2006,60:583-597.
Cloning and analysis ofMlogene fromPericallis hybridaB.Nord.and VIGS vector construction
WANG Jingang,LV Yuanda,LI Shengying,YANG Tao,BAI Ding,DUAN Ran,LIU Yan(School of Horticulture,Northeast Agricultural University,Harbin 150030,China)
In this paper,Mlogene full length cDNA was obtained by reverse transcription polymerase chain reaction(RT-PCR)and RACE,then through VIGS vector gene silencing technology to build and transferred intoAgrobacteriumGV3101.The result of sequence analysis indicated that the Mlogene fromPericallis hybridaB.Nord contained about 1 296 bp,encoding 431 amino acids.Finally, through fluorescence quantitative analysis,we found thatMlogene showed the highest expression level in leaves and the lowest in root.According to PCR results and double digestion results showed the vector was successfully constructed.PCR results showed that the carrier through the broth had been successfully transferred toAgrobacteriumGV3101.The research for the next step in the analysis of gene silencing cineraria provides the basis for changes inMlogene.
Pericallis hybridaB.Nord;Mlogene;RACE cloning;sequence expression analysis; vector construction
Q949.783.5;Q785
A
1005-9369(2014)05-0026-05
2013-09-12
黑龙江省自然科学基金项目(C201112);黑龙江省博士后科研启动基金项目(LBH-Q10144);东北农业大学博士启动基金
王金刚(1974-),男,教授,博士,硕士生导师,研究方向为园林植物遗传育种。E-mail:wangjingang99@aliyun.com
时间2014-5-12 9:01:07[URL]http://www.cnki.net/kcms/detail/23.1391.S.20140512.0901.014.html
王金刚,吕远达,李声影,等.瓜叶菊Mlo基因的克隆、分析及VIGS载体构建[J].东北农业大学学报,2014,45(5):26-30.
Wang Jingang,Lv Yuanda,Li Shengying,et al.Cloning and analysis ofMlogene fromPericallis hybridaB.Nord.and VIGS vector construction[J].Journal of Northeast Agricultural University,2014,45(5):26-30.(in Chinese with English abstract)
