利用组织芯片技术研究CDX2和MUC2在萎缩性胃炎及胃癌组织中的表达①
2014-01-13陈淑敏邹宗楷唐忠辉沈洪武苏海燕陈雅静林彩环
陈淑敏,邹宗楷,唐忠辉,沈洪武,苏海燕,陈雅静,林彩环
(1.漳州卫生职业学院病理学教研室,福建 漳州 363000 E-mail:chensm1705@163.com;2.福建省漳州市医院病理科,福建 漳州 363000)
胃癌是我国最常见的消化道肿瘤,其发病率居各类肿瘤的首位。胃癌的发生发展是多基因改变的结果。尾侧型同源转录 因 子2(caudal type homeobox transcription factor-2,CDX2),属肠特异性转录因子,对肠上皮细胞的分化、凋亡和肠道特定基因的转录起调控作用。黏蛋白2(mucin 2,MUC2)是MUC2基因编码的一种分泌性黏蛋白,主要功能是在肠腔的上皮表面形成保护屏障。科学研究发现CDX2和MUC2在胃黏膜肠化生及胃癌组织中表达异常[1]。本实验采用组织芯片技术构建101例组织芯片,用免疫组化方法(S-P 法)检测组织芯片中CDX2和MUC2的表达,旨在探讨他们的表达与萎缩性胃炎及胃癌的关系。
1 材料与方法
1.1 临床资料 选取漳州市医院病理科2002年7月~2003年1月期间随访资料完整的41例原发性胃癌手术切除标本的蜡块及30例萎缩性胃炎标本蜡块。另胃镜活检选取30例正常胃黏膜作为对照。复习全部病例的临床资料,胃癌病例按新编常见恶性肿瘤诊治规范进行组织分型、区域淋巴结转移分站及TNM 分期。其中乳头状腺癌6例、管状腺癌17例、低分化腺癌6例、黏液腺癌7例、印戒细胞癌1例。所有患者术前未经过任何抗癌治疗。
1.2 主要试剂 实验用兔抗人CDX2 单克隆抗体(克隆号:EPR2764Y,即用型,产品编号:RMA-0631)、鼠抗人MUC2单克隆抗体(克隆号:M53,即用型,产品编号:MAB-0075)及SP免疫组化试盒及DAB显示试剂盒均购自福州迈新生物技术开发有限公司。
1.3 组织芯片制作 步骤一:HE 染色切片形态学观察,确定目标组织:萎缩性胃炎的胃黏膜、胃癌等。步骤二:选择目标组织并分别在组织切片和相应石蜡组织上标记。步骤三:依次制作取材针、组织芯片制孔器和7×5和7×6点列阵的组织芯片受体模块[2];用取材针从已定位的石蜡上取目标组织到组织芯片受体蜡块的相应孔内,构建含有正常胃黏膜、萎缩性胃炎及胃癌的组织阵列蜡块。步骤四:将组织阵列蜡块行连续切片,切片厚度为4μm,与常规组织制片操作基本相似。
1.4 免疫组化 采用S-P方法对组织芯片切片进行免疫组化染色,DAB显色,苏木精复染,封片,具体操作按照SP 试剂盒说明书进行。以PBS缓冲液代替一抗作为阴性对照,用肠黏膜组织切片作阳性对照。
1.5 染色结果判断 染色结果采用半定量分析法:以染色强度结合阳性细胞数百分比综合计分。CDX2蛋白表达阳性为胞核出现淡黄色至棕褐色颗粒。MUC2蛋白表达阳性为胞质内出现淡黄色至棕褐色颗粒。染色强度以多数细胞呈现的染色特性(染色深浅需与背景着色相对比)计分:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。阳性细胞百分比即某类细胞5个视野(每400×高倍视野计数100个此类细胞)的阳性细胞平均数:0~5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3 分,>75%为4 分。每张切片随机取5个400倍视野,每个视野均进行染色强度计分与阳性细胞百分比计分。采用双盲法,分别由两位资深病理医师观察计分,取二者的平均评分作为每张切片的染色强度分值和阳性细胞百分比计分。最终评分为染色强度与阳性细胞百分比的乘积:0分为阴性(-),1~4分为弱阳性(+),5~8分为中度阳性(++),9~12分为强阳性(+++)。1~12分在文中都描述为阳性。
1.6 统计学方法 应用SPSS 11.0统计学软件进行分析,阳性率以%表示。采用行×列表χ2检验,Spearman 秩相关检验。P <0.05为差异具有统计学意义。
2 结果
2.1 组织芯片的质量 构建含30例正常胃黏膜、30例萎缩性胃炎和41例胃癌患者的组织芯片,30例萎缩性胃炎和41例胃癌患者的组织芯片。蜡块组织阵列排列整齐,常规切片组织形态良好。在101例组织芯片中有7例发生取材定位不准、掉片和皱折现象,其中胃癌4 例、正常胃黏膜2 例、萎缩性胃炎1例。41例胃癌中只有1例印戒细胞癌,故剔除掉。总共8例芯片在结果分析时未纳入统计。
2.2 CDX2和MUC2在正常胃黏膜、萎缩性胃炎和胃癌组织中的表达情况 在正常情况下,CDX2表达于肠黏膜上皮细胞的胞核,染色呈棕黄色。MUC2主要表达于肠道的杯状细胞的胞质中,染色呈棕黄色。本实验发现在正常胃黏膜中CDX2、MUC2无表达(见图1A 和图1B)。在29例萎缩性胃炎组织中CDX2全部表达阳性(100%),MUC2表达阳性21例(72.41%)(见图2A 和图2B)。在胃癌组织中CDX2阳性染色主要定位于细胞核,其阳性表达率为66.67%(见图3A)。在胃癌组织中MUC2主要定位于胞质,其阳性表达率为13.89%(见图3B)。CDX2、MUC2在不同胃黏膜阳性表达率差异有统计学意义(P<0.001),见表1。
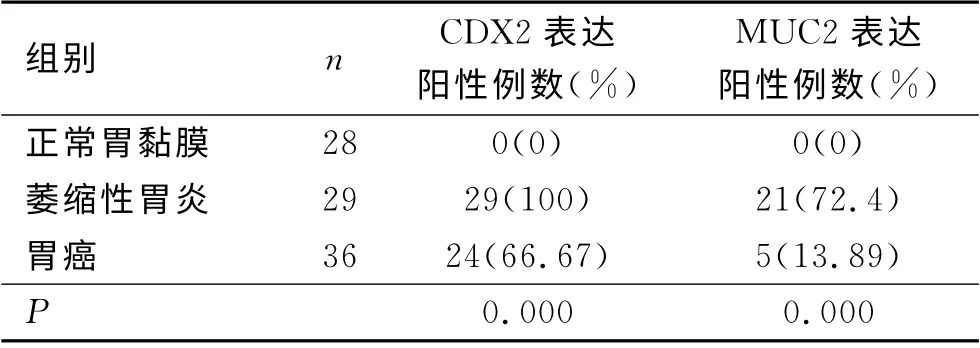
表1 CDX2和MUC2在不同胃黏膜病变中的表达
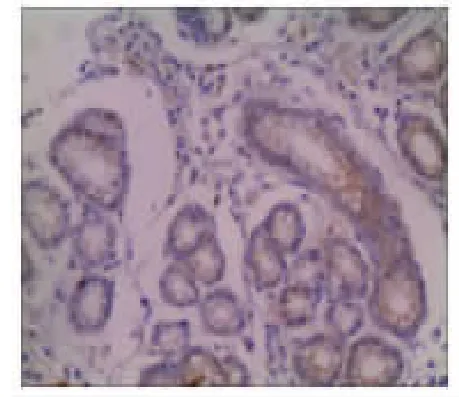
图1A 正常胃黏膜CDX2免疫组化结果(S-P法×100)
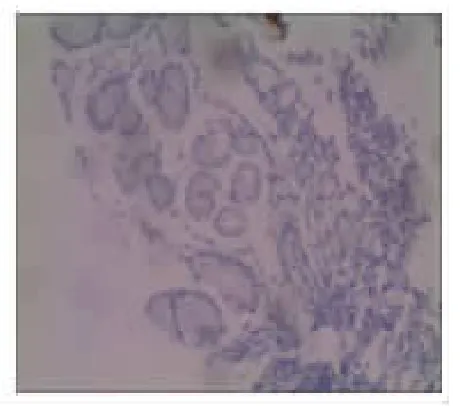
图1B 正常胃黏膜MUC2免疫组化结果(S-P法×100)
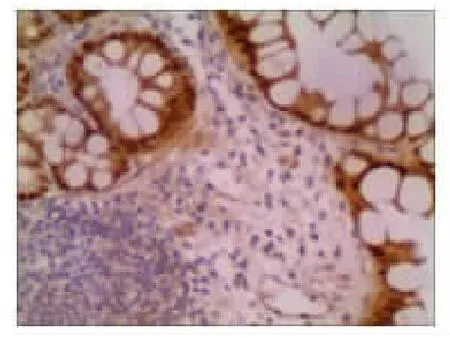
图2A 萎缩性胃炎伴肠化生CDX2免疫组化结果(S-P法×200)
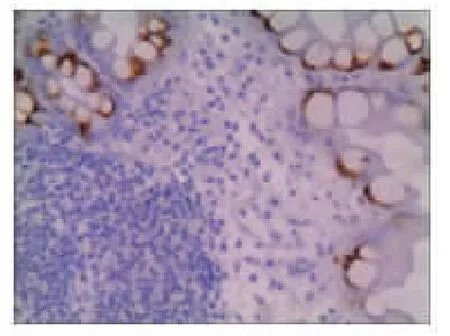
图2B 萎缩性胃炎伴肠化生MUC2免疫组化结果(S-P法×200)
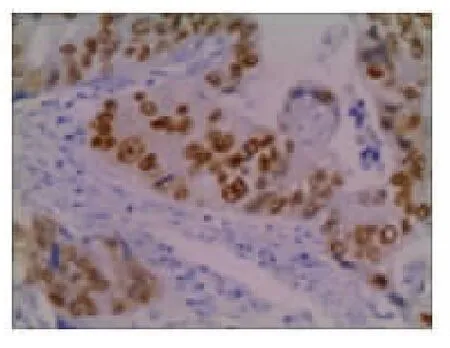
图3A 胃癌黏膜CDX2免疫组化结果(S-P法×400)

图3B 胃癌黏膜MUC2免疫组化结果(S-P法×200)
2.3 CDX2和MUC2蛋白表达与胃癌临床病理特征的关系 通过统计学分析表明,CDX2在男女性别表达差异有统计学意义(P <0.05)。CDX2 表 达 在 低 分 化 腺 癌 阳 性 率 最高(83.33%),在管状腺癌阳性率最低(58.82%),但差异无统计学意义。CDX2在高中分化程度组的阳性表达率为55%,低分化程度组阳性表达率为81.25%,差异无统计学意义(P>0.05)。MUC2在低分化腺癌阳性表达率为33.33%,黏液腺癌阳性表达率为42.86%,差异有统计学意义(P <0.05)。在高中分化程度组的阳性表达率为0,低分化程度组阳性率31.25%,差异有统计学意义(P <0.05)。CDX2和MUC2在胃癌组织中的表达与病人年龄、浸润深度、有无淋巴结转移、TNM 分期均无关(P >0.05)。以上结果见表2。
2.4 CDX2和MUC2蛋白表达的相关性 在萎缩性胃炎黏膜中CDX2表达阳性率为100%,MUC2表达阳性率为72.40%,二者无明显相关性。在胃癌组织中MUC2阳性表达的病例都发生在CDX2阳性表达的病例中,但二者无明显相关性(r =0.284,P =0.093),以上结果见表3。
2.5 CDX2和MUC2蛋白共同表达与胃癌浸润转移的关系 CDX2和MUC2表达阳性者共5例,全部累及肌层甚至达浆膜层,全部有淋巴结转移,3例TNM 分期为Ⅲ期或Ⅳ期。CDX2(+)/MUC2(-)者共19例,累及肌层甚至达浆膜层13例,有淋巴结转移的有18例,10例TNM 分期为Ⅲ期或Ⅳ期。CDX2(-)/MUC2(-)者共12例,累及肌层甚至达浆膜层9例,有淋巴结转移的有11例,8例TNM 分期为Ⅲ期或Ⅳ期。以上结果见表4。
3 讨论
本实验采用组织芯片技术,具有高通量的优点,提高实验效率;使实验对照平行化,减少实验误差。实验中使用自制的组织芯片制孔器制作受体蜡块,一次制孔完成,省时省力,减少了实验费用。
本实验发现CDX2在不同胃黏膜阳性表达率差异有统计学意义(P <0.001)。CDX2在正常胃黏膜上皮中不表达,在萎缩性胃炎中全部表达阳性(100%),与文献结果相似[3],可能与所选取病例都是萎缩性胃炎伴肠上皮化生有关。切片观察发现阳性表达都发生于肠化生的杯状细胞,提示CDX2的表达是发生胃黏膜肠化生的重要起始事件,而萎缩性胃炎伴肠上皮化生是胃癌的癌前病变。正常胃黏膜上皮没有CDX2表达,但胃癌中却有较高表达,并与分化程度无关,提示CDX2可能具有区分非肿瘤性和肿瘤性胃黏膜上皮的潜能。在胃癌黏膜组织中CDX2的表达低于萎缩性胃炎,考虑CDX2基因的突变可能导致CDX2表达缺失,最终导致胃癌的发生[4]。另外,本实验结果与朱惠君等[5]相似,发现CDX2 异常表达与组织学分型、年龄、临床病理分期、分化程度、淋巴结转移等因素无关。本实验发现CDX2的阳性表达有男女差别,且差异有统计学意义,考虑:①本实验的病例数较少,应增加标本数减少偏差;②CDX2表达确实与性别有关,是否与不同性别基因易感性不同有关,具体机制需要进一步探讨。
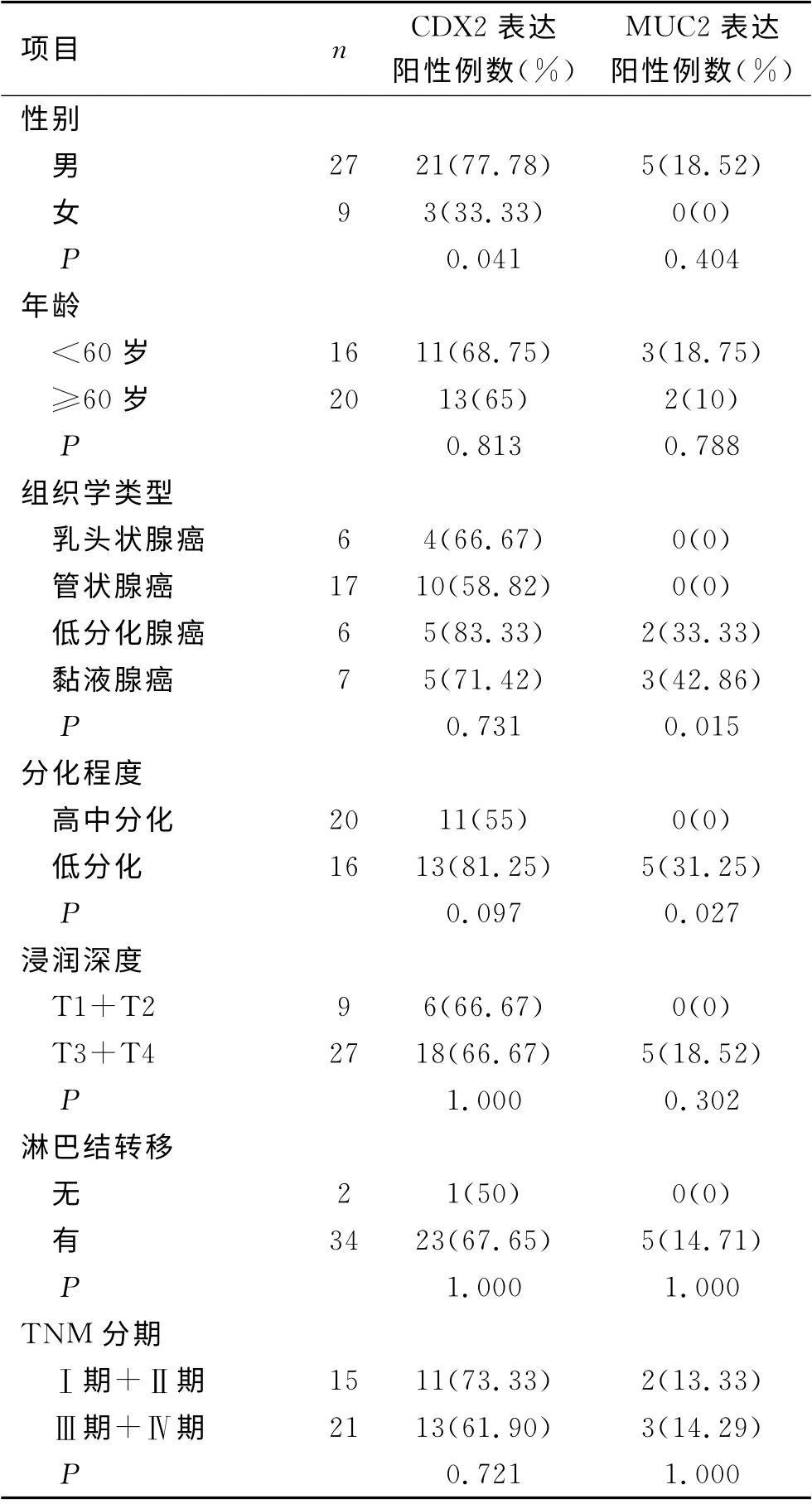
表2 CDX2和MUC2的表达及其与胃癌临床病理特征的关系

表3 胃癌组织CDX2和MUC2表达的相关性
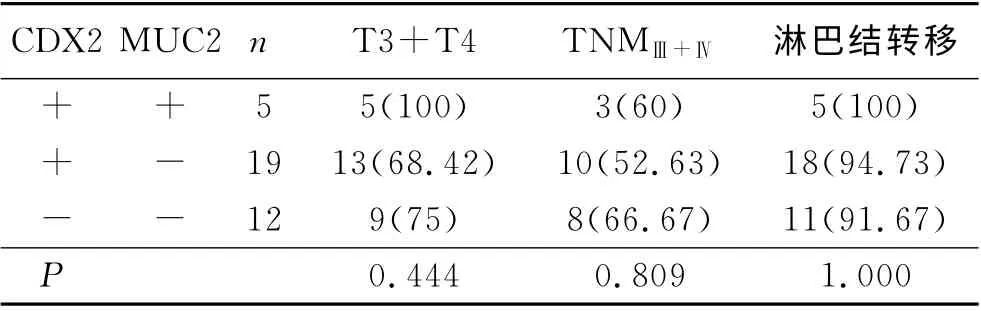
表4 胃癌CDX2、MUC2共同表达与胃癌浸润转移的关系 (n,%)
本实验发现MUC2在不同胃黏膜阳性表达率差异有统计学意 义(P <0.001)。MUC2 蛋 白 表 达 于 萎 缩 性 胃炎(72.41%),可能与MUC2蛋白在上皮更新分化方面具有重要作用有关。胃癌中黏液腺癌和低分化腺癌MUC2阳性率高,与陈亚男等[6]、南则仲等[7]研究结果相似,认为MUC2可作为研究黏液腺癌的较好指标。MUC2的表达与分化程度有关,主要表达于低分化程度组。本实验结果发现MUC2在胃癌组织中的表达与浸润深度、有无淋巴结转移、TNM 分期均无关,考虑肿瘤的迁移与扩散可能是多因素综合作用的结果,可能与Survivin、CD147和CD34 等异常表达有关[8]。
本实验发现不论在萎缩性胃炎或胃癌组织中CDX2 和MUC2的表达无明显相关性,与文献报道不一致[9-10]。Yamamoto等[11]认为CDX2蛋白可能通过作用于MUC2基因的启动子,上调MUC2 mRNA 的活性,共同参与胃黏膜肠化。本研究认为CDX2的表达可影响MUC2的表达,但还有其他因素共同调控和决定MUC2 的表达,具体机制需进一步深入研究。
[1] 陈淑敏,唐忠辉.CDX2和MUC2在胃癌癌变多阶段组织中的表达及意义的研究近况[J].医学 综述,2011,17(14):2111-2113.
[2] 沈洪武,叶莉,吴文乔,等.组织芯片制孔器和受体蜡块的制作[J].中华病理学杂志,2007,36(9):624.
[3] 苏帅,陈鑫,姜葵,等.CDX2、COX-2和NF-kB在胃癌和癌前病变中的表达和意义[J].中国肿瘤临床,2013,40(22):1387-1390.
[4] Song JH,Kim CJ,Cho YG,et al.Genetic alterations of the Cdx2gene in gastric cancer[J].APMIS,2008,116(1):74-80.
[5] 朱惠君,许钟,毛振彪,等.鸟甘酸环化酶C和尾型同源盒转录因子2蛋白在胃癌及癌前病变组织中的表达[J].中华医学杂志,2008,88(48):3418-3421.
[6] 陈亚男,姜懿凌,罗阳,等.胃癌组织MUC 黏蛋白表达及其与胃癌分型关系的研究进展[J].中华肿瘤防治杂志,2008,15(13):1032-1035.
[7] 南则仲,吉卫卫.MUC1和MUC2与MUC4在胃癌组织中表达及临床意义[J].山西医学教育,2008(1):60-62.
[8] 陈华生,唐忠辉,邹宗楷,等.利用组织芯片技术研究Survivin和CD147在胃癌中的表达与血管生成的关系[J].中国临床实用医学,2009,3(1):14-16.
[9] 刘杲,童仕伦.CDX2和MUC2在胃癌组织中的表达及意义[J].武汉大学学报,2007,28(3):365-368.
[10] 宋光耀,王金华,高志安,等.CDX2和MUC2蛋白表达与胃癌及癌前病变的关系[J].中华肿瘤防治杂志,2007,14(15):1129-1131.
[11] Yamamoto H,Bai YQ,Yuasa Y.Homeodomain protein CDX2regulates goblet-specific MUC2gene expression[J].Biochem Biophs Res Commun,2003,300(4):813-818.
