胰腺转移瘤的CT特点
2014-01-11刘灵灵王宇峰
刘灵灵 缪 飞 王宇峰
胰腺转移瘤较少见,发病率仅为胰腺恶性肿瘤的2%~5%[1]。笔者在复习国内外文献的基础上,对18例胰腺转移瘤的CT表现及临床资料进行回顾性分析,旨在提高该病的认识。
方 法
1.临床资料
搜集2004年9月至2014年3月临床及影像学资料较完整的胰腺转移瘤18例,其中男性12例,女性6例,年龄37~76岁,平均55岁。18例患者中,14例患者无症状,其余4例表现为:腹部不适2例,急性胰腺炎1例,黄疸1例;10例伴有胰腺外其他脏器转移。8例胰腺转移瘤与原发肿瘤同时发现,其余10例在原发肿瘤发生后4个月~6年发生胰腺转移,中位间隔时间为2年11个月。
2.CT检查方法
采用GE Light Speed 16层或64层多层螺旋CT对原始图像行薄层扫描,重建层厚3~10mm,间隔1~3mm。所有患者先行平扫,然后注射80~100ml碘海醇或碘普罗胺注射液,注射速率2~4ml/s。行上腹部或全腹部三期扫描,动脉期为对比剂注射后12~25s,间隔30s及150s后行静脉期和平衡期扫描。图像后处理采用多平面重建(MPR)技术。
结 果
原发恶性肿瘤包括:肺癌7例,肾癌3例,结肠癌2例,直肠癌、胃癌、肝癌、筛窦神经内分泌癌、骨肉瘤及心脏肉瘤各1例。
本组18例胰腺转移瘤中,10例(55.6%)表现为单发结节,源自肺腺癌6例、结肠癌2例、骨肉瘤及筛窦神经内分泌癌各1例;6例(33.3%)为多发结节,源自肾癌3例、肺鳞癌、直肠癌及心脏肉瘤各1例;2例 (11.1%)为弥漫性病变,源自肝癌及胃癌各1例。16例结节型转移瘤共发现34个病灶,5个(14.7%)位于胰头,14个(41.2%)位于胰体,15个(44.1%)位于胰尾,发生于胰腺体尾部者较多,占85.3%;2例弥漫性病变分别位于胰腺头颈体部及体尾部。转移灶直径1~8.1cm。31个病灶表现为类圆形肿块,3个表现为分叶状的肿块(图1)。大部分转移灶边界清楚,弥漫性病变边界欠清。
33个病灶表现为实性肿块,其中低密度灶15个、等密度灶18个。1个病灶表现为囊性肿块伴内部钙化。2例弥漫性病变表现为胰腺头颈体部及体尾部肿胀呈低密度。增强扫描后21个病灶呈均匀强化,其中轻度强化16个,明显强化5个;13个病灶表现为边缘强化、中心坏死区无强化,其中轻、中度强化各4个(图1、2),明显强化5个(图3);明显强化均发生于肾癌,且均为多发结节型。弥漫性病变增强后呈轻度均匀强化(图4)。在18例患者中,3例表现为胰腺周围血管受累,其中2例侵及脾血管,1例侵及胃左动脉。3例主胰管轻度扩张;1例骨肉瘤胰头转移患者出现胰胆管明显扩张。
8例胰腺转移瘤患者伴有胰腺外其他脏器转移,脑、肺、肝脏、脾脏、肾脏、肾上腺、肩关节、腹壁等部位出现一处或多处转移灶;2例患者出现下腔静脉、右肾静脉或肠系膜上静脉癌栓。
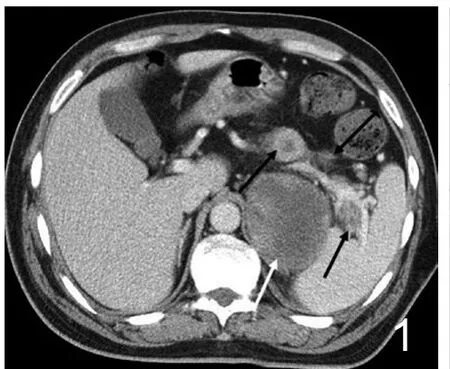
图1 男,58岁,心脏肉瘤转移至肺、胰腺、左侧肾上腺及腹壁。腹部CT增强静脉期胰腺体尾部见多枚类圆形及分叶状肿块(黑箭),大者密度不均匀、呈边缘强化而内部坏死区无强化。左侧肾上腺转移瘤可见(白箭)。
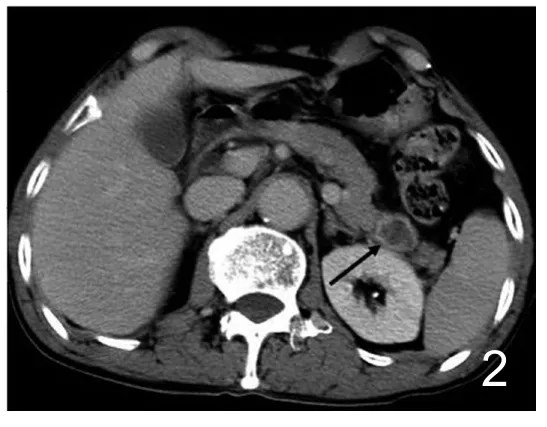
图2 男,66岁,肺腺癌胰腺转移。腹部CT平衡期:胰尾病灶边缘中度强化,中心坏死区无强化(黑箭)。

图3 男,74岁,右肾癌切除术后胰腺转移。腹部CT增强动脉期:胰头及体部见两枚类圆形肿块,密度不均匀,强化较明显,中心坏死区无强化,边界清楚。
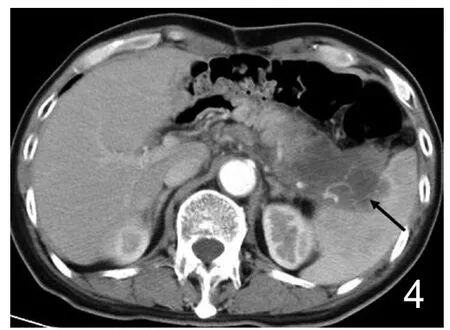
图4 男,65岁,胃癌切除术后胰腺转移。腹部CT增强动脉期:胰腺体尾部肿胀,呈弥漫性低密度影,脾动脉受累。
讨 论
胰腺转移瘤发病年龄偏大,本组平均发病年龄为55岁。最近国外文献显示胰腺转移瘤绝大多数是肾细胞癌(70.5%),其次是乳腺癌(6.8%)、肺癌(5.9%)、大肠癌(5.5%)和黑色素瘤(2.7%)[2],而骨肉瘤和食管癌[3-4]偶有个案报道。本组资料显示,居于首位的原发肿瘤为肺癌,可能与我国肺癌的发病率高且易发生血行转移有关,其次是肾癌和结肠癌,骨肉瘤1例,而筛窦神经内分泌癌及心脏肉瘤转移至胰腺在既往文献中尚未见报道。
胰腺转移瘤的临床表现无明显特异性,可表现为腹部不适、腹背部疼痛、恶心、消化道出血等[5],而50%~83%的患者没有症状[6]。本组资料中,仅4例患者出现临床症状,其余14例(77.8%)无症状。位于胰头的肿块还可压迫主胰管而致远端胰管扩张、胰腺体尾部萎缩,应与原发性胰腺癌鉴别。胰腺转移瘤是原发肿瘤细胞脱落后通过血行或淋巴道转移至胰腺,其肿瘤细胞并非起源于胰管上皮细胞,一般不造成胰管扩张,除非转移瘤浸润到胰导管上皮细胞或位于胰头的病灶压迫可引起胆总管及胰管扩张[7]。本研究中,胰胆管扩张及胰腺周围血管受侵均较少发生,此特点成为胰腺转移瘤区别于原发性胰腺癌的重要鉴别点之一。本组中,仅3例(16.7%)出现胰周淋巴结转移,因此胰周淋巴结不易发生肿大亦是胰腺转移瘤区别于原发性胰腺癌的鉴别点之一。血清CA199对原发性胰腺癌诊断价值较高,而在胰腺转移瘤患者中可表现为正常、极少数病例可升高。
胰腺转移瘤可发生于胰腺任何部位,本组资料中,发生于胰腺体尾部者较多,占85.3%;其形态主要表现为:单发结节型,最常见;其次为多发结节型;第三是弥漫浸润型。Tsitouridis等[8]的研究中,单发结节型约占63.6%,多发结节型约占27.3%,而弥漫型仅占9%。本研究结果与其接近,这3种类型所占比例分别为55.6%、33.3%和11.1%。除这3种基本类型外,胰腺还可发生囊性转移,如骨肉瘤及食管鳞癌等可出现囊性转移[3-4],推测与肿瘤易发生坏死有关,本组1例骨肉瘤患者表现为胰腺囊性转移伴内部钙化。
由于大多数转移瘤病灶较小、平扫呈等密度,容易漏诊,因此须行CT增强扫描。胰腺转移瘤存在多种强化方式,多数病灶表现为均匀或边缘强化,其强化方式与原发肿瘤的类型及血供有关[9],如肺癌、结肠癌、胃癌等的转移瘤多表现为轻度强化,而肾癌的转移瘤,表现为动脉期明显强化、静脉期及平衡期减退。胰腺往往是肾脏透明细胞癌的唯一转移部位,通常发生于肾切除术后很长一段时间[10],本组中1例肾癌患者间隔54个月后发生胰腺转移;本组间隔时间最长者为1例直肠癌患者间隔72个月后发生胰腺转移。有文献显示[11],较大的病灶(直径>1.5cm)主要表现为边缘强化,中心坏死区不强化,而较小的病变往往表现为均匀增强。本组中,1个直径>1.5cm的病灶表现为均匀强化,而多个直径<1.5cm的病灶表现为边缘强化。因此我们认为肿瘤的增强方式主要与其血供有关,当血供丰富时,肿瘤很少发生坏死。
患者有原发肿瘤病史,胰腺出现单发、多发结节或弥漫性病变,边界多清晰,较少发生胰胆管扩张及胰周血管侵犯,增强后表现为均匀或边缘性强化时,倾向于转移瘤的诊断。胰腺乏血供转移瘤需与淋巴瘤相鉴别:原发于胰腺的淋巴瘤,单发或多发肿块,常发生于胰头,病灶密度均匀,增强后呈轻至中度持续强化。富血供转移瘤需与胰腺腺泡细胞癌、透明细胞癌以及神经内分泌肿瘤相鉴别:胰腺腺泡细胞癌多位于胰头,肿瘤一般较大、密度不均匀;胰腺神经内分泌肿瘤增强后明显强化,静脉期及延迟期仍持续强化;胰腺透明细胞癌与胰腺转移性透明细胞癌在影像上较难区别,但后者有肾脏透明细胞癌病史,且多发,明确诊断需依赖病理结果。弥漫型转移瘤应与急性胰腺炎、全胰癌相鉴别:急性胰腺炎强化后边界模糊,胰周有低密度水肿带,并伴有淀粉酶升高;全胰癌表现为胰腺弥漫性肿大,肿瘤标志物CA199的升高有助于正确诊断。
总之,胰腺转移瘤CT表现具有一定特征性,综合分析其CT表现并结合原发癌病史有利于胰腺转移瘤的诊断。
[1] Ballarin R, Spaggiari M, Cautero N, et al. Pancreatic metastases from renal cell carcinoma: the state of the art. WJG, 2011, 17: 4747-4756.
[2] Sweeney AD, Fisher WE, Wu MF, et al. Value of pancreatic resection for cancer metastatic to the pancreas. J Surg Res, 2010,160: 268-276.
[3] Jin P, Wang W, Su H, et al. Osteosarcoma metastasizing to pancreas confirmed by endoscopic ultrasound-guided fine-needle aspiration.Endoscopy, 2014, 46: 109-110.
[4] Esfehani MH, Mahmoodzadeh H, Alibakhshi A, et al. Esophageal squamous cell carcinoma with pancreatic metastasis: a case report.Acta Med Iran, 2011, 49: 760-762.
[5] Sweeney AD, Fisher WE, Wu MF, et al. Value of pancreatic resection for cancer metastatic to the pancreas. J Surg Res, 2010,160: 268-276.
[6] Ahmed S, Johnson PT, Hruban R, et al. Metastatic disease to the pancreas: pathologic spectrum and CT patterns. Abdom Imaging,2013, 38: 144-153.
[7] Tan CH, Tamm EP, Marcal L, et al. Imaging features of hematogenous metastases to the pancreas: pictorial essay. Cancer Imaging, 2011, 11: 9-15.
[8] Tsitouridis I, Diamantopoulou A, Michaelides M, et al. Pancreatic metastases: CT and MRI findings. Diagn Interv Radiol, 2010, 16:45-51.
[9] Corwin MT, Lamba R, Wilson M, et al. Renal cell carcinoma metastases to the pancreas: value of arterial phase imaging at MDCT. Acta Radiol, 2013, 54: 349-354.
[10] Sellner F, Tykalsky N, De Santis M, et al. Solitary and multiple isolated metastases of clear cell renal carcinoma to the pancreas: an indication for pancreatic surgery. Ann Surg Oncol, 2006, 13: 75-85.
[11] Triantopoulou C, Kolliakou E, Karoumpalis I, et al. Metastatic disease to the pancreas: an imaging challenge. Insights Imaging,2012, 3: 165-172.
