胃肠道间质瘤CT影像特征对照病理危险度评估的相关性研究
2014-01-11苏海霞潘海虹
苏海霞 潘海虹 张 蕾
胃肠道间质瘤(gastrointestinal stromal tumors,GIST)是少见的胃肠道间叶源性肿瘤,具有潜在恶性,占胃肠道恶性肿瘤1%~3%[1]。GIST免疫组化通常为CD117、CD34或DOG-1表达阳性[2]。因其在生物学形态上具有侵袭性即复发及转移性,临床常规通过病理学评估GIST手术预后侵袭危险性,但其无法为术前选择合理的治疗手段提供判断依据。国内外多有文献报道GIST的CT影像特征,在影像学上具有一定特征性,术前不同CT特征的GIST之间术后病理危险度分级存在显著差异,提示CT在GIST诊断和鉴别诊断中起重要作用[3-4]。但CT影像特征与评估GIST病理危险度和肿瘤特征之间的相关程度,即相关系数尚待明确。本研究旨在回顾性分析CT影像特征: 肿瘤密度、大小、形态、边界、生长方式、发生部位和强化程度等评估GIST肿瘤特征和病理危险度之间的相关性,为运用影像学检测早发现、早诊断GIST,正确预评估其侵袭性,减少GIST的临床复发率提供有效的手段。
方 法
1.一般资料
收集2010年7月~2013年7月间经术后病理及免疫组化确诊的41例GIST,男性20例,女性21例,年龄34~88岁(平均61.6±13.7岁),中位年龄63岁。主要临床表现为腹胀腹痛及烧灼不适25例,黑便5例,饭后饱胀感伴反酸嗳气3例,触及腹部包块2例,其他6例为电子胃镜检查时偶尔发现。
2.检查方法
采用Philips 64层螺旋CT扫描,检查前禁食、禁水10~12h,扫描前15min口服温水500~1000ml充盈胃腔。患者仰卧,扫描范围自膈顶至耻骨联合下缘。扫描参数:管电压120kV,管电流250mA,层厚及层距3.0mm,螺距1.173,显示野(FOV)350mm。动脉期延迟32s,门脉期延迟55s。经肘前静脉注射非离子型对比剂,注射速率:2.5ml/s。
3.CT观察指标
①肿瘤最长径:在轴位图像测量肿瘤最长径,以<2cm、2.1~5cm、5.1~10cm及>10cm四组;②CT值:选取肿瘤最大层面,采用感兴趣区ROI (region of interest)描记法统一测量区域,避开血管、钙化及坏死囊变区,获得实质病灶平扫、动脉期、静脉期CT值(HU),较大病灶多点测量取其平均CT值,判断病灶的强化程度。按轻度强化为CT值增值6~21HU,中度强化CT值增值21~40HU,CT值增值>40HU为明显强化;③生长方式:腔内生长、腔外生长、混合型生长;④形态:分规则及不规则;⑤界限:根据肿瘤周围脂肪间隙及与周围组织器官的界限分为边界清晰及边界不清;⑥质地:根据肿瘤内部是否有坏死囊变分为密度均匀及不均匀。⑦生长部位:根据病灶初发所在部位,为肿瘤的生长部位。
4.CT图像预评估GIST肿瘤良恶性倾向
复习文献[3,5-8]预评估GIST良恶性倾向标准如下:①良性倾向:肿块直径≤5cm,形态规则,呈实体密度且均匀,与周围组织分界较清,增强扫描肿块实性部分强化较明显;②恶性倾向:肿块直径>5cm,形态不规则,边界不清对周围组织有浸润,周围见肿大淋巴结;肿块密度不均匀,其内部出现大小不等的囊变坏死区,囊变区可见出血。增强扫描后肿块呈轻中度至明显不均匀强化。
5.病理危险度分级标准
判断GIST的生物学行为一直是一道难题,病理危险度分级标准不一,有Fletcher、Miettinend及NIH标准。本研究采用中国胃肠间质瘤诊断治疗专家共识推荐2008版美国国立卫生署(National Institute of Health,NIH)的危险度分级标准[2]。将GIST术后危险度分为极低度、低度、中度、高度4级(表1)。
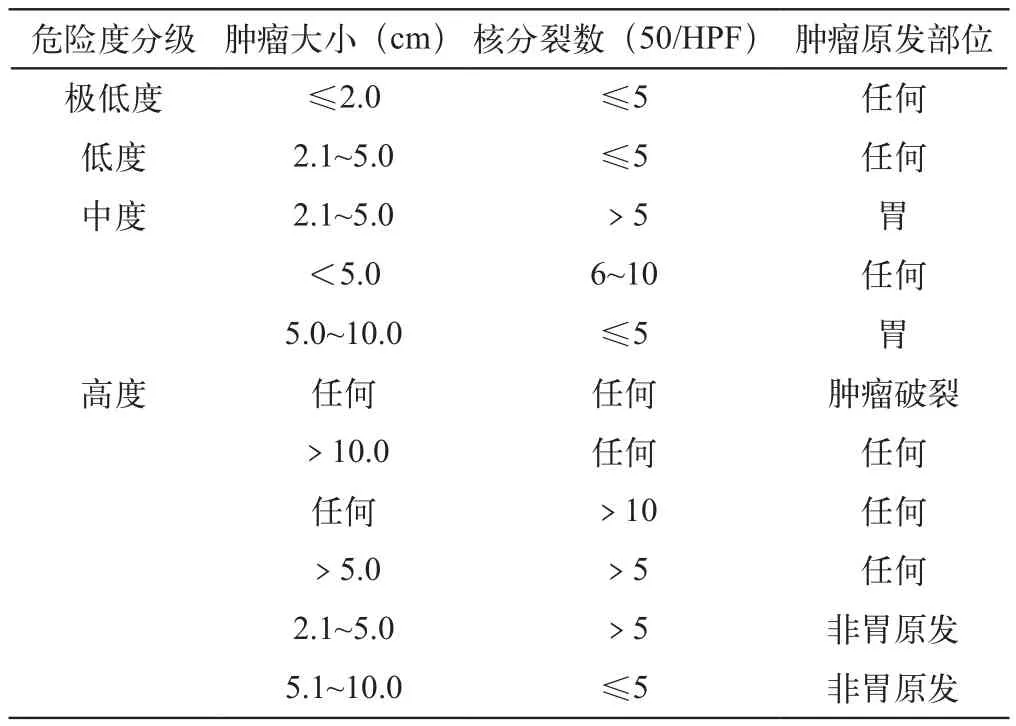
表1 NIH原发GIST切除后的风险分级(NIH 2008版)
6.统计学分析
采用皮尔逊(pearson)相关系数法,确定相关系数r值,探寻各个变量或因素之间的相互关系及其相关方向,从而反映对比变量的密切程度。一般划分为:∣r∣<0.4为低度相关;0.4<∣r∣<0.7为显著性相关;0.7<∣r∣<1为高度相关。CT评估为恶性倾向的GIST,术后病理危险度分级为中、高度的概率比较采用χ2检验分析。
结 果
1.手术及病理结果(表2)
本组41例免疫组化均符合GIST诊断。手术证实41例为单一部位单发病灶,发生在胃部的27例,小肠13例,1例发生在食管下段近贲门部。病理危险度分级高度危险16例,中度危险11例,低度危险10例,极低度危险4例。12例肿块突破浆膜层,大网膜和肠系膜发生粘连,其中5例周围可见肿大淋巴结,病理结果均为反应性增生;淋巴管内瘤栓及脉管内瘤栓各1例,但手术上下切缘均未见瘤组织,且淋巴结未见瘤转移。本组41例GIST均未见转移灶。
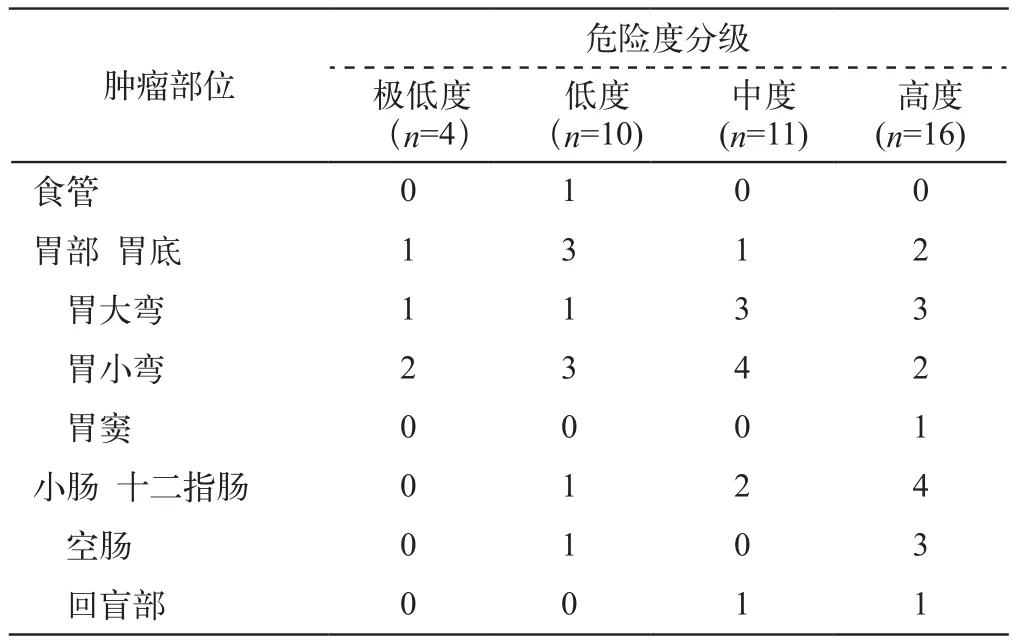
表2 不同病理类型GIST发生部位的分布
2.CT预评估GIST与病理分级相关性(表3)
通过CT图像各项观察指标进行肿瘤良恶性度的预评估,对照病理危险度结果显示:其中良性倾向肿块17例(图1),对比病理危险度分别为:极低度危险占23.5% (4/17)、低度58.8%(10/17)、中度17.6%(3/17)、高度0%(0/17)。CT预评估为恶性倾向肿块24例(图2、3),极低度和低度危险性分级未出现在恶性肿块中0%(0/24)、中度占33.3%(8/24)、高度占66.6%(16/24)。CT预评估为良性倾向肿块危险度分级为中度及高度仅占17.6%,而CT评估为恶性倾向的肿块,其侵袭性表现为中度及高度的比例显著增大(P<0.0001)。统计显示CT预评估GIST的恶性度与病理分级数据呈正相关且高度相关(r=0.771)。
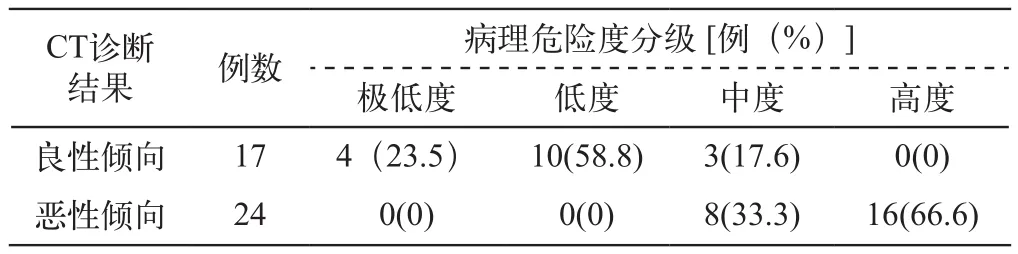
表3 CT预评估 GIST患者恶性度与病理危险度分级
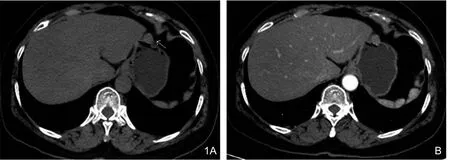
图1 胃间质瘤,低度危险。A.胃体大弯侧见2cm×2cm结节样软组织影,与胃壁边界清晰,密度均匀,病灶周围脂肪间隙清晰。B.增强后呈明显均匀强化。
3.CT特征与不同危险度GIST的相关程度(表4)
利用CT强大的数据后处理功能,综合分析肿瘤的大小、形态、边界、密度、强化程度、病灶内部有无坏死囊变等影像特征,探寻GIST的CT特征与病理侵袭程度之间的对应关系。数据显示肿瘤的大小、密度及有无坏死囊变与GIST侵袭性的关联度最高,r值分别为0.769、0.777和0.777;而病灶的形态、边界的关联度其次,r值分别为0.673和0.573;肿瘤的生长方式与侵袭性的相关程度较弱,r值仅0.493;而强化程度与病理危险度分级之间出现负相关(r=-0.205)。各CT征象之间相关性比较,显示病灶的密度与病灶内部坏死囊变征象之间的相关系数呈完全相关(r=1)。病灶的大小与形态、边界、密度及生长方式之比较也相关联(相关系数分别为r=0.689、0.690、0.578、0.434)。数据之间相互印证。因此CT特征在反映不同危险度GIST的相关程度存在差异,其判断价值大小依次为:肿瘤密度>大小>形态>边界>生长方式>发生部位。
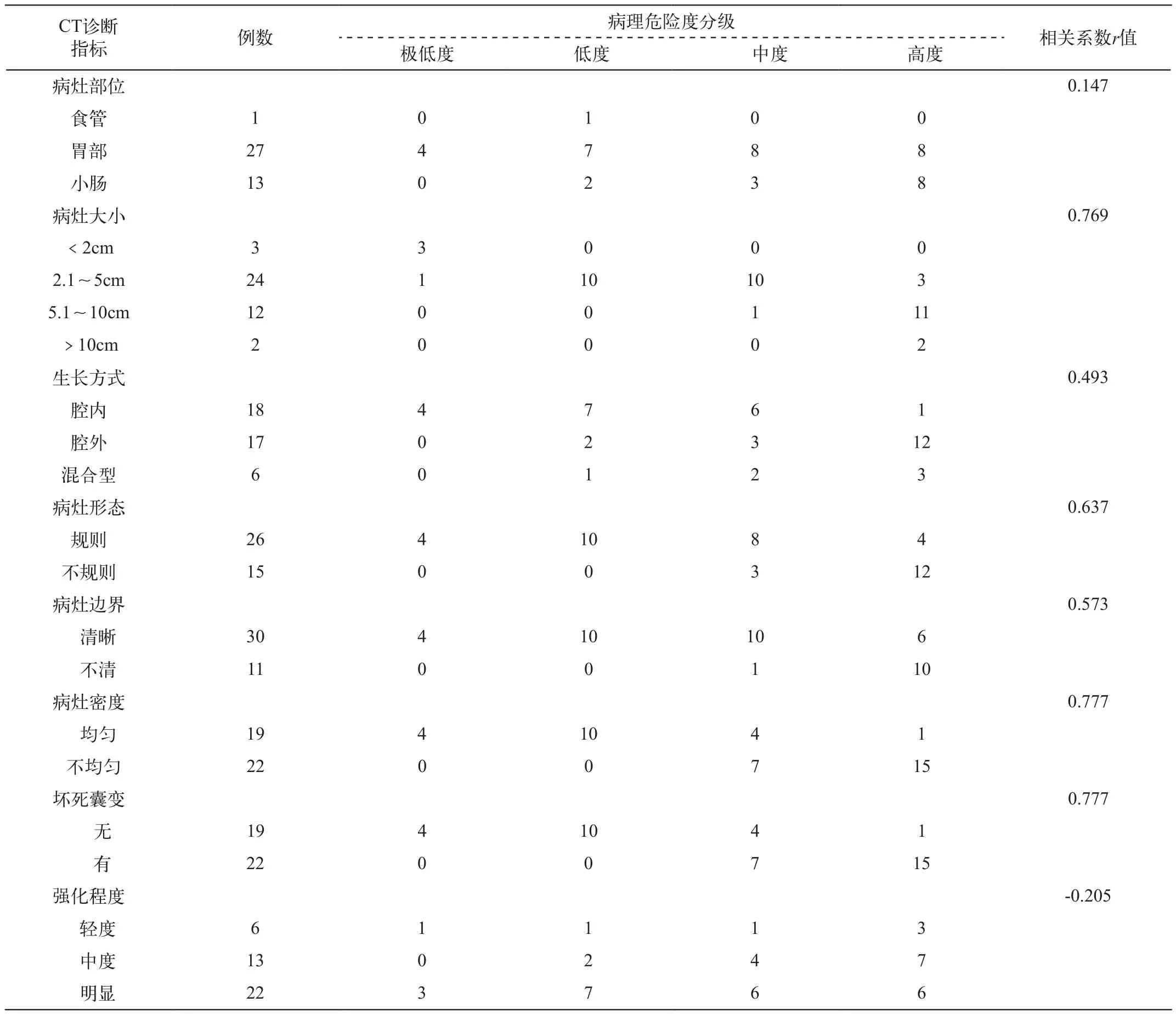
表4 不同危险度GIST的CT影像比较
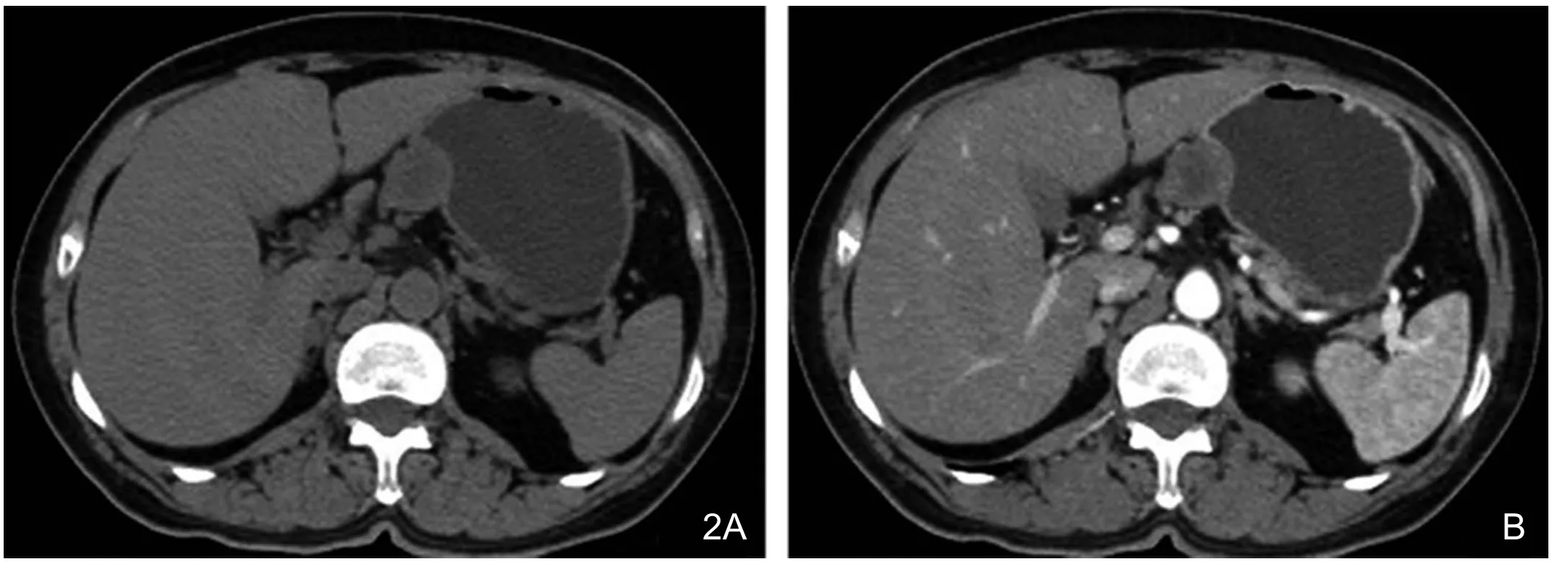
图2 胃间质瘤,中度危险。A.胃体小弯侧见2.5cm×3.3cm向腔外突出肿块影,边界清晰,内见低密度坏死灶。B.增强后为中度不均匀强化,病灶周围见簇状供血血管,与周围组织界限清晰。
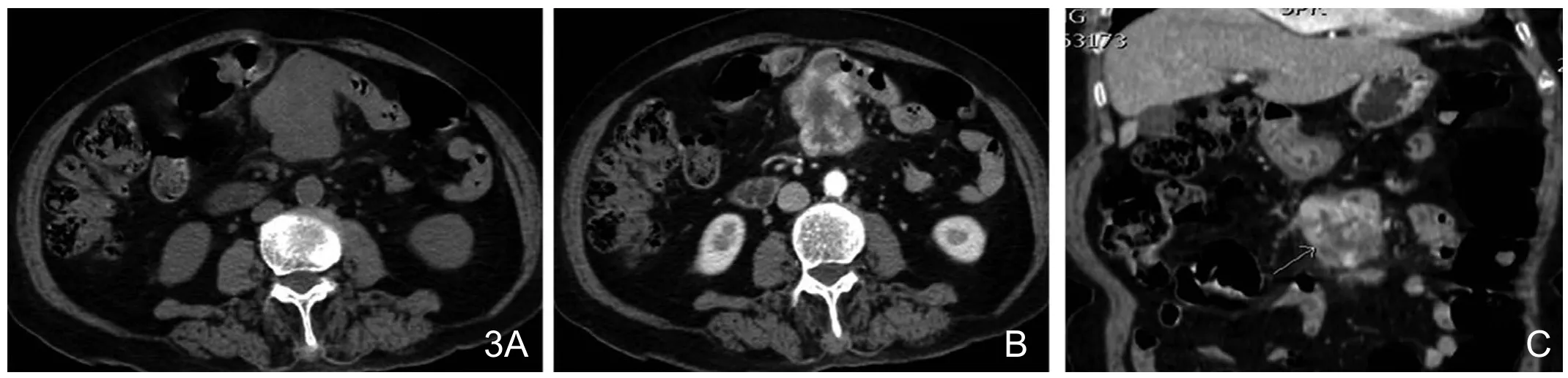
图3 小肠间质瘤,高度危险。A.空肠上段腔外生长不规则肿块影,呈分叶状,内可见低密度坏死,边界尚清,未见肠道梗阻。B.增强后不均匀结节状明显强化。C.MPR图像,病灶周围脂肪间隙模糊,见肿大淋巴结影。
讨 论
目前认为GIST均具有潜在恶性[9],手术治疗是GIST首选的治疗手段。根据2011版CSCO及NCCN外科综合治疗指南,术前准确判断GIST的良恶性以及恶性程度,制定合理的手术方案是治疗成功的关键。CT扫描因具有良好的空间分辨率及密度分辨率,可以对GIST进行全方位评估,为充分、准确地对肿瘤进行术前定位、定性诊断提供重要依据。
1.GIST的CT征象与病理学危险程度分级的相关性
Ulusan等[10]对30例GIST的回顾性研究发现>5cm的肿瘤,术后病理为高度危险性的频率增加。李玉林等[6]研究显示肿瘤>10cm的均为高度恶性。本研究发现肿瘤的大小与病理危险程度呈高度正相关,其相关系数r值高达0.769,2cm≤肿瘤直径<5cm者的病理分级以中度及高度危险性居多,同时14例肿瘤直径>5cm的GIST中13例病理分级均呈高度危险性。结果反映随肿瘤直径逐渐增大,其危险度分级越高,肿瘤术后可能复发及转移的概率增大,表明肿瘤大小可提示恶性程度。
孙烨等[11]发现高危险程度与较低危险程度GIST在发生部位上有统计学差异,但未提供相关性数据。Miettinend等[12]报道GIST的生长部位与恶性度之间有一定意义,但需结合病理核分裂数根据和生长部位评判预后。本研究显示,虽然小肠GIST的恶性程度显著高于胃GIST(P<0.001),但肿瘤生长部位与肿瘤的侵袭性之间相关程度较弱(r=0.147),故肿瘤的发生部位较难以作为单一因素来评估GIST的危险性。
宋晓丽等[13]的研究表明不同强化程度GIST的危险程度具有显著差异。也有文献[6,14]报道不同危险性GIST的强化程度之间无统计学差异。本研究通过病灶的强化程度与病理分级之间相关性分析两者之间呈现负相关(r=-0.205),故肿瘤的强化程度对GIST侵袭性的判定不具有指导意义。同样,文献关于不同GIST生长方式是否有益于判断GIST危险度的认识亦不一致[6,13,15]。本组数据显示高度危险性的GIST中腔外性生长占70.5%(12/17),混合型生长中高度危险占50%(3/6),生长方式和病理危险度之间呈现显著相关(r=0.493),提示肿瘤>5cm且腔外性生长可作为恶性肿瘤的诊断指标之一。
CT影像研究显示病灶的大小与病灶密度及病灶内部之间也相关联呈显著性相关。病灶密度与病灶内部有无坏死囊变呈现完全相关(r=1),同时两个因素与GIST病理分级高度相关(r均为0.777)。因此病灶生长越大越容易发生坏死囊变,其病灶密度越趋向不均匀,术后病理危险性分级也趋向中度及高度。边界与形态分别与肿瘤的危险度呈高度相关,两者之间亦高度相关(r=0.797)。病灶的大小与肿瘤生长方式之间(r=0.434)相关程度较弱,但腔外性生长和(或)以腔外性为主的混合型生长的病例,其危险度为中度和高度的比例较高。
总之,CT影像特征可以反映GIST的病理危险度,各因素之间相互关联,与不同危险度的GIST在病灶的形态、大小、密度、边界等方面有统计学差异一致[14],通过危险度的相关程度分析,我们发现CT特征对GIST危险度判断的价值从大到小依次为肿瘤密度>肿瘤大小>形态>边界>生长方式>发生部位。
2.CT评估GIST良恶性倾向诊断结果与病理侵袭性
恶性倾向GIST的CT影像特征已明确,不同影像CT特征GIST的病理侵袭性存在显著差异,但尚缺乏相关程度的研究,本研究发现CT评估GIST良恶性倾向诊断结果与侵袭性呈正相关且相关系数高达0.771,CT评估为恶性倾向的肿块,术后病理分级为高度的占66.6%及中度的占33.3%。其病理危险度表现为中度及高度的比例显著增大(P<0.0001)。
本研究的不足之处在于本组GIST主要发生在胃及小肠,不能完全反映病灶的发生部位与病理危险度的关系。尽管如此,通过CT检测观察肿瘤大小、形态、密度及肿瘤的边界等指标,对GIST的良恶性预评估较为准确。同时CT扫描三维重建可显示瘤体及其与邻近组织结构的关系,尤其对向胃肠道外生长或向腔内外混合生长的GIST更有意义,可为临床手术方案制定及术后随访提供必要手段。
[1] Nowain A, Bhakta H, Pais S, et al. Gastrointestinal stromal tumors:clinical profile, pathogenesis, treatment strategies and prognosis. J Gastroenterol Hepatol, 2005, 20: 818-824.
[2] CSCO胃肠间质瘤专家委员会. 中国胃肠间质瘤诊断治疗专家共识(2011年版). 临床肿瘤学杂志, 2011, 16: 836-844.
[3] Choi YR, Kim SH, Kim SA, et al. Differentiation of large (≥5cm)gastrointestinal stromal tumors from benign subepithelial tumors in the stomach: Radiologists' performance using CT. Eur J Radiol,2014, 83: 250-260.
[4] Teoh WC, Teo SY, Ong CL. Gastrointestinal stromal tumors presenting as gynecological masses: usefulness of multidetector computed tomography. Ultrasound Obstet Gynecol, 2011, 37: 107-109.
[5] 田宗武,谢爱民. 胃肠道间质瘤的多层螺旋CT诊断. 实用医学影像杂志, 2013, 14: 35-37.
[6] 李玉林,于 昭,程亚宝,等. 胃肠间质瘤CT表现及预测肿瘤恶性程度的分析. 中国医学计算机成像杂志, 2011, 17: 135-139.
[7] Hou YY, Lu SH, Zhou Y, et al. Predictive values of clinical and pathological parameters for malignancy of gastrointestinal stromal tumors. Histol Histopathol, 2009, 24: 737-747.
[8] Yang TH, Hwang JI, Yang MS, et al. Gastrointestinal stromal tumors: computed tomographic features and prediction of malignant risk from computed tomographic imaging. J Chin Med Assoc, 2007,70: 367-373.
[9] Joensuu H, Reichardt P, Eriksson M, et al. Gastrointestinal stromal tumor: a method for optimizing the timing of CT scans in the follow-up of cancer patients. Radiology, 2014, 271: 96-103.
[10] Ulusan S, Koc Z, Kayaselcuk F. Gastrointestinal stromal tumours:CT findings. Br J Radiol, 2008, 81: 618-623.
[11] 孙 烨,綦维维. 多层螺旋CT半定量诊断高危险程度胃肠道间质瘤.中国医学影像技术, 2010, 26: 517-520.
[12] Miettinen M, Lasota J. Gastrointestinal stromal tumors: pathology and prognosis at different sites. Semin Diagn Pathol, 2006, 23: 70-83.
[13] 宋晓丽,方 一,吴正阳,等. MSCT评价胃肠道间质瘤的恶性程度.中国医学影像技术, 2012, 28: 1870-1873.
[14] 李健丁,乔 英,贺敬红. 胃肠道间质瘤的CT诊断及不同危险性征象分析. 当代医学, 2010, 16: 28-31.
[15] Horton KM, Fishman EK. Current role of CT in imaging of the stomach. Radiographics, 2003, 23: 75-87.
