骨髓间充质干细胞应用于急性肺损伤修复的实验研究
2014-01-04徐莹田野赵平
徐 莹 田 野 赵 平
(中国医科大学附属盛京医院麻醉科,1中国医科大学附属盛京医院脊柱关节骨科,沈阳110004)
急性肺损伤、间质性肺疾病,临床表现为呼吸困难,肺弥散功能减低,低氧血症,X线表现为弥漫性阴影。目前临床上缺乏有效的治疗及阻止病程进展的良好方法,因而是一种病死率很高的难治性疾病。在药物治疗的基础上,近年来间充质干细胞的治疗逐渐成为热点。因为肺脏原位干细胞数量较少,且其表型特征和龛位分布很难发现,同时肺脏的结构和功能复杂,所以目前有关肺脏干细胞的研究进展缓慢。但现在已有报道,成体组织来源的间充质干细胞可以归巢至肺脏并长期定植,通过对定植于肺部的成体组织来源的间充质干细胞表达特异性I型肺泡上皮细胞的标志,包括水通道蛋白—5等的检测,也证实了其它干细胞转化为肺组织细胞的可能性。最近的研究提示,在骨髓组织中存在一种多能基质干细胞,具备向成骨细胞、软骨细胞、成肌细胞和神经细胞等分化的能力,其生物学性状稳定,可长期增殖,这种细胞有可能成为干细胞治疗的种子细胞来源。林群等将转染的骨髓间充质干细胞(BMSCs)经颈内静脉注入大鼠体内,经检测后证实其具有较好的肺内靶向性。本研究目的在于,通过对成体骨髓来源的间充质干细胞在损伤肺部的分布和定植情况的研究,以期对急性肺损伤、间质性肺疾病等难治性肺部疾病的治疗提供新思路。
材料和方法
1.实验动物和主要试剂
清洁级wistar大鼠,4-6周龄,体重150-200克,雌雄不限(中国医科大学附属盛京医院实验动物中心提供)。DMEM培养基(Gibco公司);标准胎牛血清(Hyclone公司);胰蛋白酶(Sigma公司);Percoll分 离 液 (Pharmacia 公 司);CD29、CD44、CD34、CD45兔抗大鼠多克隆抗体(武汉博士德公司);FITC标记的羊抗兔二抗(武汉博士德公司);脂多糖(sigma公司);苏木素(西塔化学试剂公司);伊红(西塔化学试剂公司);二甲苯(西塔化学试剂公司);无水酒精(西塔化学试剂公司);中性树胶(西塔化学试剂公司);鼠抗尿嘧啶脱氧核苷单克隆抗体(中杉金桥公司);免疫组化试剂盒(中杉金桥公司)。
2.方法
2.1 BMSCs的体外分离和培养
选用6周龄健康Wister大鼠(约150克),颈椎脱臼法处死,无菌条件下分离股骨胫骨,咬去骨两端,用10ml L-DMEM培养基(无血清),冲出骨髓于离心管中,吹打制成细胞悬液。1000 rpm/min,离心10 min,弃上清,再加入10ml L-DMEM培养基吹打制成细胞悬液,同样方法离心,弃上清。用LDMEM 3m L重悬细胞,将悬液贴壁轻轻加入到预置等体积Percoll分离液(1.073g/m L)的离心管中,2500rpm/min,离心25min。收集云雾状白膜层的单个核细胞,用L-DMEM洗涤两次(1000rpm/min,离心5min),用 L-DMEM 培养基(含 15%FBS、100U/ml青、链霉素)重悬。接种后24时首次换液,以后每3天换液,8-12天达到80-90%融合时消化传代。
2.2 BMSCs的鉴定
将BMSCs培养至2代后,取2代细胞,以2×104传代于24孔板中,加500μl培养基。于37℃、5%CO2培养至细胞70%-80%融合时进行细胞鉴定。取8孔细胞,去除培养液后PBS清洗3遍,滤纸吸干表面液体,加入500μl 4%的多聚甲醛固定10 min。10min后PBS清洗3遍,滤纸吸干表面液体,分别向8孔内滴加CD29、CD44、CD34、CD45兔抗大鼠多克隆抗体(1∶100)300μl,4℃孵育过夜,次日弃去一抗,PBS清洗3遍后向每孔加入300μl山羊抗兔FITC标记的二抗(1∶100),室温孵育2h后弃去二抗,PBS清洗3遍,滤纸吸干表面液体,荧光显微镜下观察并照相。
2.3 急性肺损伤大鼠动物模型建立及分组
20只大鼠随机分为两组:A组 肺损伤组(只注射脂多糖);B组 肺损伤后干细胞修复组(注射脂多糖和干细胞)。脂多糖以注射用水稀释成0.5mg/ml,按照2mg/kg经大鼠尾静脉注入;取培养第2代骨髓干细胞,与溴脱氧尿嘧啶溶液共同培养24h,使溴脱氧尿嘧啶整合于骨髓干细胞内后,以适当生理盐水混合,B组每只大鼠经尾静脉注入0.2ml(含有2.5×106个细胞);另有2只大鼠:1只为正常对照,不注射任何试剂;1只为干细胞对照,只注射干细胞。观察比较大鼠呼吸状态,呼吸频率,活动状态,摄食情况,口鼻分泌物情况。于第5日指标观察后,放血法处死大鼠,取肺组织观察比较。
2.4 肺组织病理切片制备和观察
以10%福尔马林溶液浸泡大鼠肺组织(肺组织均取自左肺上叶,大小约1×1×1cm3)固定48 h,进行脱水处理。脱水时间分别为:75%酒精缸,80%酒精缸,90%酒精缸,95%酒精缸,100%酒精Ⅰ缸,100%酒精Ⅱ缸,时间分别为1h;二甲苯Ⅰ缸,二甲苯Ⅱ缸,两个缸一起为1 h,然后分别经浸蜡Ⅰ缸和浸蜡Ⅱ缸各浸蜡1 h,将标本变为蜡块;将标本蜡块经切片机切成4 mm后的病理标本片,于38℃经展片机展片,于70℃经烤片机烤片4 h;再分别经二甲苯Ⅰ缸4 min,二甲苯Ⅱ缸4 min,二甲苯缸Ⅲ4分钟,100%酒精Ⅰ缸,100%酒精Ⅱ缸,95%酒精缸,75%酒精缸,脱蜡数秒。
2.5 HE染色和免疫组化染色
HE染色:先将脱蜡的切片经苏木素染色5 min,反兰3 min钟,经1%盐水酒精浸泡30 s,伊红染色7 min,自来水冲洗;分别经70%酒精缸3 s,90%酒精缸3 s,100%酒精Ⅰ缸4 min,100%酒精Ⅱ缸4 min,二甲苯Ⅰ缸4 min,二甲苯Ⅱ缸4 min,进行脱色处理;用中性树胶封片。
免疫组织化学染色:蒸馏水冲洗,PBS浸泡5 min钟;3%H2O2去离子水孵育5-10 min,以消除内源性过氧化物酶活性;滴加封闭用正常山羊血清工作液,室温孵育10-15 min,倾去;滴加适当比例稀释的鼠抗尿嘧啶脱氧核苷单克隆抗体,37℃孵育2-3 min或4℃过夜;PBS冲洗,3 min×3次;滴加生物素化二抗工作液,室温或37℃孵育10-15 min;PBS冲洗,3 min×3次;滴加辣根酶标记链霉卵白素工作液,室温或37℃孵育10-15 min;PBS冲洗,3分钟×3次;显色剂显色;自来水充分冲洗;用中性树胶封片。
以Olympus光学显微镜分别于低倍镜(×10)和高倍镜(×40)下,观察比较大鼠肺组织病理切片。
3.统计学处理
结 果
1.大鼠BMSCs培养形态观察结果
原代细胞培养24h后可见到细胞多数呈小圆形,少量贴壁且伸出突起的细胞,呈小的短梭形或三角形。第3d起伸出突起细胞增多,呈集落多细胞性分布,可见分裂相。4、5天开始形成分布均匀的团簇状增生灶,且数量逐渐增多,细胞形态呈较大的长梭形,排列较紧密,培养的第5天即可见散在的细胞群落形成;第9-10天细胞生长即可达80%-90%的融合,呈很大的长梭形,紧密排列可有旋涡状形成。第2代后细胞的形态比较均一(图1)。
3.指标观察统计结果
正常对照和干细胞对照大鼠呼吸状态及活动性良好。A、B两组均有部分大鼠呼吸困难,呼吸频率加快,不活动和不进食,口鼻有粉红色分泌物。但A组数量更多,呼吸频率加快更明显,经统计学分析,两组差异有统计学意义(P<0.05)(表1、2)。A组有4只大鼠于处死前死亡,其中1只为注射后立即死亡,故未列入统计范围内。
4.大鼠肺组织病理观察结果
大体观察:正常对照和干细胞对照大鼠肺脏无异常。A、B两组大鼠肺脏均出现不同程度淤血水肿,但A组程度更重,且有3只大鼠肺脏出现了肉眼可见的实变改变。
HE染色:正常对照和干细胞对照大鼠肺病理切片显示,肺组织无损伤出现,肺泡结构正常(图3)A组大鼠肺脏病理切片显示,肺组织明显水肿充血,部分肺泡腔内渗出、充血、肺泡萎陷不张;肺泡间隔增宽,毛细血管扩张充血,部分肺脏出现实变的情况(图3);B组大鼠肺脏病理切片显示,肺组织也出现了水肿和充血情况,部分肺泡腔内也有渗出、充血、肺泡萎陷,但较A组为轻,且无肺实变情况发生(图3)。

表1 两组大鼠观察指标比较Table 1 Observation index of two groups

表2 两组大鼠呼吸频率比较(次/分)Table 2 Respiratory rates of two groups(beat/min)

图1 原代培养的BMSCs(a)和第2代培养的BMSCs(b)(×10)Fig.1 Primary BMSCs(a)and BMSCs of second generation(b)(×10)

图3 正常对照(a)、干细胞对照(b)、肺损伤组(c-k)和干细胞修复组(l-u)大鼠肺脏病理 HE染色(×10)Fig.3 Lungs pathology of control(a),stem cell control(b),A group(c-k)and B group(l-u)HE staining(×10)
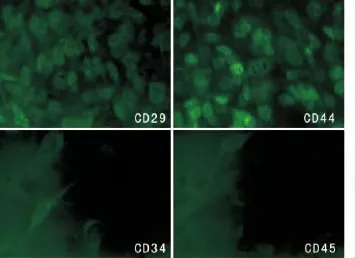
图2 免疫荧光法检测BMSCs表面标志物结果Fig.2 BMSCs surface markers detection by immunofluorescence
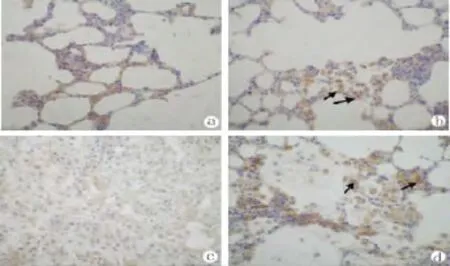
图4 正常对照(a)、干细胞对照(b)、肺损伤组(c)和干细胞修复组(d)肺脏病理 免疫组化(×40)Fig.4 Lungs pathology of control(a),stem cell control(b),A group(c)and B group(d)immunohistochemistry(×40)
2.大鼠BMSCs的鉴定
免疫荧光法检测BMSCs CD29、CD44呈阳性反应,CD34、CD45呈阴性反应(图2)。
免疫组化染色:正常对照和干细胞对照大鼠肺病理切片显示,肺组织无损伤出现,于干细胞对照大鼠肺病理切片可发现呈长圆形或梭形较大细胞,其细胞核内有棕黄色颗粒(图4),表明骨髓干细胞确于肺内定植;A组大鼠肺脏病理切片显示,肺组织内无细胞核内有棕黄色颗粒细胞(图4);B组大鼠肺脏病理切片显示,肺组织内发现呈长圆形或梭形较大细胞,其细胞核内有棕黄色颗粒(图4),表明骨髓干细胞确于肺内定植。
讨 论
BMSCs是多分化潜能的干细胞,在一定诱导条件下,可以形成骨、软骨或脂肪等组织,因此是组织工程的种子细胞[1,2],目前是研究的热点。到目前为止,BMSCs的培养和分离方法有很多种,比较常用的方法是密度梯度离心法[3]、贴壁细胞分离法、流式细胞仪法[4]和免疫磁珠分离法[5]。作为组织工程的种子细胞,细胞的纯度越高越能符合组织工程研究的要求,实验中我们把密度梯度离心法与贴壁培养法相结合,用比重为1.073 g/ml的percoll分离液分离骨髓MSCs,随换液弃除血细胞。具有操作简便、快速、实用等优点,祢补了流式细胞仪和免疫磁珠分离法影响细胞活性,单纯贴壁法所得的BMSCs的纯度不足的缺点,是一种比较理想的分离纯化方法。
近期研究发现,BMSCs还没有一种特异的表面标记,故无法直接鉴定,本实验中我们采用免疫荧光法进行鉴定,CD29、CD44表达阳性,CD34、CD45表达阴性,与文献相符合[6]。说明分离的细胞纯度较高,成份比较单一,不是造血细胞和成纤维细胞,而是BMSCs。
目前大鼠肺损伤动物模型的建立有很多种方法,如经137铯照射300cGy,注射油酸或博来霉素等。本研究采用脂多糖经大鼠尾静脉注入的方法,按照2mg/kg给药,除A组1只大鼠于给药后立即死亡外,其余大鼠均存活数日,处死后其肺组织病理切片均出现肺部水肿充血及部分实变情况,说明脂多糖可以造成大鼠急性肺损伤。
急性肺损伤起病急,发展迅速,病情凶险,治疗困难。治疗急性肺损伤的方法目前临床上有很多种,但各种方法均有其不足之处,且对于急性肺损伤的治疗效果非常有限,因而急性肺损伤是一种病死率很高的难治性疾病。在药物治疗的基础上,近年来间充质干细胞的治疗逐渐成为热点。因为肺脏原位干细胞数量较少,且其表型特征和龛位分布很难发现,同时肺脏的结构和功能复杂,所以目前有关肺脏干细胞的研究进展缓慢[7]。但现在已有报道,成体组织来源的间充质干细胞可以归巢至肺脏并长期定植[8],通过对定植于肺部的成体组织来源的间充质干细胞表达特异性I型肺泡上皮细胞的标志,包括水通道蛋白—5等的检测,也证实了其它干细胞转化为肺组织细胞的可能性[9]。本研究经大鼠尾静脉注入骨髓间充质干细胞后,经肺病理切片免疫组化检查证实干细胞确于肺内归巢定植,且其对急性肺损伤确有修复保护作用。由于干细胞具有自我更新及多向分化能力,且具有取材容易,细胞增殖快速,生物学性状稳定,便于自体移植等特点,近年来在基因治疗肺损伤中倍受重视[10,11]。目前有研究表明,BMSCs对于矽肺大鼠模型肺脏的损伤和纤维化,具有明显的抑制作用[12];通过对高氧所致新生大鼠肺损伤的研究发现,BMSCs可以明显抑制损伤肺脏的炎症反应,从而减轻高氧所致的肺损伤程度[13],但是其具体机制目前还不完全清楚。随着基因治疗肺部疾患研究的不断深入,相信干细胞介导的基因治疗有望成为治疗急性肺损伤的有效方法之一。
本研究存在的缺点和有待于研究的问题:①不同代骨髓间充质干细胞的肺内归巢活性是否相同[14],如何检查;②不同剂量脂多糖对大鼠肺损伤的程度有多大影响;③骨髓间充质干细胞大鼠肺内定植期有多长,其影响因素是什么[15]。④由于本研究样本量较小,因此骨髓间充质干细胞对急性肺损伤大鼠肺脏的修复保护作用,其确切性和具体机制还有待于进一步研究确认。
[1]Longobardi L,O'Rear L,Aakula S,et al.Effect of IGF-I in the chondrogenesis of bone marrow mesenchymal stem cells in the presence or absence of TGF-beta signaling.J Bone Miner Res,2006,21(4):626-636
[2]Indrawattana N,Chen G,Tadokoro M,et al.Growth factor combination for chondrogenic induction from human mesenchymal stem cell.Biochem Biophys Res Commun,2004,320(3):914-919
[3]Lisignoli G,Remiddi G,Cattini L,et al.An elevated number of differentiated osteoblast colonies can be ob-tained from rat bone marrow stromal cells using a gradient isolation procedure.Connect Tissue Res,2001,42(1):49-57
[4]Zohar R,Sodek J.Characterization of stromal progenitor cells enriched by flow cytometry.Blood,1997,90(9):3471-3481
[5]Encina NR,Billotte WG,Hofmann MC.Immunomagnetic isolation of osteoprogenitors from human bone marrow stroma.Lab Invest,1999,79(4):449-457
[6]康新勤,藏伟进,宋土生等.大鼠骨髓间充质干细胞分离培养及其形态观察.西安交通大学学报,2003,24(5):518-519
[7]Ortiz LA,Gambelli F,McBridge C,et al.Mesenchymal stem cell engraftment in lung is enhanced in response to bleomycin exposure and ameliorates its fibrotic effects.Proc Natl Acad Sci U S A,2003,100(14):8407-8411
[8]Borthwick DW,Shahbazian M,Krantz QT,et al.Evidence for stem cell niches in the tracheal epithelium.AmJ Respir Cell Mol Biol,2001,24(6):66-70
[9]Prockop DJ,Gregory CA,Spees JL.One strategy for cell and gene therapy:harnessing the power of adult stem cells to repair tissues.Proc Natl Acad Sci USA,2003,100 Suppl 1:11917-11923
[10]Kotton DN,Ma BY,Cardoso WV,et al.Bone marrow2derived cells as progenitors of lung alveolar epithelium.Development,2001,128(24):518-523
[11]Han ZB,Chen HX,Deng JX.Multipotential differentiation and potential applications of adipose-derived stem cells.Sheng Wu Gong Cheng Xue Bao,2007,23(20:195-200
[12]Zhao MM,Cui JZ,Cui Y,et al.Therapeutic effect of exogenous bone marrowderived mesenchymal stem cell transplantation on silicosis via paracrine mechanisms in rats.Mol Med Rep,2013,8(3):741-746
[13]Tian Z,Li Y,Ji P,Zhao S,et al.Mesenchymal stem cells protects hyperoxia-induced lung injury in newborn rats via inhibiting receptor for advanced glycation endproducts/nuclear factorκB signaling.Exp Biol Med(Maywood),2013,238(2):242-247
[14]Amamoto N,Akamatsu H,Haseqawa S,et al.Isolation of multipotent stem cells from mouse adipose tissue.Dermatol Sci,2007,48(1):43-52
[15]林群,雷丽华,曾帮雄等.骨髓间充质干细胞介导大鼠肺内基因转移的可行性.中华麻醉学杂志,2006,26(3):230-233
