Mfn-2降低促进培养的大鼠血管平滑肌线粒体自噬
2014-01-04郭小梅李宏莲杨晓云
李 丹 郭小梅 李宏莲 杨晓云*
(1华中科技大学同济医学院附属同济医院心血管内科;2华中科技大学同济医学院组织学与胚胎学系,武汉430030)
自噬现象是依赖于溶酶体将体内损伤的蛋白质与细胞器吞噬清除的一种保守的代谢方式。当营养物质短缺时,体内可通过自噬过程消耗自身胞浆中的细胞器来满足能量的需求从而维持机体的稳态。但是,自噬过程的过度激活会导致细胞的死亡,大量的研究已表明自噬体的产生增多与心室重构、心力衰竭和心肌缺血密切相关[1]。在机体产生自噬的过程中,线粒体的融合与分裂发挥着重要的作用,特别是线粒体的分裂,线粒体膜电位的降低在机体通过选择性自噬降解线粒体的过程中尤为关键[2]。Mfn-2是近年来发现的分布于线粒体外膜,与线粒体融合与分裂相关的蛋白质,而且已有研究报道Mfn-2在心肌细胞的自噬溶酶体形成过程中起核心功能,心肌细胞缺乏 Mfn-2时会导致自噬体的堆积,溶酶体的产生减少,最终导致心肌功能的受损[3]。平滑肌细胞的增殖在动脉粥样硬化的产生和形成过程中发挥着重要的作用,但是Mfn-2与平滑肌细胞中的自噬现象目前尚无研究,本研究中,我们将培养的大鼠血管平滑肌细胞(r VSMCs)中分别感染腺病毒载体 Adv-Mfn-2-SiRNA和空载 Adv-Lac-Z作为实验组和对照组,通过 Western Blot分析Mfn-2的表达,JC-1处理后运用流式细胞术检测线粒体膜电位的变化,透射电子显微镜显示线粒体超微结构的改变以及自噬体的形成和积累过程探讨Mfn-2降低对r VSMCs内线粒体自噬的影响。
材料和方法
1.材料
1.1 细胞及腺病毒
Wistar大鼠胸主动脉血管平滑肌细胞(r VSMCs)及 腺 病 毒 Adv-Mfn-2-SiRNA 和 Adv-Laz[由美国国立卫生研究院(NIH)陈光慧教授惠赠]。
1.2 主要试剂
DMEM高糖培养基(美国Gibco公司);胎牛血清(美国Gibco公司);HEPES(美国Sigma公司);碳酸氢钠、氯化钠、氯化钾、磷酸二氢钾、十二水磷酸氢二钠(国药集团化学试剂公司);碘化丙啶、RNA酶、TEMED、EDTA、PVDF膜(美国Sigma公司);胰酶、AP、丙烯酰胺、N,N-二甲基双丙烯酰胺、Tris碱、SDS、HCl、Tris-HCl、甘油、溴酚蓝、甘氨酸(美国Amersco公司);5×上样缓冲液(博士德生物);甲醇(西陇化工股份有限公司);RIPA裂解液、BCA蛋白浓度测定试剂盒(中国碧云天生物技术研究所);Mfn-2抗体(英国 Abcam 公司);Tubulin(美国Sigma公司);HRP标记的羊抗兔或羊抗鼠IgG/Ig M(美国 Cell Signaling Technology公司);ECL显色剂(美国BIPEC BIOREAGENT公司);胶片、显影液、定影液(美国 Kodak公司),多聚甲醛、Triton-X-100、戊二醛、锇酸、乙醇、丙酮、环氧树脂、醋酸双氧铀、枸橼酸铅(西陇化工股份有限公司),JC-1线粒体膜电位检测试剂盒(南京凯基)。
2.方法
2.1 实验分组
Wistar大鼠胸主动脉血管平滑肌细胞,实验选择3至5代处于对数生长期的细胞,采用DMEM高糖培养基(含10%胎牛血清)在37℃、5%CO2的细胞培养箱中培养,生长至50%丰度左右时,采用DMEM无血清培养基同步化48 h后,加入Adv-Mfn-2-SiRNA以感染复数60 pfu/细胞感染血管平滑肌细胞24 h作为实验组,加入Adv-LaZ 60 pfu/细胞继续维持24 h作为对照组。
2.2 免疫印迹分析
收集处理后的细胞,加入RIPA裂解液100 ml/每皿(100 mm),冰上裂解30 min;收集全部裂解液,4℃,12000 rpm离心15 min,收集上清;根据BCA蛋白浓度测定试剂盒配制标准蛋白样品,分别取各组蛋白样品5 ml,加入45 ml蒸馏水,稀释10倍;分别取标准蛋白样品和待测蛋白样品各5 ml/孔和95 m LA-B液(VA∶VB=50∶1)加入96孔板,每个样品平行做3孔,37℃培养箱孵育30 min后,ELX-800酶标仪490 nm读数,记录各组数值,根据标准蛋白样品的OD490绘制标准曲线,再根据待测蛋白样品的OD490值得算待测蛋白样品浓度,待测蛋白样品的原始浓度=待测蛋白样品计算的浓度×稀释倍数(10倍);制备SDS-PAGE凝胶和电泳缓冲液;将样品依次上样至梳齿孔,先用恒流(10 m A/胶)电泳,待指示剂电泳至堆积胶和分离胶的交界处时,改用恒压 (100 V)电泳,直至指示剂完全跑出分离胶;采用PVDF膜,转膜槽中倒入1× 转膜缓冲液,在230 m A下转印约2.5 h;转印结束后,室温下用5%TBS-脱脂牛奶振荡封闭1 h;加入用封闭液稀释的一抗,4℃孵育过夜;用TBS洗膜后采用辣根过氧化物酶/化学发光检测法曝光,显影,定影,胶片晾干后,经扫描仪扫描,Adobe Photoshop软件转换为TIFF格式后,Image J图形软件计算灰度值,进行半定量分析。
2.3 线粒体膜电位的检测
将5 ml JC-1 stock solution加入800 ml双蒸水中,待JC-1充分溶解后加入200 ml 5×染色液;2.0×105/ml的细胞密度将血管平滑肌细胞种植入6孔板内,每孔加入2 ml,24 h后进行细胞周期诱导;胰酶消化后,每孔内的细胞用1 ml培养基重悬,转移入流式管内;加入准备的染色液,混匀;37℃避光水浴20 min;准备JC-1染色缓冲液,将400 ml 5×staining solution用双蒸水稀释至2 ml,冰上预冷;水浴后的细胞室温600 g离心10 min,小心移去上清;用JC-1染色缓冲液200 ml/管重悬得到的细胞,冰浴保存,30 min内上流式仪,在590/529nm检测线粒体膜电位的变化。
2.4 常规透射电子显微镜成像
收集处理后的细胞,先将细胞悬液转入15ml离心管中800转/分5-10 min,再将细胞悬液置入1.5 ml Ep管中1500转/分10 min,完毕后Ep管底的细胞团以一粒芝麻为宜,去除上清,沿管壁缓慢加入2.5%戊二醛缓冲固定液;2.5%戊二醛缓冲固定液固定2 h;0.1 mol/L磷酸缓冲液清洗2×20 min;1% 锇酸后固定30至120 min;0.1 mol/L磷酸缓冲液清洗;按50%乙醇、70%乙醇、90%乙醇、90%乙醇丙酮、90%丙酮、100%丙酮(2次)各5 min梯度脱水;丙酮与环氧树脂1∶1混合半浸透2 h;纯环氧树脂包埋剂浸透2 h;包埋;聚合(80℃恒温箱内)10 h;修块;超薄切片(德国LEICA ULTRACUT UCT超薄切片机);染色:醋酸双氧铀和枸橼酸铅双重染色各10 min;透射电镜(荷兰FEI Tecnai G212型)观察、拍照。
3.统计学分析
相关实验数据均采用平均值±标准误表示,采用SPSS 19.0统计分析软件进行单因素方差分析,组间差异采用双尾T检验,P<0.05认为差异显著,具有统计学意义。
结 果
1.腺病毒 Adv-Mfn-2-SiRNA感染r VSMCs后Mfn-2的表达变化
r VSMCs生长至50%丰度左右时,采用DMEM高糖培养基(不含血清)同步化4 8 h后加入Adv-LacZ作为对照组,免疫印迹半定量分析的结果表明,r VSMCs中 Mfn-2蛋白条带与内参Tubulin的相对灰度值为1.434±0.127(n=3);同步化48 h后腺病毒 Adv-Mfn-2-SiRNA 以感染复数60 pfu/细胞感染r VSMCs 24 h,Mfn-2蛋白条带与内参Tubulin的相对灰度值为0.604±0.071(n=3),Mfn-2的表达明显降低(P<0.05)。

图1 r VSMCs同步化后加入腺病毒 Adv-Mfn-2-SiRNA Mfn-2的表达较加入Adv-LacZ对照组明显降低。Fig.1 The expression of Mfn-2 was inhibited evidently in the r VSMCs infected with Adv-Mfn-2-SiRNA after synchronization,compared with that with Adv-LacZ.
2.JC-1染色法检测腺病毒 Adv-Mfn-2-SiRNA感染r VSMCs后线粒体膜电位显著降低
Adv-Mfn-2-SiRNA 感 染 r VSMCs后,线 粒 体膜电位的值为4.977±1.672(n=6),显著低于对照组线粒体膜电位的值46.79±35.58(n=6,P<0.05)。

图2 Adv-Mfn-2-SiRNA感染r VSMCs后线粒体膜电位显著低于 Adv-Lac-Z感染组。(A)JC-1染色的阳性对照显示CCCP处理后细胞大量死亡,从而与JC-1的单体结合位于右下象限(LR);(B)对照组线粒体膜电位的分布;(C)实验组线粒体膜电位的分布;(D)Adv-Mfn-2-SiRNA感染r VSMCs前后线粒体膜电位变化的统计学差异(n=6,P<0.05)。Fig.2 JC-1 staining showed that the mitochondria membrane potential declined markly after adenoviral infection of Adv-Mfn-2-SiRNA.(A)The positive control of JC-1 staining showed that most of JC-1 monomer distributed in LR after treatment with CCCP.(B)The distribution of staining of J-aggregate and JC-1 monomer in the Adv-Lac-Z infection group.(C)The mitochondria membrane potential were stained by JC-1 in the Adv-Mfn-2-SiRNA infection group.(D)The significant differences of mitochondrial membrane potential between control and Adv-Mfn-2-SiRNA infection group(n=6,P<0.05).
3.腺病毒 Adv-Mfn-2-SiRNA感染r VSMCs后自噬溶酶体的含量变化
r VSMCs同步化48 h后,采用腺病毒Adv-Mfn-2-SiRNA60 pfu/细胞感染24 h后,自噬溶酶体的数量即明显增加。
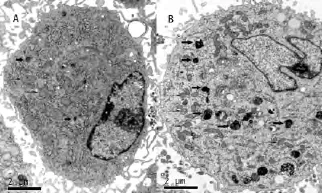
图3 腺病毒Adv-Mfn-2-SiRNA感染r VSMCs后自噬体的数量明显增多。(A)同步化后加入Adv-LacZ,r VSMCs中自噬体的分布与含量;(B)同步化后加入腺病毒Adv-Mfn-2-SiRNA后,r VSMCs中自噬体的数量明显增多(粗箭头示自噬体,细箭头示线粒体)。Fig.3 The autophagosome accumulated after the r VSMCs were infected with Adv-Mfn-2-SiRNA.(A)The distribution of autophagosome in the r VSMCs infected with Adv-LacZ after synchronization.(B)Accumulation of autophagosome were showed after the r VSMCs infected with Adv-Mfn-2-SiRNA after synchronization (Coarse show the autophagosome,fine show mitochondria).
讨 论
线粒体的自噬是细胞通过自噬机制选择性清除线粒体的过程,线粒体在通过电子传递链生成ATP为机体供能的同时也会产生大量活性氧,导致线粒体过氧化损伤,线粒体在及时清除损伤的线粒体维持细胞稳态方面发挥着重要的作用。线粒体自噬的异常与多种疾病密切相关,如神经退行性疾病、血液病、心血管疾病以及癌症。因此,研究线粒体自噬的分子机制对于揭示这些疾病的发病机制,开发新的治疗药物具有重要的意义。
研究发现,线粒体融合与分裂相关的蛋白质也参与线粒体的自噬过程,线粒体分裂后通常会产生两个不均匀的子代,其中部分线粒体能恢复膜电位,并与其他线粒体发生融合形成线粒体网络,有些膜电位下降的线粒体就会选择性被自噬清除。线粒体融合蛋白OPA1的高表达能抑制线粒体自噬的发生[4],线粒体分裂蛋白Fis1的高表达以及它的一个突变体都能促进线粒体自噬的发生[5]。
此研究通过腺病毒感染大鼠血管平滑肌细胞的方法,采用腺病毒 Adv-Mfn-2-SiRNA感染r VSMCs后发现,我们构建的腺病毒 Adv-Mfn-2-SiRNA可显著降低Mfn-2的表达,同时线粒体的膜电位下降,自噬体的产生明显增多。我们的结果提示大鼠血管平滑肌细胞中Mfn-2表达的降低与自噬体的产生增加有关。曾有报道显示,细胞在饥饿状态下,线粒体可通过外膜的转运来促进自噬体的形成[6]。Mfn-2主要分布于线粒体外膜,外膜参与自噬体的形成后,Mfn-2的表达降低,这与我们的结果也相吻合。
而且,近年来的研究也开始关注分布于线粒体外膜的线粒体融合蛋白与线粒体的自噬过程的密切关系。除前述心肌细胞缺乏Mfn-2时会导致自噬体的堆积,溶酶体的产生减少,最终导致心肌功能的受损外[7],最新的研究也表明神经系统疾病中线粒体融合蛋白与线粒体的自噬过程有关。正常情况下,线粒体的损伤导致线粒体融合蛋白的泛素化,从而促进PINK1基因以及下游的Parkin基因启动自噬系统来清除损伤的线粒体,当PINK1基因或下游的Parkin基因突变后,可引发损伤线粒体的病理性堆积,这说明线粒体融合蛋白的降解有利于机体的自噬清除过程。研究表明在小鼠心肌细胞中Mfn-2也可介导PINK1/parkin依赖的线粒体自噬清除过程,parkin与 Mfn-2结合后,PINK1磷酸化 Mfn-2,从而促进parkin介导的Mfn-2泛素化,因此该研究提出Mfn-2是心脏线粒体外膜上parkin的受体,从而介导PINK1/parkin依赖的线粒体自噬清除过程[8]。
总之,我们的实验发现大鼠血管平滑肌细胞中Mfn-2含量的降低会导致自噬体的增加,但是,其中到底是以自噬体为主还是以溶酶体为主,Mfn-2到底是以何种机制来介导平滑肌细胞内的自噬体的形成和产生,以及大鼠血管平滑肌细胞中的这种自噬现象到底是促进动脉粥样硬化的进展还是缓解尚需要进一步的研究。
[1]Cao DJ,Gillette TG,Hill JA.Cardiomyocyte autophagy:remodeling,repairing,and reconstructing the heart.Curr Hypertens Rep,2009,11(6):406-411
[2]Lglewski M,Hill JA,Lavandero S,et al.Mitochondrial fission and autophagy in the normal and diseased heart.Curr Hypertens Rep,2010,12(6):418-425
[3]Zhao T,Huang XH,Han L,et al.Central role of mitofusin2 in autophagosome-lysosome fusion in cardiomyocytes.J Biol Chem,2012,287(28):23615-23625
[4]Twig G,Elorza A,Monila AJ,et al.Fission and selective fusion govern mitochondrial segregation and elimination by autophagy.EMBO J,2008,27(2):433-446
[5]Gomes LC,Scorrano L.High levels of Fis1,a profission mitochondrial protein,trigger autophagy.Biochim Biophys Acta,2008,1777(7/8):860-866
[6]Hailey DW,Kim PK,Satpute-Krishnan P,et al.Mito-chondria supply membranes for autophagosome biogenesis during starvation.Cell,2010,141(4):656-667
[7]Gegg ME,Cooper JM,Chau KY,et al.Mitofusin 1 and mitofusin 2 are ubiquitinated in a PINK1/parkin dependent manner upon induction of mitophagy.Hum Mol Genet,2010,19(24):4861-4870
[8]Chen Y,Dorn GW 2nd.PINK1-phosphorylated mitofusin 2 is a parkin receptor for culling damaged mitochondria.Science,2013,340(6131):471-475
