二羟基萘二磺酸根构筑的一维链状镉配位聚合物的合成与晶体结构
2014-01-02陈延民解庆范
陈延民 解庆范
(泉州师范学院化学与生命科学学院,泉州 362000)
0 引 言
配位聚合物具有新颖的拓扑结构和多变的电子构型而呈现出许多独特的性质,因此在非线性光学材料、发光材料、磁性材料、催化、气体存储和手性拆分等领域具有潜在的应用前景[1-4]。以金属离子或金属簇为“节点”,以多功能有机配体为“构件”,通过共价键自组装构建金属-有机骨架配位聚合物是晶体工程的重要策略。在组装过程中有机配体的选择起着关键的作用,它直接影响着配位聚合物的立体几何结构和物理性能。有机配体之间的氢键和芳环堆积作用不仅可能扩展配合物的维度,而且可以增强配合物的稳定性。曾经长期被冷落的“乏味”的“弱”配位能力的芳磺酸类配体近年来备受关注[5-10],原因是磺酸基的配位能力可调,在配合物中引入氮杂配体或在芳环上引入其他配位基团均可增加磺酸基的配位能力;磺酸基具灵活多变的配位方式,而且具有很强的形成氢键的能力。咪唑作为许多活性酶的中心功能基,参考了不少生物化学反应,对生命活动起着重要的作用。作为含氮配体咪唑不仅具有很强的配位能力,而且是氢键的供体,因而被广泛用于过渡金属配位聚合物的合成[11-14]。
芳二磺酸及其衍生物是表面活性剂、染料和药物的重要中间体,近几年来被用于配位聚合物的设计和合成,取得了很大的研究进展[11,15-23]。我们曾以邻菲啰啉为辅助配体合成了1-氨基-8-萘酚-3,6-二磺酸锌配位聚合物{[Zn(H2O)2(L)(phen)]·3H2O}n[5]和3,6-二羟基-2,7-萘二磺酸钠超分子 Na3[Na5(dhns)2]·(phen)4·2H2O[24]。作为我们工作的延续,本文合成了一种以咪唑为辅助配体的3,6-二羟基-2,7-萘二磺酸镉配位聚合物{[Cd2(dhns)(imdz)4]·H2O}n,在此报道它的合成、晶体结构、波谱特征和热稳定性。
1 实验部分
1.1 仪器与试剂
美国Nicolet avatar 360型FT-IR红外光谱仪;德国Elmentar Vario EL元素分析仪;德国Bruker Smart ApexⅡCCD单晶衍射仪;美国Varian CARY/Eclip se型荧光分光光度计;上海美谱达UV-1800PC(DS)紫外可见分光光度计;德国塞驰STA 409 PC 型综合热分析仪。3,6-二羟基-2,6-萘二磺酸二钠盐(上海阿达玛斯试剂,98%),其他均为市售分析纯试剂。
1.2 配合物{[Cd2(dhnds)(imdz)4]·H2O}n(1)的合成
称取 0.182 5 g(0.5 mmol)3,6-二羟基-2,7-萘二磺酸二钠盐和0.154 3 g(0.5 mmol)Cd(NO3)2·4H2O溶解于 10 mL 甲醇/水(1∶1,V/V)的混合溶剂,在加热搅拌下滴入10mL含1.5 mmol咪唑的甲醇/水 (1∶1,V/V)溶液,用氢氧化钠水溶液调节pH值至6.5左右,搅拌2 h后,将反应容器密封置于70℃水浴锅中放置一夜后冷却过滤,滤液静置,2周后析出褐色单晶。元素分析结果(实验值,%):C 31.71,H 2.69,N 13.42;C22H22Cd2N8O9S2(理论计算值,%):C 31.78,H 2.66,N 13.48。 主要红外光谱数据(cm-1),配体 imdz:3 416,3 124,1 632w,1 541w,1 447w,1 063vs,840m,754m;配体 Na2H2dhns:3 222,1 630vs,1 432vs,1 377 m,1204vs,1083vs,697s,533s;配合物:3421,3133,1 611s,1 535w,1 464w,1 418s,1 354m,1 330w,1 245 s,1157s,1067vs,824m,745m,696m,524s。
1.3 晶体结构测试
选取 0.20 mm×0.22 mm×0.26 mm单晶置于Bruker Smart Apex CCD单晶衍射仪上,用经石墨单色器单色化的Mo Kα射线(λ=0.071 073 nm)在1.2°<θ<26.0°范围内以φ-ω扫描方式于291(2)K下收集到8 696个衍射点,其中独立衍射点3 234个(Rint=0.022),I>2σ(I)的可观察点 2 847 个。全部强度数据均经Lp因子校正,并进行了经验吸收校正,晶体结构由直接法解出,对全部非氢原子坐标及其各向异性热参数进行全矩阵最小二乘法修正。有机氢原子采用理论加氢法得到。所有解析和精修均采用SHELXL-2013[25]程序完成。配合物晶体属单斜晶系,空间群C2/m,晶胞参数a=1.245 97(6)nm,b=1.558 33(9)nm,c=1.629 99(10)nm,β=90.258(6)°,V=3.164 8(3)nm3,Z=4,Mr=831.39,Dc=1.745 g·cm-3,μ=1.534 mm-1,F(000)=1 640,R=0.056 4,wR2=0.140 5,S=1.09。 最后残峰为 Δρmin=-740 e·nm-3和 Δρmax=880 e·nm-3。配合物的主要键长和键角列于表1。

表1 配合物的主要键长和键角Table 1 Selected bond lengths(nm)and angles(°)of the complex
CCDC:939692。
2 结果与讨论
2.1 晶体结构描述
X射线单晶衍射分析表明配合物1为一维链结构,Cd(Ⅱ)的配位环境见图1。配合物的基本结构单元由2个晶体学独立的Cd(Ⅱ)离子、1个羟基完全脱除质子的μ4-dhns4-阴离子和4个咪唑分子以及1个无序的晶格水组成。每个Cd(Ⅱ)离子处于畸变八面体配位环境CdN2O4,2个N原子来自2个咪唑分子,4个O原子分别来自2个μ4-dhns4-阴离子的羟基氧和磺酸基氧,Cd-N键长0.224 5(3)~0.225 5(3)nm,Cd-O 键长 0.228 6(3)~0.238 1(3)nm。羟基氧采用单齿桥联方式μ-O与金属配位,而磺酸基以双齿桥联方式μ2-SO3-与金属配位,O1及其对称原子O1a以及O6及其对称原子O6b两组羟基氧分别被两对八面体共用(共边),形成晶体学独立的2个双核金属簇,Cd1-Cd1d和Cd2-Cd2c间距分别为0.339 0和0.342 6 nm。在Cd(1)的配位环境中磺酸基氧O5和O5b处于轴向,N3、N3b和羟基氧 O6、O6b位于赤道;在Cd(2)的配位环境中磺酸基氧O2和O2a处于轴向,N1、N1a 和羟基氧 O1、O1a位于赤道。μ4-dhns4-阴离子以四重桥联的方式联接着共边的2个八面体而形成一种Cd(1)与Cd(2)交替排列的一维配位聚合物(图2)。配位聚合物呈现Cs对称,dhns4-的碳原子(C1~C10)、硫原子(S1、S2)、羟基氧原子(O1、O6)与磺基未配位的氧原子(O3、O4)完全共平面。
链与链之间存在两类N-H…O氢键,一类是Cd2所在双核单元之间咪唑的-NH基(N2-H2)与磺基未配位的氧原子(O3)之间的氢键(图3a),氢键键长0.292 1(3)nm,键角140°;另一类是Cd1所在双核单元之间咪唑的-NH基(N4-H4A)与磺基配位的氧原子(O5或O5d)之间的氢键(图3b),氢键键长0.295 5(4)nm,键角117°。氢键将配位聚合物扩展为三维超分子网络。此外,另一磺基未配位的氧原子(O4)与晶格水O2W之间、晶格水O2W与羟基氧(O1)之间、晶格水O2W与O1W之间也存在较强的氢键(表 2)。

图1 配合物1中Cd(Ⅱ)的配位环境Fig.1 Coordination environment of the Cd(Ⅱ)in the complex 1

表2 配合物1的主要氢键键长和键角Table 2 Hydrogen bond lengths and angles for title complex

图2 配合物1的一维链结构Fig.2 1D chain structure of the complex 1

图3 配合物1中两类N-H…O氢键Fig.3 Two types of hydrogen bond N-H…O
2.2 红外光谱特征
Na2H2dhns的 IR(图 4)中 1 630 和 1 432 cm-1处一组吸收峰归属萘环的骨架伸缩振动,在形成配合物后红移至1 611和1 418 cm-1,尽管咪唑的C=N伸缩振动在1 632 cm-1附近也会出现吸收,但强度较弱而被掩盖;然而归属于咪唑环内C-N伸缩振动总是极强的吸收峰,与配位前(1 063 cm-1)相比配位后(1 067 cm-1)没有明显变化;同时配合物的IR谱图在824和745 cm-1处出现了归属于咪唑环的CH面外弯曲振动产生的吸收峰,与游离的咪唑(840和754 cm-1)相比发生了红移;而3 133 cm-1弱但明显的尖锐吸收峰属N-H的伸缩振动。Na2H2dhns的IR中1 204和1 083 cm-1强吸收分别归属于νasSO3和νsSO3,配位后发生蓝移至1 245和1 157 cm-1。配合物中1 354 cm-1则由νAr-O产生,与配体(1 377 cm-1)相比红移了23 cm-1,说明羟基参与配位,3 421 cm-1吸收峰则由结晶水的伸缩振动产生的。

图4 配体及其配合物的主要IR图Fig.4 IR spectrum of ligands and title complex
2.3 电子吸收光谱特征
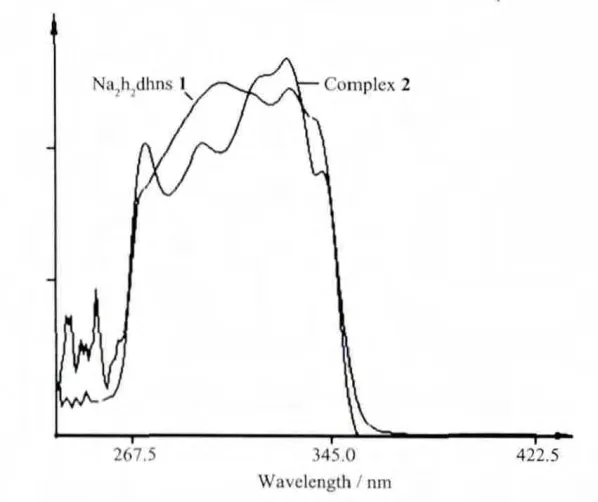
图5 配体及其配合物的电子吸收光谱Fig.5 Electronic absorption spectra of ligdnd and title complex in DMF
以DMF为溶剂,在190~500 nm范围,利用UV-1800PC(DS)型紫外分光光度计对配体及其配合物进行扫描,结果见图5。咪唑在此范围基本无吸收现象,而Na2H2dhns在260~350 nm之间有一很宽强吸收带,其中有3个明显的最大吸收峰 (304、328和338 nm),归属于配体的 π-π* 和 n-π* 跃迁,宽吸收带产生的原因可能是各种跃迁行为叠加的结果。形成配合物后吸收峰分裂更加清晰并发生不同程度的蓝移或红移(295、327和342 nm),同时在273 nm处出现一个新的吸收峰,该吸收峰可归属于咪唑配体与金属之间的荷移跃迁LMCT。
2.4 荧光光谱
配体及配合物1的荧光光谱在10-5mol·L-1DMF溶液中测定,采用全光谱扫描,找到最大激发波长分别为327和310 nm,然后固定激发波长,测试配体和配合物的发射光谱(见图6)。由图可知,配体3,6-二羟基-2,7-二磺酸二钠盐在371 nm处有一强度很大的发射峰,而配合物1则在405 nm处出现了一个带宽很宽,且强度只有配体强度1/4的发射峰,说明Cd2+对配体的荧光产生淬灭作用。
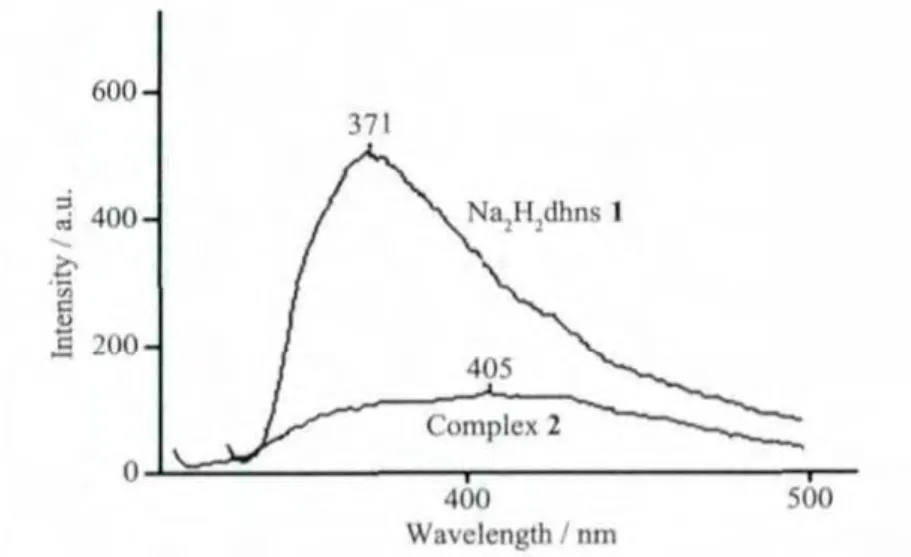
图6 配体及其配合物DMF溶液的荧光光谱Fig.6 Fluorescent spectrum of the ligand and title complex in DMF
2.5 热重分析
在N2气氛保护下以10℃·min-1的升温速度在室温至800℃范围测试了配合物的热稳定性。约66℃开始失重,至98℃失重2.6%,相当于失去1个结晶水(理论计算失重2.17%)。之后在很宽的温度范围基本保持恒重,376℃开始分解并快速失重,800℃之后趋于恒重,残重42%。
[1]GAO Zhu-Qing(高竹青),LI Hong-Jin(李红晋),GU Jin-Zhong(顾金忠).Chinese J.Inorg.Chem.(无机化学学报),2012,28(12):2655-2659
[2]HU Zong-Zhi(胡 宗 智),ZHAO Jun(赵 君),KE Xi-Jun(柯 希俊),et al.Chinese J.Inorg.Chem.(无机化学学报),2011,27(1):184-188
[3]Carlucci L,Ciani G,Proserpio D M.Coord.Chem.Rev.,2003,246:247-289
[4]Hoeben F J M,Jonkheijm P,Meijer E W,et al.Chem.Rev.,2005,105:1491-1502
[5]CHU Zhao-Hua(储召华),XIE Qing-Fan(解庆范),CHEN Yan-Min(陈延民).Chinese J.Inorg.Chem.(无机化学学报),2013,29:1385-1390
[6]Chen Y M,Xie Q F.J.Rare Earths,2012,30(10):1024-1027
[7]FANG Xiang-Qian(方向倩),CHEN Peng-Gang(陈鹏刚),ZHU Zhi-Biao(朱志彪),et al.Chinese J.Inorg.Chem.(无机化学学报),2011,27:1733-1737
[8]XIE Qing-Fan(解庆范),CHEN Yan-Min(陈延民),HUANG Miao-Ling(黄妙龄).Chinese J.Inorg.Chem.(无机化学学报),2010,26:263-268
[9]XIE Qing-Fan(解庆范),HUANG Miao-Ling(黄妙龄),CHEN Yan-Min(陈延民).Chinese J.Inorg.Chem.(无机化学学报),2009,25:249-255
[10]Deng Z P,Zhu Z B,Gao S,et al.J.Chem.Soc.,Dalton Trans.,2009,38:1290-1292
[11]QIAN Bao-Hua(钱保华),MA Wei-Xing(马卫兴),LU Lu-De(陆路德),et al.Chinese J.Inorg.Chem.(无机化学学报),2010,26:1289-1293
[12]Deng Y,Liu H,Yu B,te al.Molecules,2010,15:3478-3506
[13]ZHANG You-Min(张有明),ZHANG Qin-Shen(张勤生),LIN Qi(林奇),et al.Chem.J.Chinese Universities(高等学校化学学报),2011,32(9):2181-2186
[14]WU Qiong-Jie(吴琼洁),CHEN Xiao-Hua(陈小华),CAI Bi-Qiong(蔡碧琼),et al.Chinese J.Inorg.Chem.(无机化学学报),2012,28(12):2650-2654
[15]Cai J,Chen C H,Liao C Z,et al.J.Chem.Soc.,Dalton Trans.,2001,30:1137-1142
[16]Cai J,Chen C H,Feng X L,et al.J.Chem.Soc.,Dalton Trans.,2001,30:2370-2375
[17]Cai J,Zhou J S,Lin M L.J.Mater.Chem.,2003,13:1806-1811
[18]QIAN Bao-Hua(钱保华),MA Wei-Xing(马卫兴),LU Lu-De(陆路德),et al.Acta Phys.-Chim.Sin.(物理化学学报),2010,26(3):610-616
[19]Xiong R G,Zhang J,Chen Z F,et al.J.Chem.Soc.,Dalton Trans.,2001,30:780-782
[20]FANG Sao-Ming(方少明),MA Song-Tao(马松涛),GUO Liang-Qi(郭良起),et al.J.Chinese Rare Earth Society(中国稀土学报),2010,28:154-158
[21]Deacon G B,Harika R,Junk P C,et al.New J.Chem.,2007,31(5):634-645
[22]Song J H,Li X,Zou Y Q.J.Coord.Chem.,2010,63(2):223-233
[23]Deacon G B,Gitlits A,Zelesny G,et al.Z.Anorg.Allg.Chem.,1999,625:764-772
[24]WEI Zan-Bin(魏赞斌),XIE Qing-Fan(解庆范),CHEN Yan-Min(陈延民).Chinese J.Inorg.Chem.(无机化学学报),2013,29:1414-1418
[25]Sheldrick G M.SHELXL-2013,Program for X-ray Crystal Structure Solution and Refinement,University of Göttingen,Germany,2013.
