诱导HAP结晶回收污水中磷主要影响因素分析
2013-12-29邹海明吕锡武
邹海明 吕锡武 李 婷
(1东南大学能源与环境学院,南京210096)(2安徽科技学院城建与环境学院,凤阳233100)
基于利比希(Liebig)最小因子定律,磷是导致水体富营养化藻类(C106H263O110N16P)生长的一个重要因子,因此许多国家对其排放浓度都有着严格的限制.我国国家环境保护部要求城镇污水处理厂出水排入重点流域及湖泊、水库等封闭、半封闭水域时(如太湖、巢湖和滇池),必须执行《城镇污水处理厂污染物排放标准》(GB18918—2002)的一级A标准.随着磷排放标准的提高,在新建污水处理厂或旧工艺升级改造过程中,高效率低能耗的生物除磷技术的应用尤为重要.此外,自然界中磷主要以磷酸盐和鸟粪层岩石等形式存在[1],在生物圈中单项流动且难以再生属于不可再生的稀缺资源[2].我国磷矿资源属于濒危矿产,被列为2010年后不能满足国民经济发展需要的主要矿产之一[3].然而,生活污水中含有“较丰富”的磷(我国生活污水中的磷含量约为5~10 mg/L[4]),回收再利用潜力巨大.目前,国内外众多学者已将研究视点从单纯地去除污水中的磷转向去除和回收磷相结合[5-7],如欧盟等国50%工业用磷来自于污水中的回收,瑞典政府要求污水中的磷75%要回收再利用,而我国结合生活污水处理工艺进行磷回收的研究尚属于起步阶段.
相比于化学沉淀法,诱导结晶技术是目前被认为最经济有效的磷回收技术[8].为此,本课题组设计研发一套新的工艺,在前期反硝化同步脱氮除磷工艺基础上[9]增加诱导结晶回收柱实现磷的回收,即将厌氧释磷后的上清液通过侧流经过诱导结晶柱回收部分磷,将生物强化除磷技术和诱导结晶技术充分耦合.目前主要的结晶反应器有DHV[10],CSIR[11]和Kurita[12]等,其中流化床态的反应器因其操作简单、磷回收率高而备受关注.诱导结晶回收污水中的磷主要采用磷酸铵镁(MAP)结晶法和羟基磷酸钙(HAP)结晶法,MAP适用于含氮、磷浓度较高的废水[13-14],而HAP则适用于中低浓度含磷废水[15],且特别适合于生化强化除磷工艺厌氧池出水中磷(浓度为20 mg/L左右)的回收.当前关于污水处理与磷回收相耦合的工艺已有相关报道,如Phostrip工艺[16-17],但该方法是通过化学沉淀的方法实现磷的回收,产品品质差、含水率高且不能直接应用于实际生产,而诱导结晶法回收的磷酸盐产品纯度高、含水率低且可直接应用于工农业生产中.
此外,要使污水处理与磷回收耦合工艺能实现较好的磷回收效果,首先需分析磷回收的影响因素以及最佳的工艺参数.为此,本文采用自行设计以曝气为动力的流态化诱导HAP结晶磷回收柱,系统分析影响HAP结晶效果的主要因素(包括反应时间、反应温度、晶种投加量、pH值、Ca/P摩尔比和曝气量),以期将该诱导结晶柱与前期研究的反硝化同步脱氮除磷工艺有机地耦合来实现污水中磷的去除和部分磷的回收,同时为中试装置设计和该技术推广应用提供参考.
1 材料与方法
1.1 工艺流程
在前期反硝化同步脱氮除磷工艺基础上增加一个磷回收柱(见图1(a)),将生物除磷和磷结晶回收有机地统一.本试验采用的流态化结晶反应柱(见图1(b))由反应区、缓冲区、沉淀区和曝气区组成,总容积2.5 L.① 反应区.溶液中的构晶离子Ca2+,OH-和PO43-以Ca5(PO4)3OH形式结晶在晶种(方解石,粒径约0.2 mm)上,有效容积1.4 L.② 缓冲区.口径增大使溶液流速降低,有助于晶种沉淀.③ 沉淀区.晶种沉淀后途径缓冲区,再次返回反应区,进一步诱导结晶除磷,上清液进入下一个处理单元.④ 曝气区.使晶种呈流态化,与HAP结晶物充分接触.

图1 反硝化除磷-诱导结晶磷回收工艺
1.2 试验设计
试验中分别设计如下参数,以考察对诱导HAP结晶效果的影响:① 反应时间为10~100 min.② 反应温度为15,25,35 ℃.③ 晶种投加量为20,40,60,80,120,140 g/L.④ pH值为3~13,7~10.⑤ Ca/P摩尔比为1.5,2.0,2.5,3.0,3.5,4.0.⑥ 曝气量为90~780 L/h.
1.3 测定方法
采用流动分析仪(AutoAnalyzer3, SEAL, 英国)测定PO43--P;采用复合测定仪(YSI pH 100, 美国)测定pH值;采用自动恒温控制加热棒(佳宝3018)来控制温度.
2 结果与分析
2.1 反应时间和温度对HAP结晶效果的影响
在进水磷浓度为20 mg/L、pH值为8.5、晶种投加量为60 g/L、Ca/P摩尔比为2.5、曝气量为300 L/h的条件下,考察不同反应时间(10,20,30,40,50,60,70,80,90,100 min)和不同温度(15,25,35 ℃)对HAP结晶回收磷的影响,结果见图2和图3.
由反应时间和反应温度对HAP结晶回收率的综合影响曲面图(见图2)发现,反应时间对磷回收率影响较大,曲线呈弧形状,而温度曲面几乎是平面,影响较小.通过误差棒分析(见图3(a)和(b))也可得出相类似的结果,不同温度平均值误差明显小于不同时间平均值误差,这表明该诱导结晶反应受温度影响较小.

图2 反应时间和反应温度对HAP结晶的综合影响
此外,通过lnC-t关系曲线(见图3 (c))发现,不同温度下随时间变化的各点呈较好的线性关系,相关系数R2分别为0.991 0(15℃),0.994 6(25 ℃),0.985 0(35 ℃),表明此诱导HAP结晶回收磷反应属于准一级反应[18],其浓度C随时间t变化符合如下关系:

图3 出水磷浓度随反应时间和温度的变化

(1)
由式(1)变形得
lnC=-kt+lnC0
(2)
式中,C0为溶液初始磷浓度.因此可根据不同温度下lnC-t拟合的关系曲线求出反应速率常数k,结果见表1.

表1 不同温度反应速率常数
根据阿仑尼乌斯(Arrhenius)公式[19](反应速率常数和温度的关系)

(3)
式中,E为反应活化能,当E<42 kJ/mol, 表明化学反应速度很快,E>420 kJ/mol, 表明化学反应速度缓慢;R为气体常数(8.314);T为热力学温度;A为常数.
通过lnk与1/T的线性回归方程可求出活化能E,以此来判断化学反应受温度的影响程度.

2.2 晶种投加量对HAP结晶效果的影响
在进水磷浓度为20 mg/L、pH值为8.5、Ca/P摩尔比为2.5、曝气量为300 L/h、反应时间为100 min、室温条件下,考察不同晶种投加量(20,40,60,80,120,140 g/L)对HAP结晶回收磷的影响,结果见表2.
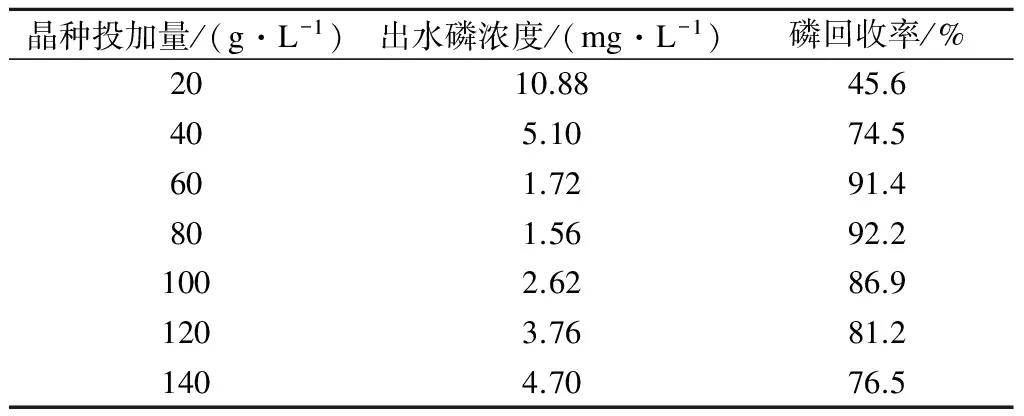
表2 晶种投加量对HAP结晶效果的影响

2.3 pH值对HAP结晶效果的影响
在进水磷浓度为20 mg/L、Ca/P摩尔比为2.5、反应时间100 min、曝气量为300 L/h、晶种投加量为60 g/L、室温条件下,考察不同pH值(3~13)对HAP结晶回收磷的影响,结果见图4.

图4 pH值对HAP结晶效果的影响
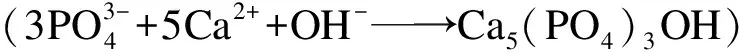
(4)
也促使了HAP结晶反应向右进行.然而,继续增加pH值至13时,磷回收率缓慢下降至86.5%,这可能是由于溶液中OH-离子浓度的增加提高了溶液中CO3-浓度,即
(5)

为进一步研究最佳的pH值范围,选取pH值7~10研究其对HAP结晶效果的影响(见图4).当pH值从8.5增加至10时,磷回收率变化趋势为:由89.7%(pH=8.5)增加到92.9%(pH=9)又降低至91.9%(pH=10),变化幅度较小.这表明利用诱导HAP结晶法回收污水中的磷,溶液pH值存在一个临界值,当达到此临界值时会显著增加HAP的结晶效果.这可能是当溶液中Ca2+和PO43-离子浓度一定时,pH值达到某个临界值,Ca2+,OH-和PO43-离子浓度积超过HAP溶度积(Ksp=55.9, 25℃),则诱导HAP结晶效果明显增强.
2.4 Ca/P摩尔比对HAP结晶效果的影响
在进水磷浓度为20 mg/L、pH值为9、反应时间100 min、晶种投加量为60 g/L、曝气量为300 L/h、室温条件下,考察不同Ca/P摩尔比(1.5,2.0,2.5,3.0,3.5,4.0)对HAP结晶回收磷的影响,结果见表3.

表3 Ca/P摩尔比对HAP结晶效果的影响
HAP结晶的前提是溶液中构晶离子的浓度积要大于溶度积,只要提高其中一种离子浓度就可以导致过饱和现象的发生,促使HAP结晶于晶种上.由表3可知,在进水磷浓度一定的情况下,增大Ca/P摩尔比有助于提高溶液中磷的回收率.当Ca/P摩尔比从1.5增加3.0时磷回收率由68.5%上升到94.2%,这是由于Ca2+浓度的增加使得溶液中结晶体系的过饱和度加大、结晶反应驱动力增强,促进了HAP结晶的形成.当Ca/P摩尔比为1.5时,磷回收率较低,这主要因为这个比例并不能满足HAP组成的比例(1.67)要求,没有足够数量的Ca2+与溶液中PO43-结合.当Ca/P摩尔比大于2.5时,磷回收率均大于92%,且变化幅度不大.
2.5 曝气量对HAP结晶效果的影响
在进水磷浓度为20 mg/L、pH值为9、反应时间100 min、Ca/P摩尔比2.5、晶种投加量为60 g/L、室温条件下,考察不同曝气量(90,120,…,780 L/h)对HAP结晶回收磷的影响,结果见图5.
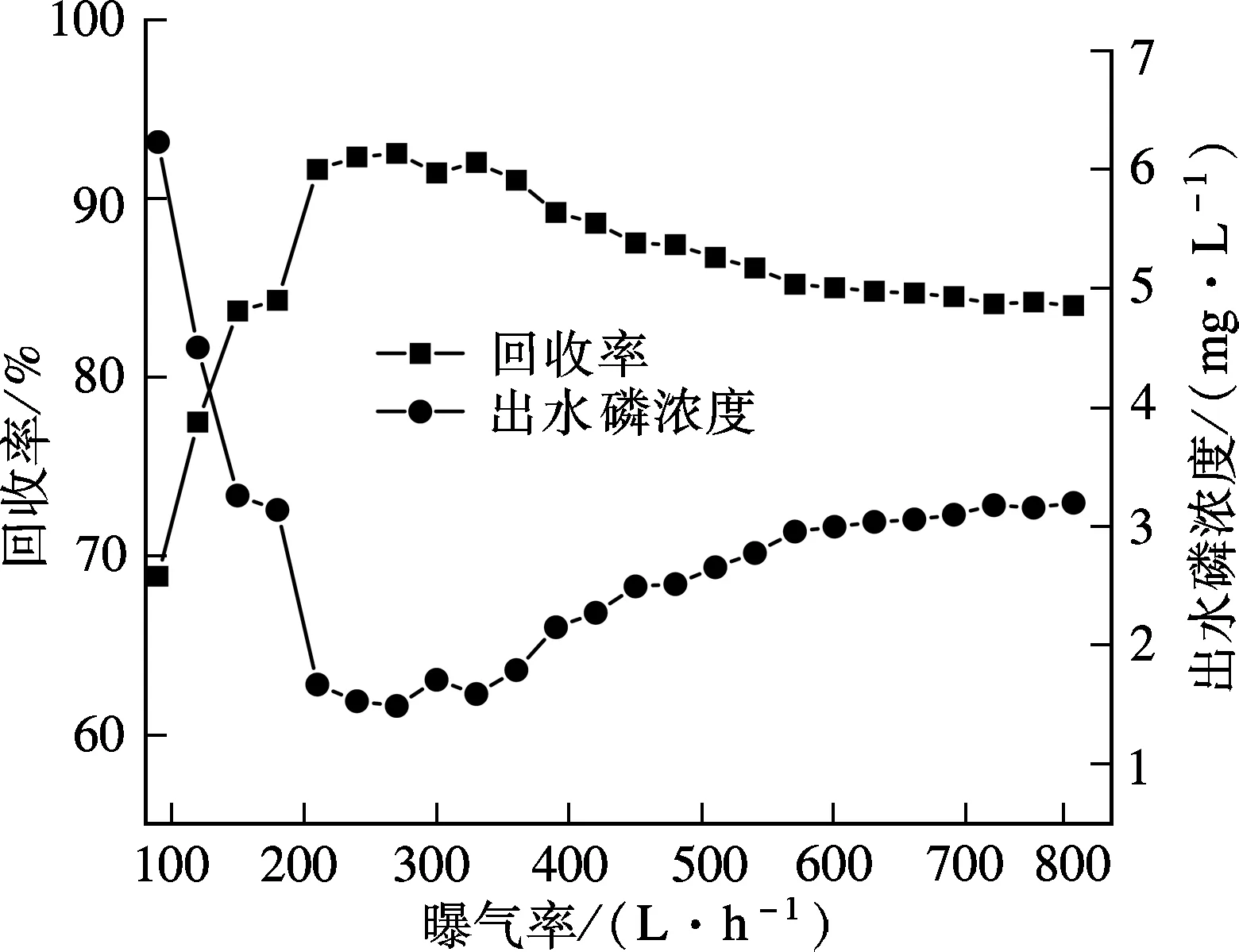
图5 曝气量对HAP结晶效果的影响
诱导结晶柱底部曝气是柱内晶种和构晶离子呈流态化的主要动力,同时通过曝气吹脱溶液中的CO2,可提高溶液的pH值,有助于HAP的结晶反应.曝气量的大小决定了晶种及HAP晶体流态、运行形式和摩擦强度,进而影响晶核形成和生长,此外曝气产生的液体剪切力也影响着晶体在晶种上的附着.由图5可知,当曝气量从90 L/h上升到780 L/h时,诱导结晶除磷量先快速上升后缓慢下降,磷回收率从68.9%增加到最大值92.5%,后又降至84.0%.当曝气量过小时,晶种流态化程度差,构晶离子不能充分地接触,试验中发现此时晶种不能充满整个反应区,表明动力不足,严重影响了HAP的结晶效果.而曝气量过大(大于360 L/h)时,磷回收率低于90%且随着曝气量增加呈缓慢下降趋势,这主要因为:当曝气量过大时,水的扰动动力强,结晶柱内液体湍流加剧,晶种及其附着在晶种上的HAP晶体颗粒间摩擦力大,使得部分HAP晶体脱落随着出水流失,降低了磷的回收效果.此外,曝气量过大,液体剪切力增加不利于晶核的生长且有可能造成长大的晶体破碎.通过试验发现,当曝气量在210~360 L/h之间时,磷回收率可达到90%以上,最大值92.5%出现在曝气量为270 L/h时.
3 结论
1) 溶液中磷浓度随时间的变化呈准一级反应形式,反应时间为100 min时磷回收率达到最大(91.0%);诱导HAP结晶反应速度快、受温度影响较小,其反应的活化能为5.96 kJ/mol,因而该方法增强了在实际应用中的实用性.
2) pH值对HAP诱导结晶回收磷效果影响较大,当pH>8.5时,可明显提高溶液中的磷回收率,且在一个较宽的pH值范围(8.5~10)内可保持较高的磷回收率(大于89.7%),这为该方法的实际应用提供了可操作性.此外,晶种投加量为60~80 g/L、Ca/P摩尔比为2.5~3.0、曝气量为210~360 L/h时,均可获得较高的磷回收率.
3) 当进水磷浓度为20 mg/L、pH值为9、反应时间为100 min、Ca/P摩尔比2.5、晶种投加量为60 g/L、曝气量为270 L/h、室温条件下,诱导结晶反应柱回收磷的比例可达92.5%.
4) 试验证实了通过诱导HAP结晶回收污水中的磷是可行的,但本试验采用的是模拟含磷废水,当将该诱导结晶反应柱嵌入反硝化同步脱氮除磷工艺中时,其进水是厌氧池的上清液,需要进一步考察溶液中的有机物对HAP诱导结晶的影响.
)
[1] Kim E H, Lee D W, Hwang H K, et al. Recovery of phosphates from wastewater using converter slag: Kinetics analysis of a completely mixed phosphorus crystallization process[J].Chemosphere, 2006,63(2): 192-201.
[2] de-Bashan L E, Bashan Y. Recent advances in removing phosphorus from wastewater and its future use as fertilizer (1997—2003)[J].WaterResearch, 2004,38(19): 4222-4246.
[3] 张卫峰,马文奇,张福锁,等. 中国、美国、摩洛哥磷矿资源优势及开发战略比较分析[J]. 自然资源学报, 2005, 20(3): 378-386.
Zhang Weifeng, Ma Wenqi, Zhang Fusuo, et al. Comparative analysis of the superiority of China’s phosphate rock and development strategies with that of the United States and Morocco[J].JournalofNaturalResources, 2005,20(3): 378-386. (in Chinese)
[4] 郭杰. 诱导结晶法处理含磷废水[D]. 长沙:湖南大学环境科学与工程学院, 2006.
[5] Cornel P, Schaum C. Phosphorus recovery from wastewater: needs, technologies and costs[J].WaterScienceandTechnology, 2009,59(6): 1069-1076.
[6] 徐微,吕锡武. 诱导结晶磷回收技术处理低浓度含磷废水研究[J].环境科学与技术, 2011, 34(12): 119-123.
Xu Wei,Lü Xiwu. Inducing crystallization phosphorus recovery technology used in treatment of wastewater with low phosphorus concentration[J].EnvironmentalScience&Technology, 2011,34(12): 119-123. (in Chinese)
[7] Chen Xuechu, Kong Hainan, Wu Deyi, et al. Phosphate removal and recovery through crystallization of hydroxyapatite using xonotlite as seed crystal[J].JournalofEnvironmentalSciences, 2009,21(5): 575-580.
[8] Suzuki K, Tanaka Y, Kuroda K, et al. Removal and recovery of phosphorous from swine wastewater by demonstration crystallization reactor and struvite accumulation device[J].BioresourceTechnology, 2007,98(8): 1573-1578.
[9] 史静,吕锡武,张怀玉,等. 缺氧段碳源浓度对反硝化聚磷的影响[J]. 东南大学学报:自然科学版, 2011, 41(4): 788-792.
Shi Jing, Lü Xiwu, Zhang Huaiyu, et al. Effect of carbon source concentration on denitrifying phosphorus removal under anoxic condition[J].JournalofSoutheastUniversity:NaturalScienceEdition, 2011,41(4): 788-792. (in Chinese)
[10] van Houwelingen G, Bond R, Seacord T, et al. Experiences with pellet reactor softening as pretreatment for inland desalination in the USA[J].DesalinationandWaterTreatment, 2010,13(1/2/3): 259-266.
[11] Randall D G, Nathoo J, Lewis A E. A case study for treating a reverse osmosis brine using eutectic freeze crystallization:approaching a zero waste process[J].Desalination, 2011,266(1): 256-262.
[12] Moriyama K, Kojima T, Minawa Y, et al. Development of artificial seed crystal for crystallization of calcium phosphate[J].EnvironmentalTechnology, 2001,22(11): 1245-1252.
[13] 郝晓地, 兰荔, 王崇臣, 等. MAP沉淀法目标产物最优形成条件及分析方法[J]. 环境科学, 2009, 30(4):1120-1125.
Hao Xiaodi, Lan Li, Wang Chongchen, et al. Optimal formation conditions and analytical methods of the target product by MAP precipitation[J].EnvironmentalScience, 2009,30(4):1120-1125. (in Chinese)
[14] Carballa M, Moerman W, de Windt W, et al. Strategies to optimize phosphate removal from industrial anaerobic effluents by magnesium ammonium phosphate (MAP) production[J].JournalofChemicalTechnologyandBiotechnology, 2009,84(1): 63-68.
[16] Blöcher C, Niewersch C, Melin T. Phosphorus recovery from sewage sludge with a hybrid process of low pressure wet oxidation and nanofiltration[J].WaterResearch, 2012,46(6): 2009-2019.
[17] Sartorius C, von Horn J, Tettenborn F. Phosphorus recovery from wastewater—expert survey on present use and future potential[J].WaterEnvironmentResearch, 2012,84(4): 313-322.
[18] Barca C, Gerente C, Meyer D, et al. Phosphate removal from synthetic and real wastewater using steel slags produced in Europe[J].WaterResearch, 2012,46(7): 2376-2384.
[19] Gutierrez O, Park D, Sharma K R, et al. Iron salts dosage for sulfide control in sewers induces chemical phosphorus removal during wastewater treatment[J].WaterResearch, 2010,44(11): 3467-3475.
