丹参酮ⅡA对腹膜透析液诱导的氧化应激及腹膜间皮细胞凋亡因子表达的影响
2013-12-25夏阳阳蒋春明孙琤于立杰张苗
夏阳阳,蒋春明,孙琤,于立杰,张苗
(1.南京医科大学鼓楼临床医学院,江苏南京 210008;2.南京大学医学院附属南京鼓楼医院肾内科,江苏南京 210008)
目前临床广泛使用的葡萄糖腹膜透析液(PDF)具有明显的非生物相容性,长期使用可导致腹膜损伤,进而导致腹膜纤维化。腹膜间皮细胞发生凋亡是腹膜纤维化发生发展重要机制之一。目前研究表明,葡萄糖PDF可通过诱导氧化应激反应而促进细胞发生凋亡[1-2]。以往研究证实,丹参酮ⅡA(TSN)在体内、外具有显著抑制多种细胞氧化应激和凋亡的作用[3-4]。本研究主要通过体外细胞培养干预,旨在了解TSN能否通过抑制PDF诱导的氧化应激下调人腹膜间皮细胞(HPMCs)凋亡因子的表达。
1 材料与方法
1.1 主要试剂
正常澳洲胎牛血清、High-glucose DEME培养基、0.25%EDTA-Trypsin均购自GIBCO公司(Great Island,纽约,美国);丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽(GSH)检测试剂盒购自南京建成生物工程研究所;Trizol以及引物购自invitrogen公司(Carlsbad,加利福尼亚洲,美国),逆转录及Real-time-PCR反应试剂盒为日本TAKARA公司(大连,中国)产品;兔抗人 bcl-2、bax抗体购自 Cell Signaling公司(Boston,波士顿,美国),鼠抗人caspase-3抗体购自碧云天生物技术研究所(海门,中国),辣根过氧化物酶(HRP)标记羊抗兔IGg抗体购自Cell Signaling公司(Boston,波士顿,美国),辣根过氧化物酶(HRP)标记羊抗鼠IGg抗体购自碧云天生物技术研究所(海门,中国);4.25%PDF为广州百特医疗用品公司(广州,中国)产品,丹参酮ⅡA磺酸钠注射液为江苏科菲平医药有限公司(南京,中国)产品,30%过氧化氢为南京宁试化学试剂有限公司(南京,中国)产品。
1.2 HPMCs的培养与鉴定
取3位择期腹部手术(非尿毒症、糖尿病、肿瘤、腹膜炎)患者的大网膜组织,按文献[5]方法原代培养HPMCs,按1∶3传代,第3代用于实验,传代细胞经倒置相差显微镜观察,免疫组化鉴定抗细胞角蛋白抗体阳性、抗波形蛋白染色阳性、抗Ⅷ因子抗体阴性、抗白细胞CD45抗体染色阴性。
1.3 方法
1.3.1 细胞培养与分组 氧化应激指标检测分组:用含10%胎牛血清的High-glucose DMEM培养液培养HPMCs,放置于含体积分数为5%的CO2培养箱37℃培养。同步培养24 h后分为5组:对照组(DEME培养基)、PDF组(4.25%PDF)、TSN组(含TSN终浓度为100μmol·L-1的 DEME培养基)、TSN低浓度组(含TSN 终浓度为50 μmol·L-1的4.25%PDF)、TSN高浓度组(含TSN终浓度为100μmol·L-1的4.25%PDF),在37℃、体积分数为5%的CO2培养箱中继续培养48 h用于实验,实验重复3次。细胞凋亡因子检测分组:按照上述培养方法同步培养后分为5组:对照组(DEME 培养基)、H2O2组(3%H2O2)、TSN+H2O2组(含TSN终浓度为50μmol·L-1的3%H2O2)、PDF组(4.25%PDF)、TSN+PDF组(含TSN 终浓度为50μmol·L-1的4.25%PDF),在37℃、体积分数为5%的CO2培养箱中继续培养72 h用于实验,实验重复3次。
1.3.2 上清液中MAD、SOD、GSH浓度检测 取各组细胞培养的上清液,将其保存于-20℃冰箱。按照试剂盒说明分别用硫代巴比妥酸法、黄嘌呤氧化酶法、二硫代二硝酸苯甲酸显色法检测上清液MDA、SOD、GSH浓度。
1.3.3 Real time PCR 法检测 bax、caspase-3、bcl-2 基因的表达 用Trizol试剂盒提取细胞总RNA,1μg RNA按照逆转录试剂盒(TAKARA公司)说明逆转录为 cDNA,20 μl的 bax、caspase-3、bcl-2 反应体系用于PCR扩增。反应在7500Real-time-PCR仪上进行,反应条件:95℃ 30 s,预变性,1个循环;95℃ 5 s,65℃ 34 s,PCR反应,共40个循环。使用GAPDH作为内参,通过2—ΔΔCT方法计算基因表达的相对比值。Real time PCR引物序列见表1。
1.3.4 Western Blot法检测 bax、caspase-3、bcl-2 蛋白表达 用RIPA细胞裂解液提取总蛋白,按BCA试剂盒(凯基生物公司)说明采用BCA法测定蛋白浓度。取等量蛋白样品,进行12%SDS-PAGE凝胶电泳,将蛋白转移至硝酸纤维素膜,放入5%脱脂牛奶在摇床上缓慢摇动,进行室温封闭60 min。然后加入兔抗人抗体bcl-2、bax(1∶1 000 稀释)、鼠抗人抗体 caspase-3(1∶500稀释)和 GAPDH(1∶5 000稀释),4 ℃孵育过夜。次日用TBST洗膜,每次10 min,共4次,然后加入相对应的HRP标记羊抗兔IGg抗体和HRP标记羊抗鼠IGg抗体,室温孵育2 h。再次用同样方法洗膜后加入ECL显色液进行显色,曝光。使用Quantity one分析软件对目的条带进行灰度值分析,目的蛋白灰度值/内参蛋白灰度值为所测蛋白的相对含量。

表1 引物序列Tab 1 Sequences of primers
1.4 统计学处理
采用SPSS17.0软件进行统计分析。数据用均数±标准差表示,组间数据比较采用方差分析;两组间比较采用LSD法检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 上清液中氧化应激指标MAD、SOD、GSH浓度检测结果
各组上清中 MDA、SOD、GSH的含量见表2。其中,PDF组 MDA的含量较对照组显著升高(P<0.01),SOD、GSH的含量显著降低(P<0.01)。与PDF组比较,加入不同浓度TSN的PDF组的MDA含量都明显降低(P<0.01),SOD、GSH的含量都显著升高(P<0.01),但未发现与 TSN浓度高低(50、100μmol·L-1)存在剂量依赖关系(P>0.05)。

表2 上清液中MDA、SOD、GSH的水平Tab 2 The levels of MAD,SOD,GSH in the supernatant
2.2 Real time PCR结果
与对照组比较,H2O2组和PDF组的bax、caspase-3的 mRNA表达量显著增加(P<0.01),bcl-2的mRNA表达量显著减少(P<0.01)。与H2O2组比较,TSN+H2O2组 bax、caspase-3的 mRNA表达量减少(P<0.01),bcl-2的mRNA表达量增加(P<0.01)。与PDF组比较,TSN+PDF组bax、caspase-3的mRNA表达量减少(P<0.01),bcl-2的mRNA表达量增加(P<0.01)。bax、caspase-3、bcl-2的 mRNA 表达情况及定量分析结果见图1。

图1 bax、caspase-3、bcl-2 mRNA Real time PCR 分析结果Fig 1 Real-time quantitative analysis of bax,caspase-3,bcl-2 mRNA
2.3 Western Bolt结果
与对照组比较,H2O2组和PDF组bax、caspase-3的蛋白表达量显著增加(P<0.01),bcl-2的蛋白表达量显著减少(P<0.01)。与H2O2组比较,TSN+H2O2组bax、caspase-3的蛋白表达量减少(P<0.01),bcl-2的蛋白表达量增加(P<0.01)。与PDF组比较,TSN+PDF组bax、caspase-3的蛋白表达量减少(P<0.01),bcl-2的蛋白表达量增加(P<0.01)。bax、caspase-3、bcl-2蛋白表达情况及定量分析结果见图2~4。

图2 bax蛋白印迹分析结果Fig 2 Western Blot analysis of bax
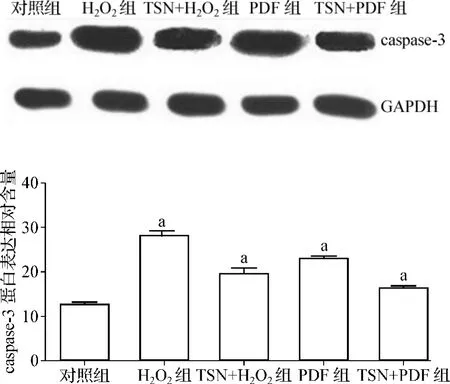
图3 caspase-3蛋白印迹分析结果Fig 3 Western Blot analysis of caspase-3
3 讨 论

图4 bcl-2蛋白印迹分析结果Fig 4 Western Blot analysis of bcl-2
长期使用非生物相容PDF可以导致腹膜纤维化。目前研究表明,腹膜纤维化的发生与PDF所导致的HPMCs凋亡密切相关。凋亡因子表达上调可以启动细胞凋亡的发生。既往已有研究表明PDF可以诱导腹腔发生氧化应激[6],是上调凋亡因子表达的重要因素之一。Kapoor等[7]研究表明,使用抗氧化剂可以抑制高糖诱导的小鼠肝细胞氧化应激并下调凋亡因子的表达。TSN是一种新型有效的抗氧化剂,已被证实具有明显的抗氧化、清除自由基和保护细胞功能等作用[8-9]。作者旨在研究TSN是否具有抑制PDF诱导的HPMCs氧化应激并下调细胞凋亡因子表达的作用。
以往的研究表明,非生物相容性透析液导致的腹膜损伤与腹腔高氧化应激状态有关[10]。Diaz-Buxo等[11]通过对动物模型的研究表明,使用非生物相容性的PDF 30 d后大鼠腹腔内氧化应激指标显著升高,腹膜硬化明显,且腹膜超滤功能显著降低,提示氧化应激在腹膜损伤中起重要作用。本研究发现,在含有高糖PDF的刺激下,培养细胞HPMCs的上清液中氧化应激指标MDA浓度显著高于对照组,SOD、GSH浓度显著低于对照组,表明高糖PDF可以诱导HPMCs氧化应激发生。在添加TSN后氧化应激指标MDA浓度显著降低,SOD、GSH浓度显著升高,提示TSN在体外的确具有抑制PDF诱导HPMCs氧化应激作用。
细胞发生凋亡是氧化应激损伤的重要后果之一,氧化应激产生的氧自由基可以使生物膜的不饱和脂肪酸发生脂质过氧化反应,改变细胞膜的结构及通透性以及线粒体损伤,从而使凋亡因子bax、caspase-3释放到细胞浆内,导致细胞发生凋亡[12-13]。以往研究证实,生物非相容PDF可以导致腹膜间皮细胞凋亡。Boulanger等[14]通过使用不同浓度葡萄糖的透析液与HPMCs共培养发现,HPMCs的凋亡率与透析液葡萄糖浓度成正比。本研究亦发现加入高糖PDF后,HPMCs的凋亡因子mRNA及蛋白含量显著高于对照组,抑制凋亡因子mRNA及蛋白的含量显著低于对照组,证实高糖PDF可以诱导腹膜间皮细胞凋亡。在添加TSN后,HPMCs的凋亡因子mRNA及蛋白含量显著低于PDF组,抑制凋亡因子mRNA及蛋白的含量显著高于PDF组,表明TNN具有抑制PDF诱导的腹膜间皮细胞凋亡作用。
本实验中设立了H2O2组和TSN+H2O2组,以进一步探讨TSN抑制细胞凋亡的作用是否与其抑制氧化应激损伤有关。我们的研究发现H2O2组较对照组细胞凋亡因子bax、caspase-3表达增多,抑制凋亡因子bcl-2表达降低,提示氧化应激的确可以诱导腹膜间皮细胞凋亡。加入TSN后,和H2O2组相比,细胞凋亡因子bax、caspase-3表达显著减少,抑制凋亡因子bcl-2表达显著增多,表明丹参酮可以有效抑制氧化应激诱导的腹膜间皮细胞凋亡。因此,丹参酮对腹膜间皮细胞的保护作用可能是通过抑制氧化应激反应和抑制氧化应激导致的细胞损伤两方面实现的。
[1]YANOM,HASEGAWA G,ISHII M,et al.Short-term exposure of high glucose concentration induces generation of reactive oxygen species in endothelial cells:implication for the oxidative stress associated with postprandial hyperglycemia[J].Redox Rep,2004,9(2):111-116.
[2]RAVICHANDRAN P,BALUCHAMY S,SADANANDAN B,et al.Multiwalled carbon nanotubes activate NF-kappaB and AP-1 signaling pathways to induce apoptosis in rat lung epithelial cells[J].Apoptosis,2010,15(12):1507-1516.
[3]JIA L Q,YANG G L,REN L,et al.Tanshinone ⅡA reduces apoptosis induced by hydrogen peroxide in the human endothelium-derived EA.hy926 cells[J].J Ethnopharmacol,2012,143(1):100-108.
[4]CHEN W,TANG F,XIE B,et al.Amelioration of atherosclerosis by tanshinoneⅡA in hyperlipidemic rabbits through attenuation of oxidative stress[J].Eur J Pharmacol,2012,674(2-3):359-364.
[5]JIMENEZ-HEFFERNAN J A,AGUILERA A,AROEIRA L S,et al.Immunohistochemical characterization of fibroblast subpopulations in normal peritoneal tissue and in peritoneal dialysis-induced fibrosis[J].Virchows Arch,2004,444(3):247-256.
[6]孙琤,张苗,蒋春明.腹膜透析液添加丹参酮ⅡA对氧化应激状态的影响[J].现代医学,2011,39(4):430-434.
[7]KAPOOR R,KAKKAR P.Protective role of morin,a flavonoid,against high glucose induced oxidative stress mediated apoptosis in primary rat hepatocytes[J].PLoS One,2012,7(8):e41663.
[8]罗旭敏,蔡伟,徐积兄,等.丹参酮ⅡA对2型糖尿病患者氧化应激的作用[J].江西医学院学报,2009,49(4):90-92,95.
[9]陆璐,李新荣,邓湘蕾,等.丹参酮ⅡA对高糖培养的大鼠血管平滑肌细胞p38 MAPK信号通路的影响[J].东南大学学报:医学版,2008,27(2):130-133.
[10]NOH H,KIM J S,HAN K H,et al.Oxidative stress during peritoneal dialysis:implications in functional and structural changes in the membrane[J].Kidney Int,2006,69(11):2022-2028.
[11]DIAZ-BUXO J A,GOTLOIB L.Agents that modulate peritoneal membrane structure and function[J].Perit Dial Int,2007,27(1):16-30.
[12]GUO S,YAN J,YANG T,et al.Protective effects of green tea polyphenols in the 6-OHDA rat model of Parkinson's disease through inhibition of ROS-NO pathway[J].Biol Psychiatry,2007,62(12):1353-1362.
[13]CHHABRA R,DUBEY R,SAINI N.Gene expression profiling indicate role of ER stress in miR-23a~27a~24-2 cluster induced apoptosis in HEK293T cells[J].RNA Biol,2011,8(4):648-664.
[14]BOULANGER E,WAUTIER M P,GANE P,et al.The triggering of human peritoneal mesothelial cell apoptosis and oncosis by glucose and glycoxydation products[J].Nephrol Dial Transplant,2004,19(9):2208-2216.
