吡格列酮对胶质瘤细胞生长的抑制研究
2013-12-25万政强陈晨伏林山孙关
万政强,陈晨,伏林山,孙关
(盐城市第一人民医院神经外科,江苏盐城 224001)
胶质瘤是中枢神经系统最常见的恶性肿瘤,由于生长位置特殊、恶性程度高以及血脑屏障的存在,目前临床上胶质瘤治疗效果极差[1]。过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors γ,PPARγ)的生物学功能复杂,参与调控脂肪和糖代谢、脂肪细胞终末分化、能量平衡,控制单核细胞分化成熟,诱导巨噬细胞凋亡,抑制炎症反应,促进排卵,抗肝纤维化和动脉粥样硬化,降血脂和血压,并能够诱导肿瘤细胞分化和凋亡,抑制肿瘤血管生成[2]。近年来,PPARγ激动剂的抗肿瘤作用成为研究热点,本实验采用PPARγ激动剂吡格列酮处理细胞,研究吡格列酮对胶质瘤细胞生物学功能的影响及其相关作用机制。
1 材料和方法
1.1 材料
人胶质瘤细胞系U251细胞购自中国科学院上海细胞库,TUNEL及CCK-8试剂盒购自上海碧云天生物技术有限公司,β 连环蛋白(β-catenin)、MMP-2、Bad、Bax一抗购自Santa Cruz公司,转染试剂Lipofectamine 2000购自Invitrogen公司,吡格列酮购自美国Sigma公司。
1.2 细胞培养
细胞培养于含10%新生牛血清的DMEM培养基,并置于37℃、体积分数为5%的CO2孵箱中,取对数生长期细胞进行实验。
1.3 β-catenin反义寡聚核苷酸设计合成
β-catenin反义寡聚核苷酸由上海吉玛公司设计合成,其合成序列为5'-AAG TCC TGT ATG AGT GGG AAC-3'。
1.4 CCK-8法检测细胞增殖
各组细胞加吡格列酮处理后每孔1×104个细胞接种于 96孔培养板,加入培养液 100μl·孔-1,37℃、体积分数为5%的CO2培养24、48、72 h。检测前4 h每孔加CCK-8溶液10μl,继续孵育2~4 h,弃上清液,选择490 nm波长,用酶标仪测定每孔吸光度值,取5孔的平均值,实验重复3次。
1.5 划痕试验检测细胞侵袭
取90%融合度的U251细胞经无血清DMEM同步化24 h,用无菌的移液管尖(约0.7 mm)在各培养板细胞生长单层的相同位置划直线,分别用含100μmol·L-1吡格列酮和DMSO的DMEM培养液培养细胞过夜。分别于划痕后12、24 h在显微镜下观察细胞,随机选取5个视野进行拍摄(×40)。
1.6 TUNEL法检测细胞凋亡
各组细胞加吡格列酮处理后固定液固定细胞30 min,加配制好的 TUNEL检测液,37℃避光孵育60 min,抗荧光淬灭剂封片后荧光显微镜下观察细胞。
1.7 Western Blot法检测蛋白表达
各组细胞处理后收集细胞,RIPA裂解液裂解,收获蛋白并行BCA法定量,40μg蛋白上样于10%SDSPAGE凝胶电泳分离蛋白,湿转至PVDF膜并用5%脱脂奶粉于37℃条件下封闭1 h,一抗(β-catenin、MMP-2、Bad、Bax 1∶500稀释)4 ℃孵育过夜,HRP 标记的二抗孵育1.5 h,以β-actin作为内参,将超敏发光液加在PVDF膜上,曝光显影。
1.8 统计学处理
实验均独立重复3次,实验数据用均数±标准差表示,采用SPSS 11.5统计软件进行常规统计,行t检验,P<0.05认为差异有统计学意义。
2 结 果
2.1 吡格列酮对胶质瘤细胞生长的影响
选择U251胶质瘤细胞株分别给予不同浓度吡格列酮(1、10、50、100、200 μmol·L-1)处理 1、3、5、7 d,采用CCK-8法检测吡格列酮对胶质瘤细胞增殖活力的影响。如图1所示:1、10、50 μmol·L-1的吡格列酮对胶质瘤细胞的生长无明显抑制作用,100μmol·L-1的吡格列酮作用3 d后U251细胞增殖活力降至(54.6±2.8)%,且随着药物作用时间的延长,细胞增殖能力逐渐降低。将药物浓度增加至200μmol·L-1后,U251细胞的生长明显受到抑制。结果表明吡格列酮能抑制胶质瘤细胞的生长,且随药物浓度和作用时间的增加,细胞活力逐渐降低,呈药物浓度-时间负性依赖方式。
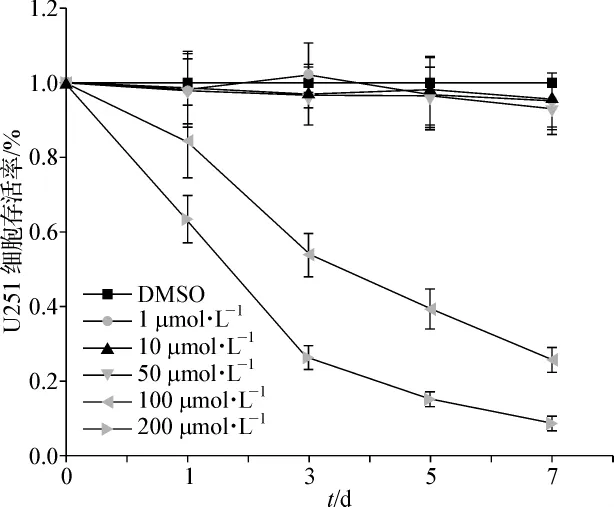
图1 CCK-8法显示吡格列酮抑制U251细胞增殖,并呈时间-剂量依赖性
2.2 吡格列酮抑制胶质瘤细胞侵袭
划痕损伤形成伤口模型后,划痕边缘的细胞以出芽的方式向外生长,导致伤口面积逐渐缩小。损伤24 h后,对照组约有80%的伤口面积重新融合,而吡格列酮组的伤口面积几乎没有改变。Western Blot检测显示,吡格列酮能显著降低MMP-2的蛋白表达(P<0.05)(图2),提示吡格列酮能增加胶质瘤细胞的黏附性,抑制细胞的侵袭和转移。

图2 A.划痕试验显示吡格列酮抑制胶质瘤U251细胞侵袭;B.吡格列酮抑制MMP-2蛋白表达
2.3 吡格列酮对胶质瘤细胞凋亡的影响
TUNEL法发现吡格列酮处理细胞24 h后,显微镜下绿色荧光阳性细胞显著多于对照组,提示吡格列酮能诱导胶质瘤细胞发生凋亡。同时,U251细胞中凋亡诱导蛋白Bad、Bax表达均上调,与对照组相比均差异有统计学意义(P<0.05)(图3)。结果表明,吡格列酮能够促使胶质瘤细胞凋亡显著增加。
2.4 吡格列酮抑制β-catenin蛋白表达水平
Western Blot法检测发现吡格列酮处理U251细胞后,细胞内β-catenin蛋白表达水平逐渐降低,呈浓度-时间依赖方式(图4)。
2.5 β-catenin siRNA抑制相关基因表达
U251细胞转染β-catenin反义寡聚核苷酸发现,βcatenin siRNA明显下调MMP-2蛋白,并激活促凋亡蛋白Bad和Bax的表达。见图5。
3 讨 论
吡格列酮是一种人工合成的高选择性PPARγ激动剂,临床上常用于治疗Ⅱ型糖尿病,上市以来经过几年的临床使用尚未发现有明显的副作用。近年来研究表明,吡格列酮具有抗肿瘤的功效,能抑制多种肿瘤细胞生长[3-5],但是吡格列酮对胶质瘤细胞作用的研究鲜有报道。

图3 A.TUNEL实验表明吡格列酮诱导胶质瘤U251细胞凋亡;B.吡格列酮抑制凋亡相关蛋白Bad、Bax表达

图4 随着吡格列酮浓度的增加及作用时间的延长,β-catenin蛋白表达水平逐渐下调
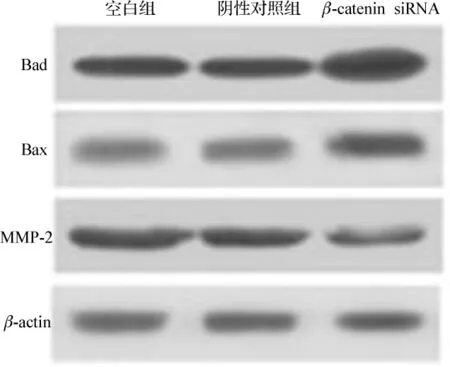
图5 β-catenin siRNA下调U251细胞中MMP-2蛋白表达,上调Bad、Bax蛋白表达
肿瘤发生最突出的特征是细胞异常增殖,因此本研究首先采用CCK-8法观察了吡格列酮对胶质瘤U251细胞增殖活性的影响,结果发现随药物浓度和作用时间的增加细胞活力逐渐降低,呈药物浓度-时间负性依赖方式。胶质瘤发生发展过程中主要以局部浸润为主,肿瘤细胞从肿瘤中心向周边正常脑组织侵袭,无包膜形成,造成手术界限不清,肿瘤组织无法完全切除,导致残留肿瘤组织在颅内继续生长是治疗失败及肿瘤复发的重要因素。迁移能力增强是肿瘤细胞侵袭的一个主要步骤;在胶质瘤细胞侵袭过程中,蛋白酶对细胞外基质(extacrellularmairix,ECM)的降解是另一个关键步骤。其中以基质金属蛋白酶类(matrix metalloproeteinases,MMPs)最为重要,几乎能降解ECM和基底膜的所有成分,在ECM降解过程中起主导作用[6]。MMP-2是MMPs中一种重要的蛋白酶,与胶质瘤细胞的侵袭性密切相关[7-8]。本研究通过细胞划痕实验发现,吡格列酮能抑制胶质瘤U251细胞的迁移能力;Western Blot法检测显示,吡格列酮能显著降低MMP-2的蛋白表达,提示吡格列酮能增加胶质瘤细胞的黏附性,抑制细胞的迁移和侵袭。
研究显示,呈侵袭性的细胞可通过表达某些凋亡调节基因抑制细胞凋亡的发生。凋亡途径障碍在肿瘤的发生发展中起着重要作用,促进恶性肿瘤细胞凋亡是肿瘤生物治疗的重要方向。通过TUNEL荧光染色,本研究发现吡格列酮在抑制胶质瘤细胞生长和迁移的同时还促进了细胞的凋亡。在调节细胞凋亡的蛋白中,Bad和Bax蛋白是关键性凋亡诱导因子。我们的研究发现,吡格列酮可以上调胶质瘤细胞中Bad和Bax蛋白表达水平。
β-catenin是连环蛋白家族中的一员,它既是Wnt信号转导通路中的一个重要组成部分,同时又是重要的细胞黏附分子和细胞骨架成分[9]。目前,β-catenin被公认为是一种原癌基因[10]。实验结果显示,吡格列酮能够显著降低胶质瘤细胞中β-catenin的蛋白水平。特异性敲除β-catenin后胶质瘤细胞中MMP-2表达下调,而Bad和Bax蛋白表达水平明显上调。因此,我们认为吡格列酮的抗胶质瘤作用机制是通过调节βcatenin的表达介导的。吡格列酮通过抑制胶质瘤细胞中β-catenin的表达破坏其对下游靶基因的转录,从而抑制胶质瘤的发生。
本实验研究证明,吡格列酮通过β-catenin介导抑制胶质瘤细胞生长,且通过下调MMP-2的表达降低细胞的侵袭能力,上调Bad和Bax水平来诱导胶质瘤细胞凋亡。上述结果提示吡格列酮对胶质瘤细胞具有抗肿瘤的功效,有望作为胶质瘤新的治疗药物,具有重要的临床应用价值。
[1]张建超,杨天明.磁性纳米铁治疗大鼠胶质瘤的实验研究[J].东南大学学报:医学版,2010,29(3):254-259.
[2]HOUSEKNECHT K L,COLE B M,STEELE P J.Peroxisome proliferator-activated receptor gamma(PPARgamma)and its ligands:a review[J].Domest Anim Endocrinol,2002,22(1):1-23.
[3]KOGA H,SELVENDIRAN K,SIVAKUMAR R,et al.PPARγ potentiates anticancer effects of gemcitabine on human pancreatic cancer cells[J].Int J Oncol,2012,40(3):679-685.
[4]FU H,ZHANG J,PAN J,et al.Chemoprevention of lung carcinogenesis by the combination of aerosolized budesonide and oral pioglitazone in A/Jmice[J].Mol Carcinog,2011,50(12):913-921.
[5]郭晏同,冷希圣,赵景明,等.过氧化物酶体增殖物激活受体γ配体对诱导大鼠肝癌的抑制作用[J].中华肝脏病杂志,2005,13(2):145-146.
[6]CURRAN S,MURRAY GI.Martix metalloporoteinase in tumor invasion and metastis[J].J Pathol,1999,189(3):300-308.
[7]RAO JS,STECK P A,MOHANAM S,et al.Elevated levels of M(r)92,000 type IV collagenase in human brain tumors[J].Cancer Res,1993,53:2208-2211.
[8]FORSYTH P A,WONG H,LAING T D,et al.Gelatinase-A(MMP-2),gelatinase-B(MMP-9)and membrane type matrix metalloproteinase-1(MT1-MMP)are involved in different aspects of the pathophysiology of malignant gliomas[J].Br J Cancer,1999,79:1828-3185.
[9]BUCHMAN J J,DURAK O,TSAI L H.ASPM regulatis Wnt signaling pathway activity in the develpoing brain[J].Genes Dev,2011,25(18):1909-1914.
[10]LIM SC,LEE M S.Significance of E-cadherin/beta-catenin complex and cyclinD1 in breast cancer[J].Oncol Rep,2002,9(5):915-928.
