缺血后适应联用粒细胞集落刺激因子对心肌急性缺血再灌注损伤的保护作用
2013-12-25于宗良陈乐杨向军
于宗良,陈乐,杨向军
(1.江苏大学附属昆山医院心内科,江苏昆山 215300;2.苏州大学附属第一医院心内科,江苏苏州 215006)
与缺血预适应相比,现有的研究相继表明缺血后适应(ischemic postconditioning,IP)同样可以减轻急性心肌缺血再灌注损伤,也可减少梗死心肌面积等[1-5]。粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)是一类新型的拮抗心肌细胞凋亡、提高心肌细胞活力、促进血管新生的细胞因子[6-9],因而将IP和G-CSF应用治疗急性心肌梗死受到较多的关注,但确切的临床疗效仍有较大争议[5,9]。本研究从心肌缺血再灌注损伤、心室重构以及超微结构等三方面,探究二者联合应用对心肌缺血再灌注损伤的保护效应及其可能机制,为临床应用提供实验依据。
1 材料与方法
1.1 动物模型的制作
体重在2.2~2.8 kg之间的健康雄性新西兰白兔,3%戊巴比妥钠静脉注射麻醉后开胸暴露心脏,在左心耳下缘与心尖连线中点之间的连接面上,采用双线双结法结扎心脏冠状动脉左室支(LVA)[10]。以结扎局部心肌的搏动明显减弱、苍白,心电图ST-T改变及血肌钙蛋白I(cTnI)升高为模型制作成功标志。
1.2 药物及剂量
G-CSF注射液(商品名:洁欣;苏州中凯生物制药;批号:药准字 S19991002),剂量为10μg·kg-1·d-1,采用皮下注射,缺血再灌注12 h后给药,连用5 d。
1.3 分组及处理
将建模成功的动物随机分为4组,即:单纯缺血再灌注对照组(IR组),松开结扎的线结后立即进行再灌注,12 h后开始皮下注射生理盐水0.5 ml,每天1次,连续5 d;粒细胞集落刺激因子组(G-CSF组),在单纯缺血再灌注组的基础上,于再灌注12 h后皮下注射G-CSF;IP组,在再灌注开始的1 min内通过周期性结扎和松解LVA的线结,进行缺血30 s/再灌注30 s的连续循环4次的IP处理,最后完全恢复左室支血流,再灌注12 h后皮下注射生理盐水0.5 ml;G-CSF+IP组,联合采用IP及G-CSF进行干预。所有受试白兔在再灌注15 min后缝合胸腔,精心饲养。在缺血再灌注以及治疗过程中,增补死亡动物,保证每组完成实验数为15只。
1.4 外周血白细胞计数及cTnI检测
麻醉后抽取股静脉血2 ml,分别进行外周血白细胞计数及cTnI检测,饲养7 d后再次抽取股静脉血测定cTnI及外周血白细胞计数。
1.5 超声心动图测定
4个实验组的新西兰兔饲养4周,使用二维切面及M超声,测量左房内径、室间隔厚度、左室后壁厚度、左室舒张期末径、左室收缩期末径、左室短轴缩短率,估算射血分数(EF)以评价心功能。
1.6 组织病理学检查
在超声心动图检查后静脉注射空气处死兔,分离心脏进行大体标本检查,坏死心肌染色并观察超微结构。心脏标本于-80℃冷冻半小时后,采用振动切片沿左室长轴将左室横切为厚约2 mm的薄片,在电子天平上称重后置于1%TTC溶液染色。灰白色部分为梗死心肌,砖红色部分为存活心肌,分离心肌,滤纸吸干染液后分别称重。梗死心肌面积为梗死心肌重量与左室心肌总重量的百分比。采用透射电子显微镜(JSM-840)进行超微结构观察。
1.7 统计学处理
所有数据整理和分析采用SPSS 13.0软件完成。数值变量资料以±s表示,分类变量资料以百分比(%)表示,两样本均数的比较采用成组资料t检验,同一组处理前后的比较采用配对t检验,多组样本均数的比较采用单因素方差分析,两两比较采用q检验,P<0.05作为差异有统计学意义的标准。
2 结 果
2.1 术中心电监测(缺血再灌注前后ST段变化)
实验动物结扎LVA后数分钟内,心电监护(Ⅱ导联)就显示ST段较结扎前明显抬高;而在松结再灌注后,采用后适应处理的再灌注的两组实验兔的ST段回落明显加快,和单纯缺血再灌注组的差异具有统计学意义(P<0.05)(表1)。
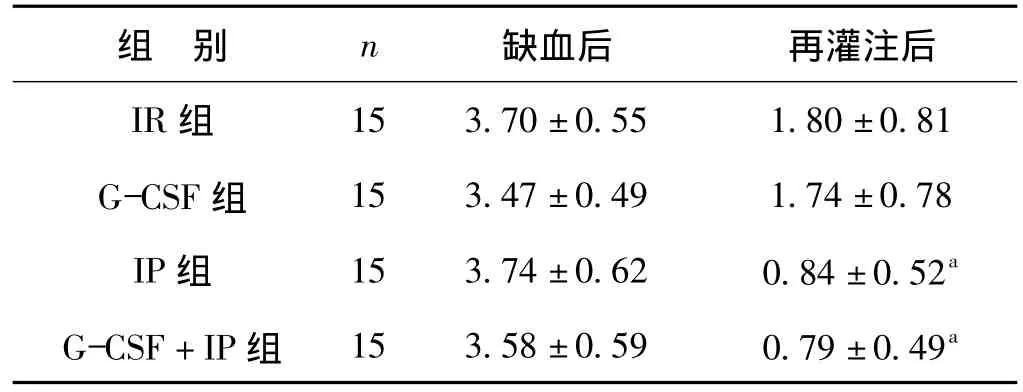
表1 缺血15 min及再灌注15 min对新西兰兔Ⅱ导联ST段的影响 mmTab 1 ST-segment(leadⅡ)resolutions before and after reperfusion in each group mm
2.2 外周血白细胞计数
从表2可以看出,和手术前相比,给予G-CSF可以明显升高外周血白细胞数(P<0.05),这一结果显示了G-CSF的造血动员作用。
2.3 cTnI含量的变化
术后7 d各组的cTnI含量均较术前有所升高,但G-CSF、IP、G-CSF+IP组的升高幅度明显低于IR组(P<0.05)(表3)。

表2 实验动物术前及术后7 d外周血白细胞数Tab 2 WBC before and 7 d after operation in each group
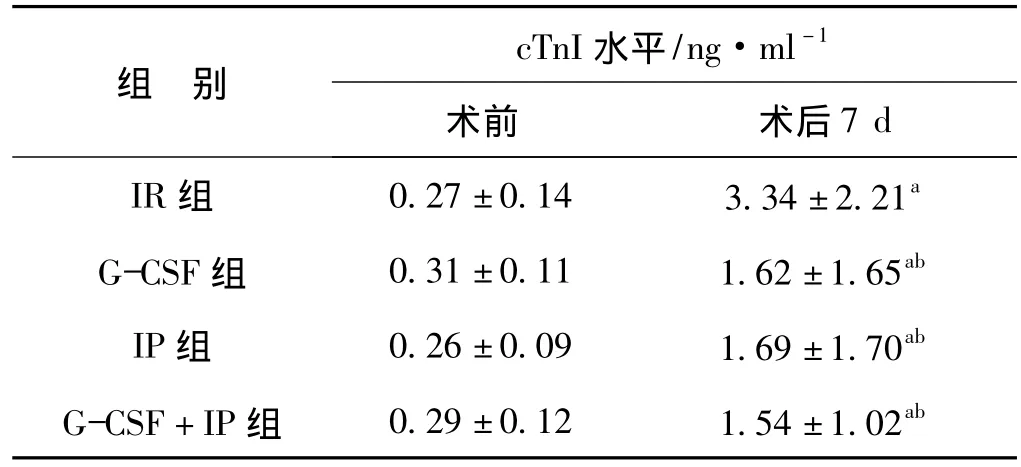
表3 缺血再灌注各组术前及术后cTnI水平Tab 3 cTnI before and 7 d after operation in each group
2.4 心功能及心室重构
术后4周超声心动图检查提示单纯IR组的平均左室舒张末期直径(LVIDd)最大,提示其收缩功能恢复最差;而IP+G-CSF组的心室重构最轻,LVEF也明显优于其他3组(P<0.05),见表4。
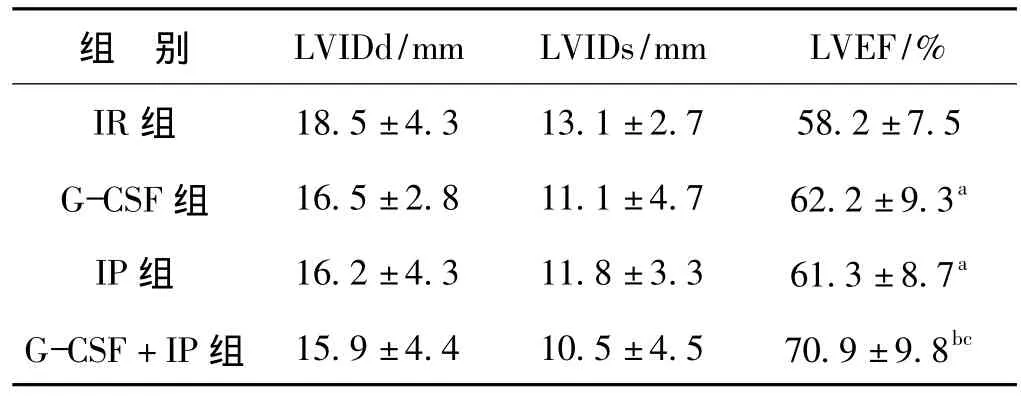
表4 不同处理方式对缺血再灌注兔术后4周心功能的影响Tab 4 Ultrasound cardiography 4 weeks after operation in each group
2.5 梗死心肌面积
从表5可见,与 IR 组相比,G-CSF、IP、G-CSF+IP组心肌梗死面积均明显减少。与G-CSF组及IP组相比,G-CSF+IP组梗死范围稍小,但差异无统计学意义。
2.6 心肌细胞超微结构变化
采用透射电子显微镜观察发现IR组肌丝排列紊乱,线粒体肿胀明显,有部分空泡变。G-CSF组仍有肌丝排列轻度紊乱,但未见肌丝溶解,且线粒体肿胀也不明显。IP组的肌丝排列稍不整齐,未见肌丝溶解,线粒体仍有肿胀。G-CSF+IP组的肌丝排列基本整齐,同样未见肌丝溶解,大部分线粒体结构完整(图1)。采用后适应、G-CSF干预后,肌丝和线粒体损伤程度均明显减轻,G-CSF+IP组的减轻幅度最大。
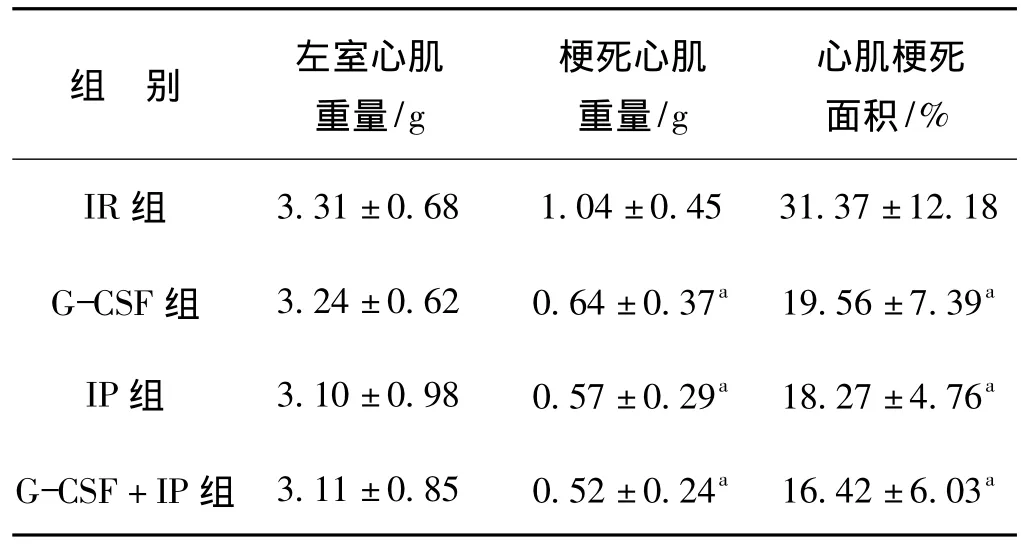
表5 不同处理方式对缺血再灌注兔心肌梗死面积的影响Tab 5 The weight of LV,MI,and infarct size in each group

图1 不同处理方式对缺血再灌注兔心肌细胞超微结构的影响 ×15 000Fig 1 Transmission electron microscope diversify of cardiomyocytes in each group ×15 000
3 讨 论
防治急性心肌梗死的关键是采用急诊冠脉介入治疗、溶栓等措施进行及时再灌注,但是由此引发的再灌注损伤却又大大降低了再灌注的获益,因而有效预防再灌注损伤是提高急性心梗治疗效果的重要保证。本研究率先采用IP优化再灌注同时给予促进心肌功能修复的G-CSF,发现与单纯缺血再灌注相比,IP或GCSF均能显著减轻心肌损伤、缩小梗死心肌面积,同时IP或G-CSF组的心室重构和超微结构损伤较IR组明显减轻,而其中IP与G-CSF联合应用的心肌保护作用较单用IP或G-CSF更好。
IP是指心肌急性缺血后在进行较长时间的再灌注之前,给予快速短暂的一次或数次重复缺血/再灌注,这一措施能够提高心肌对缺血后再灌注损伤的耐受性,减少缺血/再灌注损伤[2]。如此同时,如何促进梗死心肌的修复则是另一难题,已有研究发现G-CSF能够动员骨髓间质干细胞直接分化为心肌细胞,迅速趋化到受损心肌,促进坏死心肌的修复;G-CSF也可通过旁分泌机制促进血管再生,另外G-CSF还能直接作用于靶细胞上的受体抑制细胞凋亡来发挥细胞保护作用[9]。目前的动物实验及部分临床试验已证实IP和G-CSF确实具有心肌保护作用,因而这两者的临床应用值得探讨,特别是急诊冠脉介入治疗术的发展为IP和 G-CSF 的临床应用提供了可行性[5,9]。
本实验首次采用G-CSF联合IP干预急性心肌缺血性梗死,首先IP可以减少再灌注损伤,其次外周血白细胞计数显示采用G-CSF的剂量和给药时间确实动员了机体骨髓干细胞,提示G-CSF的保护机制与细胞动员和诱导分化有关。我们的研究结果也表明,联合应用G-CSF与IP治疗急性心肌梗死不仅减轻缺血再灌注损伤,也促进了心功能的恢复,同时超微结构损伤的逆转也为心肌的后期修复提供了物质基础,而且联合应用的效果明显优于单独应用。
我们的研究为IP与G-CSF的联合应用治疗心肌急性缺血再灌注损伤提供了一定的实验依据和理论基础,但是二者联合治疗的分子生物学机制、最佳的联合治疗方式等等尚需要更深入的研究。
[1]YELLON D M,HAUSENLOY D J.Myocardial reperfusion injury[J].N Engl JMed,2007,357(11):1121-1135.
[2]ZHAO Z Q,CORVERA JS,HALKOSM E,et al.Inhibition of myocardial injury by ischemic postconditioning during reperfusion:comparison with ischemic preconditioning[J].Am J Physiol Heart Circ Physiol,2003,285(2):H579-588.
[3]陈晓栋,娄彬,于圣永,等.缺血后适应对急性心肌梗死PCI术中再灌注心律失常的疗效评估[J].现代医学,2010,38(3):253-256.
[4]YANG X M,PROCTOR JB,CUI L,et al.Multiple,brief coronary occlusions during early reperfusion protect rabbit hearts by targeting cell signaling pathways[J].J Am Coll Cardiol,2004,44:1103-1110.
[5]OVIZE M,BAXTER G F,di LISA F,et al.Postconditioning and protection from reperfusion injury:where do we stand?Position paper from the Working Group of Cellular Biology of the Heart of the European Society of Cardiology[J].Cardiovasc Res,2010,87(3):406-423.
[6]ORLICD,KAJSTURA J,CHIMENTI S,et al.Mobilized bone marrow cells repair the infarcted heart,improving function and survival[J].Proc Natl Acad Sci,2001,98:10344-10349.
[7]RAFII S,MEEUSS,DIASS,et al.Contribution of marrow derived progenitors to vascular and cardiac regeneration[J].Semin Cell Dev Biol,2002,13:61-67.
[8]徐琢,冯毅,童嘉毅,等.超声微泡辅助干细胞移植治疗急性心肌梗死的实验研究[J].东南大学学报:医学版,2008,27(3):192-194.
[9]SHIM W,ASHISH M,LIM S Y,et al.G-CSF for stem cell therapy in acute myocardial infarction:friend or foe?[J].Cardiovasc Res,2011,89:20-30.
[10]薛枫,杨向军,李勋,等.兔在体心脏缺血再灌注模型的制作方法的改进[J].中国比较医学,2010,20:51-53.
