高效液相色谱法测定人血浆中头孢替坦二钠含量的不确定度
2013-12-23刘亚妮马林刘金梅吕永宁师少军华中科技大学同济医学院附属协和医院药剂科湖北武汉430022
刘亚妮,马林,刘金梅,吕永宁,师少军 (华中科技大学同济医学院附属协和医院药剂科,湖北 武汉430022)
测量不确定度是与测量结果关联的一个参数,用于表征合理赋予被测量值的分散性;广义上是指对测量结果正确性的可疑程度[1]。测量不确定度是目前国际上普遍认可和推荐使用的定量说明检测结果质量的一个参数[2]。在生物样本分析测试领域,越来越倍受重视,测量不确定度与实验室的质量保证和质量控制密切相关[3-4]。生物等效性及临床药动学研究需进行大样本的生物样品测定,其分析结果的可靠性直接决定了药物安全性及有效性的评定。为此,有必要探讨生物样品检测结果的不确定。本文根据国家计量技术规范和不确定度评定的相关资料,结合已发表的文献[4-8],对高效液相色谱法测定血浆中头孢替坦二钠的不确定度进行分析,找出影响不确定度的因素,对不确定度进行评估,最终得出测定结果扩展不确定度值,如实反映测量的置信度和准确度,对试验结果的可信性、可比性和可接受性有非常重要的意义。
1 材料
岛津液相色谱仪 器(LC-20AT 泵,SIL-20A 自动进样器,SPD-M20A 二极管阵列检测器,LGC-1025M 柱温箱,LC-SOLUTION 色谱工作站);头孢替坦二钠对照品(纯度:91.8%,批号CTD0912001,广州博济新药临床研究中心提供);氯霉素对照品(内标,纯度:99.92%,批号CH090356,南京白敬宇制药有限责任公司);岛津AUW-220D 电子分析天平;甲醇、乙腈为色谱纯;水为纯化水;空白血浆来源于武汉市血液中心。
2 方法与结果
2.1 色 谱 条 件[9]Thermo ODS-2 HYPERSIL C18(250 mm×4.6 mm,5μm);预柱:岛津Shimpack GVP-ODS(4.6 mm ×10 mm);流动相:乙腈-0.5%磷酸=20∶80(v/v);流速:1.0mL·min-1;进样量:20μL;柱温:40 ℃;检测波长:300 nm。
2.2 对照品溶液和内标溶液的配制
2.2.1 头孢替坦二钠对照标准溶液配制 精密称定头孢替坦二钠81.7 mg置25 mL 量瓶,用流动相溶解并稀释至刻度,配得3.0mg·mL-1头孢替坦二钠母液(C8)。分别用流动相依次稀释配制成含头孢替坦二钠1 200(C7),600(C6),300(C5),60(C4),30(C3),15(C2),5.25(C1)μg·mL-1的系列标准溶液和含头孢替坦二钠12(L),270(M),2 700(H)μg·mL-1的质控标准溶液。溶液配制过程中需用到10 mL量瓶,5 mL单标线移液管和5 mL 分度吸量管。
2.2.2 内标标准溶液配制 精密称定氯霉素对照品25.0mg置25 mL 量瓶,用甲醇溶解并稀释至刻度,配得1.0 mg·mL-1内标母液。精密吸取5 mL内标母液置25 mL 量瓶,用甲醇稀释至刻度,制得氯霉素质量浓度为200μg·mL-1的标准溶液,作为内标标准液。
2.3 含药血浆样本的配制 精密吸取空白血浆500μL(移液器量程100~1 000μL),依次加入“2.2.1”项下的头孢替坦二钠的系列标准溶液(C1至C8)和质控标准溶液各50μL(移液器量程20~200μL),涡旋30 s,混匀,配制成相当于头孢替坦二钠 质 量 浓 度 为0.525,1.5,3.0,6.0,30.0,60.0,120.0,300.0μg·mL-1的系列标准血浆样本以及质量浓度为1.2,27.0,270.0μg·mL-1的质控样本。
2.4 血浆样本的处理 精密吸取血浆样本500 μL,置1.5 mL的Ep管中,精密加入内标溶液和流动相各50μL,涡旋10 s后,加入35%的高氯酸50 μL,涡旋1 min,然后于12 000 r·min-1离心10 min,吸取上清置于进样瓶中。
2.5 样品分析 取“2.4”项下处理后的上清液20 μL进行HPLC 分析,测定计算头孢替坦二钠的峰面积As和内标峰面积Ai的比值R (R =As/Ai)。以峰面积比值R 对血药浓度C 进行加权最小二乘法线性拟合,得标准曲线回归方程。样品用同样的方法分析后,代入回归方程,计算待测血浆中头孢替坦二钠浓度。
2.6 数学模型的建立 标准曲线公式:R =a×C+b,血浆中头孢替坦二钠浓度计算公式:C=(Rb)/a其中:a为标准曲线回归方程斜率,b为标准曲线回归方程截距,R 为头孢替坦二钠与内标峰面积之比,C 为头孢替坦二钠最终血浆测得浓度。
2.7 不确定度来源 头孢替坦二钠血浆样本测定的过程中,对测定结果产生影响的因素都是不确定度的来源,主要有操作重复性,天平称量,标准溶液配制,标准血浆样本的配制,血浆样本的处理,标准曲线的拟合,高效液相仪器测定、样品纯度及温度等因素,见图1。
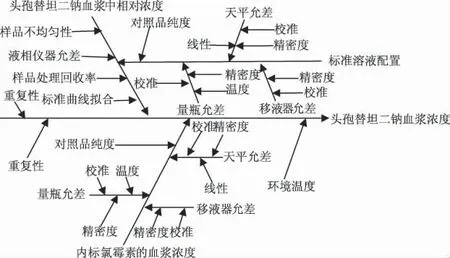
图1 不确定度来源分析图Fig 1 The source of uncertainty
2.8 测定结果的A 类不确定度评定 重复性引入的不确定度用A 类评定程序。按“2.3”项下的方法平行配制质量浓度为1.2,27.0,270.0μg·mL-1的质控样本各5份,共配制3批,结果见表1。
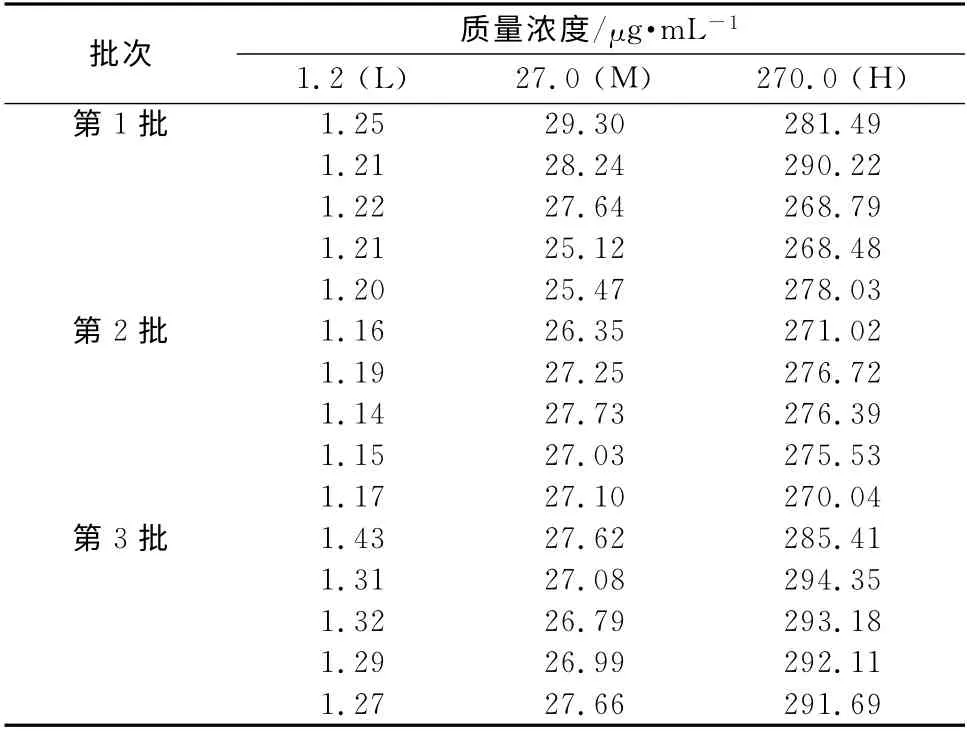
表1 头孢替坦二钠样品重复测定结果Tab 1 The repeatability for determination of cefotetan disodium
根据贝塞尔公式计算合并样本标准偏差:

其中m 为批次,n 为每批平行测定份数。经计算低浓度标准偏差均值为S(x,L)=0.048μg·mL-1;测定结果的标准不确定度为:
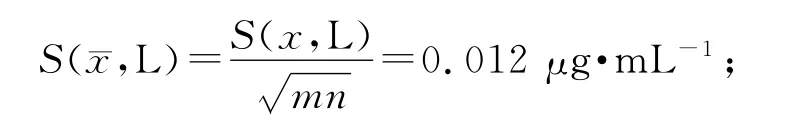
相对不确定度为:
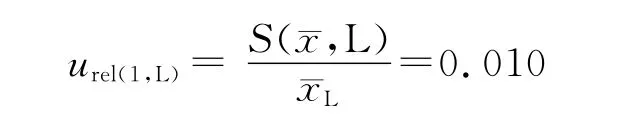
同法计算中浓度和高浓度相对标准不确定度为:

2.9 测定结果的B类不确定度评定
2.9.1 天平称量时引入的测量不确定度 用十万分之一的电子天平,可自动扣皮重。
数学模型y=m+△+△0
其中m 为透明部分,△为天平的非线性误差,△0为自动调零引起的误差。
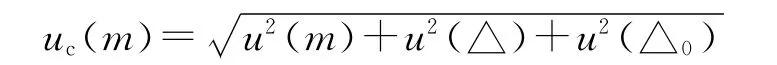
其中u(m)已经在重复性试验中产生贡献,此处不再考虑。按均匀考虑,取包含因子k=,仪器说明书提供的e为0.10 mg,天平非线性误差引起的标准测量不确定度:
自动调零作为一次扣皮,a0=a,则自动调零引起的标准测量不确定度为:
称量时天平引入的不确定度为
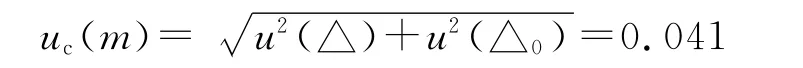
称量头孢替坦二钠的相对标准不确定度为:
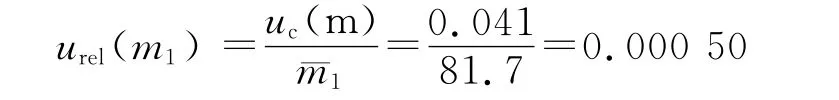
不考虑重复性误差时,称量内标的相对标准不确定度:

称量引起的相对标准不确定度为:
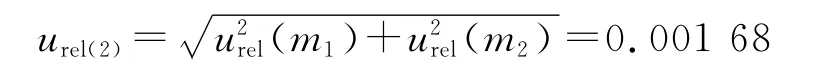
2.9.2 标准溶液配制引入的测量不确定度 ①量瓶定容引入的不确定度:配制储备液及标准溶液所用量瓶为10 mL和25 mL,其最大允许误差分别为±0.02 mL和±0.03 mL。由于温度对定容的影响非常小,可忽略不计。按均匀分布,量瓶的相对标准不确定度为:
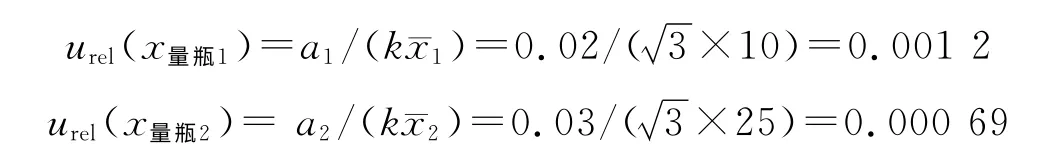
②移液管和分度吸量管引入的不确定度:配制标准溶液时用到5 mL移液管和5 mL分度吸量管,最大允许误差分别为±0.015 mL 和±0.025 mL。由于温度对于移液管影响较小,可忽略不计。按均匀分布,其相对标准不确定度分别为:
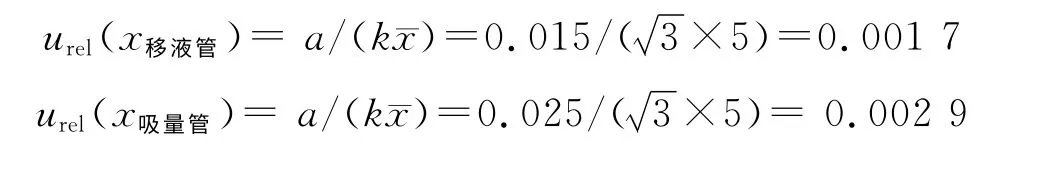
标准溶液配制时引入的不确定度为:
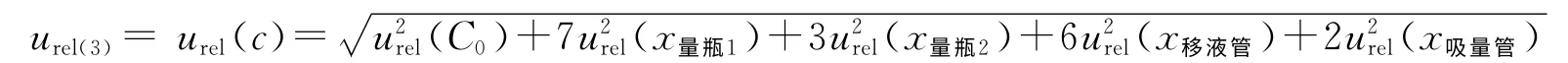
储备液C0配制时的相对标准不确定度已经在天平称量和量瓶定容中引入,因此可以忽略,故:
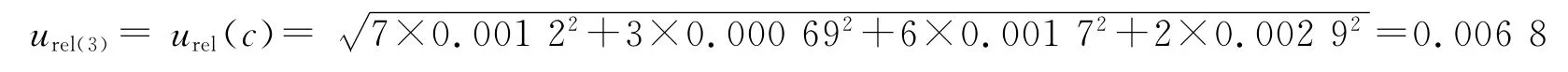
2.9.3 配制标准血浆样本时引入的不确定度 血浆样本是由500μL空白血浆、50μL 头孢替坦二钠标准溶液和50μL内标溶工作液,涡旋混匀而成,不确定度主要由移液器引起。配制血浆标准液所用移液枪为1 mL和200μL,1 mL移液器的最大允许误差为0.012 mL,200μL 移 液 器 的 最 大 允 许 误 差 为0.003 mL。由于温度对定容的影响非常小,忽略不计。移液器的不确定度分别为:
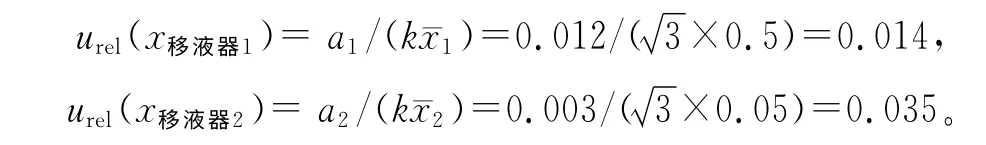
因此,配制血浆溶液时的相对标准不确定度为:
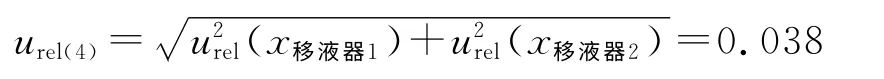
2.9.4 血浆样本处理过程中引入的不确定度 按照“2.3”项方法配制低、中、高3个浓度的质控样本及相应浓度的流动相对照溶液各5份,按“2.4”项处理,提取后的质控样本峰面积与含相同浓度对照溶液峰面积的比值计算相应浓度的提取回收率,结果见表2。
回收率的相对标准不确定度为:
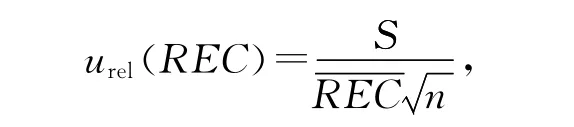
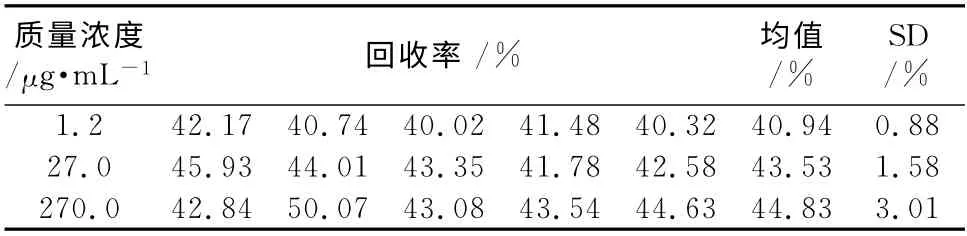
表2 提取回收率Tab 2 Results of recovery
其中S为标准偏差,REC 为回收率均值,n为每组样本数。经计算3个浓度相对标准不确定度分别为:

2.9.5 线性拟和过程引入的不确定度 以待测物浓度(X)为横坐标,待测物与内标的峰面积比值(Y)为纵坐标,采用加权(权重为1/X2)最小二乘法进行线性回归,共拟和3条标准曲线,斜率和截距见表3。
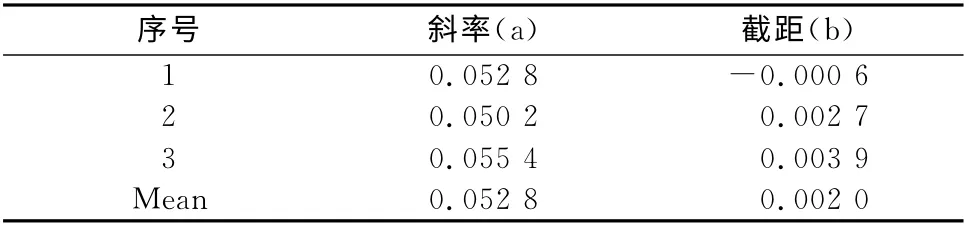
表3 各拟合标准曲线的参数Tab 3 Parameters of the calibration curves
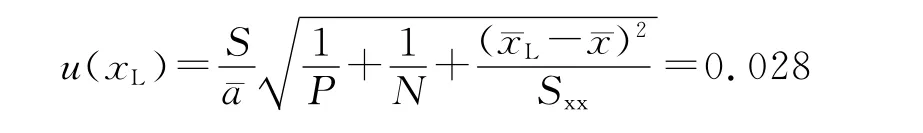
其中P为测定x 的总次数(P=15),N 为测定对标准血浆的总次数(N=3×8=24),a 为标准曲线斜率的均值为标准血浆浓度的均值,xi为第i个标准血浆的实测浓度,其相对标准不确定度为:同法计算中浓度和高浓度相对 标 准 不 确 定 度 分 别 为:urel(6,M)=0.000 97,urel(6,H)=0.000 15
2.9.6 仪器量化不确定度 所用仪器为岛津LC-2010A 型高效液相系统,定量允差为2%,其相对标准不确定度为:
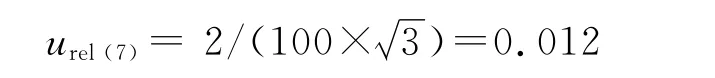
2.9.7 对照品纯度引入的不确定度 头孢替坦二钠纯度大于91%,内标纯度大于99%,纯度标准偏差为1%,按均匀分布:
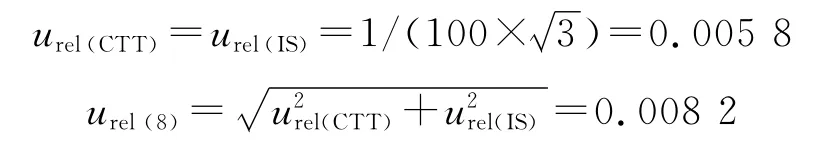
2.10 合成不确定度的评定 头孢替坦二钠浓度测定的相对标准不确定度为:
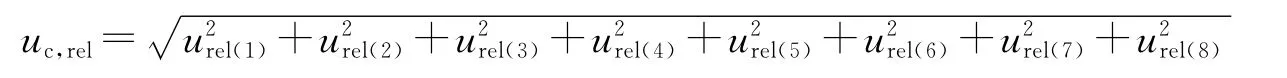
经计算低、中、高浓度的相对标准不确定度分别为:

其标准不确定度分别为:
2.11 扩展不确定度的评定 用简易评定,取k=2,此时对应的置信概率为95%。

血浆中头孢替坦二钠不同浓度质控测定结果可分别表示为:低浓度(1.23±0.12)μg·mL-1,中浓度(27.16±2.50)μg·mL-1,高 浓 度(280.90±28.65)μg·mL-1
3 讨论
血浆中头孢替坦二钠含量的HPLC 法测定过程中,分析各测量不确定度分量,标准血浆样本的配制对低、中、高浓度质控样本不确定度的贡献最大。对于中、高浓度其次是血浆样本处理过程引入的不确定度较大;而低浓度则其次是线性拟合过程引入的不确定。由结果可知,对测定结果产生影响的主要因素为血浆样本的配制和处理,标准曲线的拟合及仪器允差等因素。在实际操作过程中,需着重注意这些影响因素,并采取相应的措施,将测量结果的不确定度进一步减小。
测定过程中涉及到的样品(标准溶液、血浆)均为液态样品,且充分混匀,样品不均匀度很小,故样品不均匀性引入的不确定度非常小,在文中忽略此部分的不确定度。实验环境温度相对恒定(控制在20 ℃左右),温度对于测定结果的影响较小可忽略不计。
不确定度对于优化试验方法和控制实验质量具有重要的意义。生物样本基质成分复杂,处理步骤繁琐,干扰因素较多,不确定度评定较为困难。以上对高效液相色谱法测定血浆中头孢替坦二钠的不确定度进行分析,找出影响不确定度的因素,对不确定度进行评估,给出不确定度,如实反映测量的置信度和准确度,为方法学研究提供有益的指导。
[1] 国家质量技术监督局.测量不确定度评定与表示[S].JJF1059-1999.
[2] 张忠华,陈玟,许美娟,等.LC-MS/MS法测定人血浆中石杉碱甲浓度的不确定度分析[J].中国药房,2011,22(8):3582-3585.
[3] Burns M.Current practice in the assessment and control of measurement uncertainty in bio-analytical chemistry.Trac Trend Anal Chem,2004,23(5):393-398.
[4] 严蓓,杨晨,李扬,等.HPLC 法测定人血浆中奥硝唑浓度的不确定度评定[J].药物分析杂志,2011,31(9):1797-803.
[5] 施昌彦.测量不确定度评定与表示指南[M].北京:中国计量出版社,2005:32
[6] 粟晓黎,李冠民,金少鸿.药品检验一般检测项目不确定度评定研究-1.B类评定[J].药物分析杂志,2005,25(6):699-705.
[7] 杨娟,沈金芳,孙黎,等.HPLC 法测定血浆中法罗培南浓度的不确定度分析[J].中国药师,2011,14(8):1106-1109.
[8] 张现化,杨毅恒,杨丽,等.液质联用法测定人血浆中利培酮浓度的不确定度评定[J].药物分析杂志,2010,30(3):366-371.
[9] Liu YN,Huang JG,Liu JM,et al.A simple and sensitive liquid chromatographic technique for the determination of cefotetan disodium in human plasma and its application in a pharmacokinetic study[J].J Huazhong Univ Sci Technolog Med Sci,2012,32(5):779-784.
