日本蟾蜍聚集素cDNA的克隆与序列分析
2013-12-23袁进强徐跃杨仙玉诸葛慧张姝芳
袁进强 徐跃 杨仙玉 诸葛慧 张姝芳
(浙江农林大学林业与生物技术学院,临安 311300)
聚集素(clusterin,CLU)也称载脂蛋白J,前列腺抑制性睾酮信号-2或硫酸化糖蛋白-2,因其具有聚集细胞的功能而被命名为聚集素[1]。它在人体所有组织中都有表达[2],参与细胞聚集[1]、脂质运输[3]、细胞凋亡[4]、蛋白清理[5]和补体调节[6]等多种生理过程。在人类多种恶性肿瘤中clu基因表达上调,并且与肿瘤发生和转移有密切联系[2]。因此,成为近年来肿瘤治疗的新靶点之一[7-9]。
鉴于蟾酥、蟾衣、蟾皮等中药材广泛应用于临床抗肿瘤治疗[10-12],本研究室开展以日本蟾蜍(Bufo japonicus formosus)皮肤cDNA质粒文库为模板,通过菌落PCR筛选具有完整开放阅读框(open reading frame,ORF)的全长cDNA的工作。本研究筛选到日本蟾蜍clu全长cDNA序列,并运用多种软件对其编码的蛋白质进行生物信息学分析,构建系统进化树,旨在为进一步研究日本蟾蜍CLU蛋白生物学功能及其药物研发奠定基础。
1 材料与方法
1.1 材料
日本蟾蜍皮肤cDNA质粒文库通过材料转让协议。日本产业技术总合研究所(AIST,Tsukuba,Japan)授权浙江农林大学使用(作者杨仙玉在日本AIST博士后工作期间制备)。该文库使用的载体为pSD64TR,上下游克隆位点分别为EcoR I和Xho I,载体上、下游引物为SP6(5'-ATTTAGGTGACACTATAGAA-3')和S.D.A.(5'-TTATGTAGCTTAGAGACTC-3'),cDNA的长度介于500-2 000 bp之间。
大肠埃希菌(E.coli)感受态细胞DH5α、PCR反应试剂盒、2×PCR Master Mix等购自天根生化科技有限公司,DNA Ladder、质粒小量抽提试剂盒购自碧云天生物技术研究所。引物合成与DNA测序委托上海生工生物技术有限公司或上海桑尼生物科技有限公司。
1.2 方法
1.2.1 日本蟾蜍皮肤 cDNA质粒文库转化 将cDNA质粒文库0.2 μL电击转化到E. coli DH5α感受态细胞中(40 μL),然后迅速加入37℃预热的160 μL LB培养液,37℃恒温振荡复苏45 min,取2 μL转化液均匀涂布于LB平板(含Amp 100 μg/mL),并在37℃恒温培养12-15 h。
1.2.2 全长cDNA筛选 从平板上随机挑取单菌落接种于10 μL的LB液体培养基中,以此菌液为模板实施菌落PCR。使用的引物是载体上游引物SP6和自行设计的含ploy(T)的cDNA下游引物(5'-AGATCTCTCGAGTTTTTTTTTTTT-3')。反应体系如下:菌液0.5 μL,2×PCR Master Mix 5 μL,SP6和ploy(T)引物(2 pmol/μL)各1 μL,补加灭菌超纯水至10 μL,在反应体系中补加矿物油10 μL。反应条件为:94℃ 5 min; 94℃ 30 s,50℃ 30 s,72℃ 120 s,30循环; 72℃8 min,4℃保存。PCR结束后,取5 μL PCR产物经1%琼脂糖凝胶电泳分析,将扩增出介于500-2 000 bp之间的PCR产物的菌落确定为阳性。
1.2.3 质粒回收、DNA测序与序列分析 将通过菌落PCR确定为阳性克隆的菌液0.2 μL接种于3.5 mL LB培养液中(含Amp 100 μg/mL),37℃恒温振荡培养12-15 h,然后使用试剂盒进行质粒回收并对其进行EcoR I和Xho I 双酶切鉴定,进一步确定阳性克隆及质粒浓度。首先委托公司将阳性克隆质粒使用载体上游引物(SP6)对cDNA进行正向测序。测序结果利用DNAstar查找cDNA的开放阅读框(open reading frame,ORF),推导氨基酸序列,对具有合理开放阅读框的克隆继续委托公司使用载体下游引物(S.D.A.)进行反向测序。
1.2.4 序列分析 利用DNAstar寻找ORF,推导其编码蛋白的氨基酸序列并分析其理化性质,运用SMART(http://smart.embl-heidelberg.de/)预测其结构功能域,运用CBS的SignalP 4.0(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽,运用CBS的NetNGlyc(http://www.cbs.dtu.dk/services/NetNGlyc/)预测Asn-X-Ser/Thr糖基化位点,运用METAL DETECTOR V2.0(http://cassandra.dsi.unifi.it/)预测二硫键位点,运用NPS的GOR4(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html)预测二级结构,运用ExPASy的COIL(http://www.ch.embnet.org/software/COILS_form.html)预测卷曲螺旋结构,运用ClustalX 2.0和MEGA 4.1软件进行同源性分析,构建系统进化树。
2 结果
2.1 cDNA的筛选
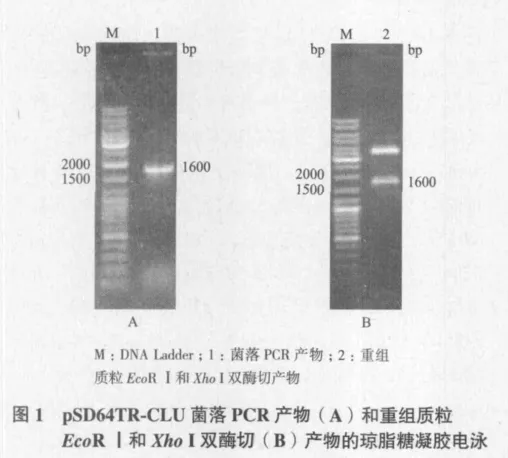
将日本蟾蜍皮肤cDNA质粒文库转化E.coli感受态细胞DH5α获得的菌落,以SP6和ploy(T)为引物,实施菌落PCR。PCR产物经1%琼脂糖凝胶电泳分析显示,有一菌落PCR产物大小在1 600 bp左右(图1-A)。将此菌液进行扩大培养、质粒回收及其EcoR I和 Xho I双酶切和1%琼脂糖凝胶电泳,结果显示该质粒含有1 600 bp左右的cDNA(图1-B)。将此质粒委托DNA测序公司进行了正、反双向测序。
2.2 序列分析
2.2.1测序结果分析及其编码蛋白的理化性质 对测序结果校对并分析确定已克隆的cDNA其全长1 616 bp,具有1 332 bp的完整ORF、5'端30 bp和3'端254 bp的非编码区(untranslated region,UTR),编码由443个氨基酸残基组成的蛋白质。根据推导的氨基酸序列在GenBank blast同源性分析表明,与其他物种的聚集素具有同源性,故将该cDNA克隆定为日本蟾蜍clu全长cDNA(图2)(GenBank登录号为JX035891)。日本蟾蜍clu的ORF推导的氨基酸序列中,正电荷氨基酸残基(K,R)为55个,负电荷氨基酸残基(D,E)为69个,疏水性氨基酸(A,I,L,F,W,V)为141个,极性氨基酸残基(N、C、Q、S、Y)为123个,分子量约为50.627 kD,pI理论值为5.13。

2.2.2 结构预测 SMART预测日本蟾蜍CLU蛋白由两条多肽链组成,这两条多肽链分别与构成聚集素的Cla、Clb家族同源;SignalP4.0预测该前体蛋白含有20个氨基酸残基的信号肽(图2),信号肽裂解位点在20和21氨基酸残基之间,故推测克隆的日本蟾蜍clu cDNA编码分泌蛋白。NetNGlyc预测蛋白中Asn-X-Ser/Thr糖基化位点,发现存在6个天冬酰胺糖基化位点,Asp-99、Asp-141、Asp-273、Asp-350、Asp-370和Asp-415(表1)。METAL DETECTOR预测蛋白二硫键位点,发现存在可形成二硫键的10个半胱氨酸残基,Cys-98、Cys-109、Cys-112、Cys-117、Cys-125、Cys-281、Cys-291、Cys-298、Cys-301和Cys-309(图2)。GOR4和COIL预测蛋白二级结构表明,日本蟾蜍CLU在其两端各形成一个卷曲螺旋(48-97 aa和336-391 aa)(图3)。
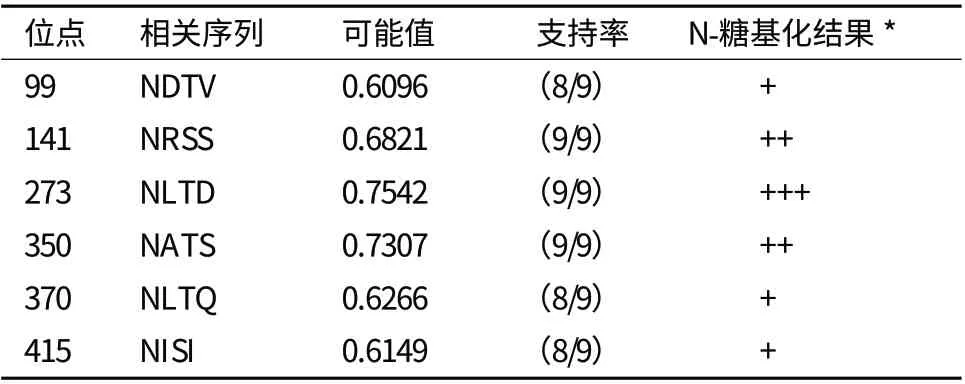
表1 日本蟾蜍CLU中N-糖基化位点预测

图3 NCOILS 分析日本蟾蜍CLU蛋白的卷曲螺旋
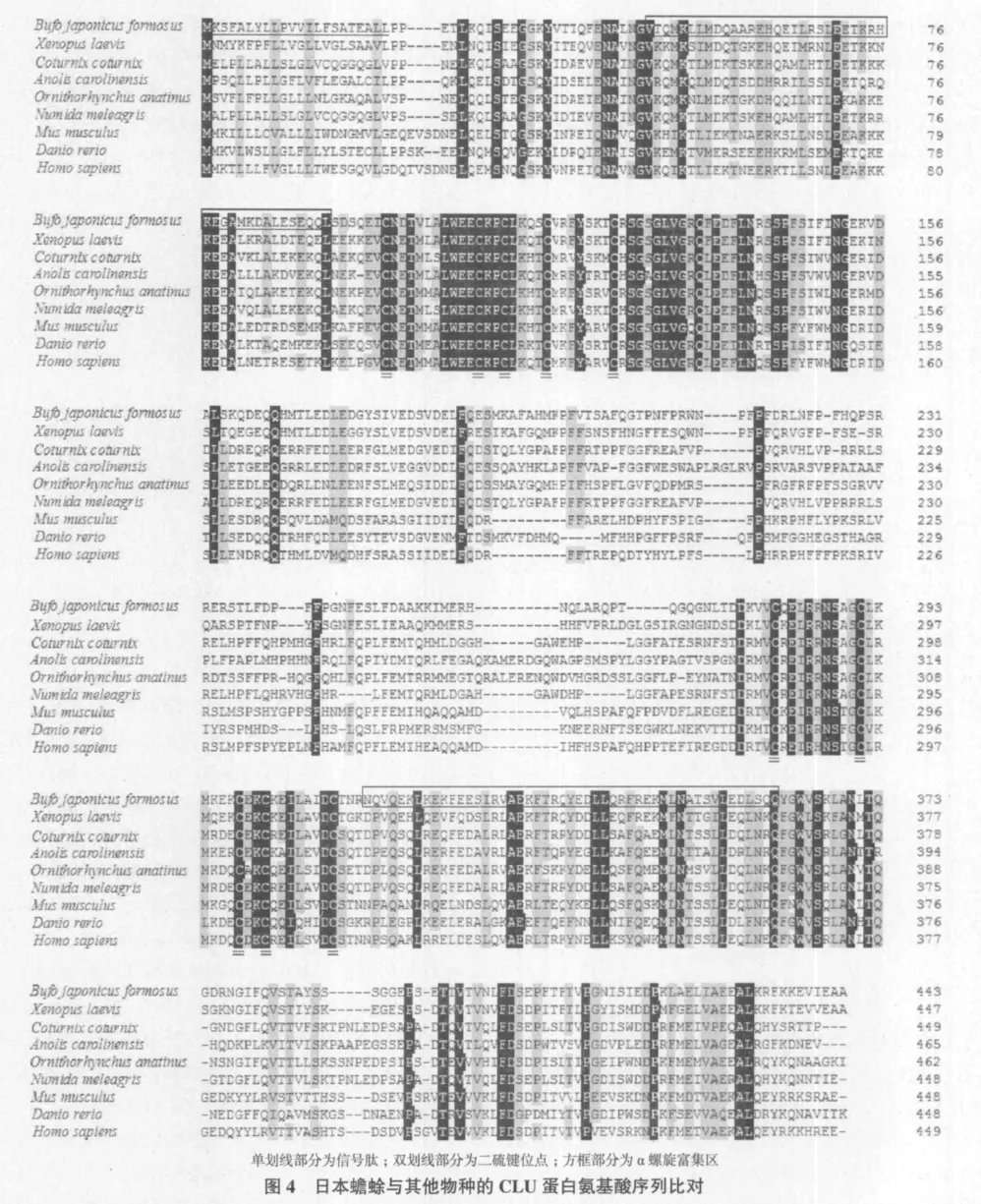
2.2.3 氨基酸序列同源性分析和系统进化树构建 日本蟾蜍CLU蛋白氨基酸序列在NCBI中同源性分析发现,与非洲爪蟾(Xenopus laevis,NP_001080-775.1)的同源性最高,达到65%,与珠鸡(Numida meleagris,AAW21812.1)、斑马鱼(Danio rerio,AAQ56181.1)、安乐蜥(Anolis carolinensis,XP_003229-606.1)、鸭嘴兽(Ornithorhynchus anatin-us,XP_00-1515556.2)、鹌鹑(Coturnix coturnix,CA-A33823.1)、小鼠(Mus musculus,NP_038520.2)、人(Homo sapiens,NP_001822)7种动物的同源性在41%-48%之间。在ClustalX软件中对蟾蜍与8个物种的CLU蛋白氨基酸序列进行比对(图4),发现各物种均含有信号肽序列,但其氨基酸组成和数量有所不同;可形成二硫键10个半胱氨酸残基在不同物种之间完全保守;与人CLU序列比对,发现在C端卷曲螺旋中的357位为Val,其他物种为Leu,358 位的Leu物种之间完全保守,除斑马鱼的361位上为Phe外,其他物种都为Leu;预测N-糖基化位点中Asp-99、Asp-141、Asp-350和Asp-370与其他物种完全保守,而Asp-273和Asp-415不存在保守性,表明CLU存在种属差异。
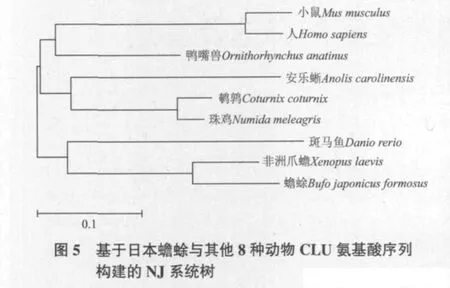
通过MEGA 4.1软件邻接法构建氨基酸序列系统进化树(图5),发现日本蟾蜍与同属两栖类的非洲爪蟾处于一个分支内,与鱼类汇于一个分支。两种鸟类动物与爬行动物汇于一支。哺乳类最低等的鸭嘴兽与其他哺乳动物汇于一支,但与胎生哺乳动物人和鼠存在一定的差异。整个进化树表明CLU的进化史遵循传统动物进化规律。
3 讨论
本试验成功克隆到日本蟾蜍聚集素的全长cDNA,并对该cDNA和其编码蛋白的氨基酸序列进行了生物信息学分析。SignalP分析该前体蛋白存在信号肽,暗示日本蟾蜍clu cDNA编码蛋白为分泌蛋白。结构预测显示日本蟾蜍CLU成熟蛋白是由两条多肽链组成[9,13,14],含有两个卷曲螺旋结构域(48-97 aa和336-391 aa),与人CLU相似。在其C端卷曲螺旋中Val-3578、Leu-358和Leu-361有3个疏水性氨基酸残基,其中后两个氨基酸不同物种间比较保守,Val-357在人类则是Leu-357。此外,日本蟾蜍CLU成熟蛋白中有10个半胱氨酸残基可形成5对二硫键,存在6个潜在的糖基化位点,这些特征在包括人的其他8种动物的CLU中完全保守[16-18]。
已有研究表明,人类分泌型CLU具有抑制线粒体介导的细胞凋亡、保护细胞的功能[19,20],但其作用机制还不十分清楚。目前,在RNA水平上抑制分泌型CLU表达,或使用寡核苷酸药物OGX-011干扰分泌型CLU表达均能增强化学药物对肿瘤细胞的杀伤力和降低肿瘤细胞的耐药性,显示出良好的临床效果[7]。因此,抑制分泌型CLU对肿瘤细胞的保护可能成为治疗肿瘤的新途径,CLU可能成为肿瘤治疗的新靶点。
4 结论
首次克隆到日本蟾蜍clu基因的全长cDNA,该基因编码的蛋白具有与人类同源蛋白相似的结构特征。日本蟾蜍CLU与其他8个物种CLU的氨基酸序列具有相似性。
[1] Fritz IB, Burdzy K, Setchell B, et al. Ramrete testis fluid contains a protein(clusterin)which influences cell-cell interactions in vitro[J]. Biolreprod, 1983, 28(5):1173-1188.
[2] Shannan B, Seifert M, Leskov K, et al. Challenge and promise:roles for clusterin in pathogenesis, progression and therapy of cancer[J]. Cell Death and Differentiation, 2006, 13(1):12-19.
[3] Konstantinos NA, Maria TV, John PC, et al. Circulating clusterin(apolipoprotein j)levels do not have any day/night variability and are positively associated with total and LDL cholesterol levels in young healthy individuals[J]. Clin Endocrinol Metab, 2011, 96(11):E1871-5.
[4] Konstantin SL, Dmitry YK, Jing L, et al. Synthesis and functional analyses of nuclear clusterin, a cell death protein[J]. Biol Chem, 2003, 13(278):11590-11600.
[5] Wyatt AR, Yerbury JJ, Berghofer P, et al. Clusterin facilitates in vivo clearance of extracellular misfolded proteins cell[J]. Cell Mol Life Sci, 2011, 68(23):3919-3931.
[6] Kurosu T, Chaichana P, Yamate M, et al. Secreted complement regulatory protein clusterin interacts with dengue virus nonstructural protein[J]. Biochemical and Biophysical Research Communications, 2007, 362(4):1501-1056.
[7] Chi KN, Hotte SJ, Yu EY, et al. Randomized phase ii study of docetaxel and prednisone with or without ogx-011 in patients with metastatic castration-resistant prostate cancer[J]. Clin Oncol, 2010, 28(27):4247-4254.
[8] Zoubeidi A, Chi K, Gleave M. Targeting the cytoprotective chaperone, clusterin, for treatment of advanced cancer[J]. Clin Cancer Res, 2010, 16(4):1088-1093.
[9] Mahon MG, Lindstedt KA, Hermann M, et al. Multiple involvement of clusterin in chicken ovarian follicle development[J]. Biol Chem, 1999, 274(7):4036-4044.
[10] 张飞春, 孙文革, 高晓玲, 等. 蟾酥乙醇提取物抗肿瘤剂量效应关系实验研究[J]. 药物研究, 2011, 20(16):23-24.
[11] 缪珠雷, 张康, 杨鸣泽, 等. 蟾蜕抗肿瘤及增强免疫效应研究[J]. 中国中药杂志, 2010, 25(2):211-214.
[12] 曾洋, 张爱, 文筱. 干蟾皮的研究进展[J]. 中国医药科学, 2011, 1(15):19-31.
[13] Lars E, Chonn A, Ducrest D, et al. Murine clusterin:molecular cloning and mRNA localization of a gene associated with epithelial differentiation processes during embryogenesis[J]. Cell Biol, 1999, 122(5):1119-1130.
[14] Yang CR, Yeh S, Leskov K, et al. Isolation of Ku70-binding protein(KUBs)[J]. Nucleic Acids Res, 1999, 27(10):2165-2174.
[15] Choi-Miura NH, Takahashi Y, Nakano Y, et al. Identification of the disulfide bonds in human plasma protein SP-40, 40(apolipoprotein-J)[J]. Biochem, 1992, 112(4):557-561.
[16] Stewart EM, Aquilina JA, Easterbrook-Smith SB, et al. Effects of glycosylation on the structure and function of the extracellular chaperone clusterin[J]. Biochemistry, 2007, 46(5):1412-1422.
[17] 赵晓航, 何洪智, 王堃, 等. 食管鳞癌中clusterin 的糖基化修饰和表达定位改变[J]. 第二军医大学学报, 2005, 26(12):1333-1336.
[18] Comunale MA, Wang MJ, Rodemich-Betesh L, et al. Novel changes in glycosylation of serum Apo-J in patients with hepatocellular carcinoma[J]. Cancer Epidemiology Biomarkers and Prevention, 2011, 20(6):1222-1229.
[19] Ammar H, Closset JL. Clusterin activates survival through the phosphatidylinositol 3-kinase/Akt pathway[J]. Biochem, 2008, 283(19):12851-12861.
[20] Trougakos IP, Lourda M, Antonelou MH, et al. Intracellular clusterin inhibits mitochondrial apoptosis by suppressing p53-activating stress signals and stabilizing the cytosolic Ku70-Bax protein complex[J]. Clin Cancer Res, 2009, 15(1):48-59.
