大豆根部两株产植酸酶菌的分离鉴定及中性植酸酶基因的克隆
2013-12-23姚明泽卢文亮张耀华梁爱华
姚明泽,卢文亮,张耀华,梁爱华*
(山西大学生物技术研究所,化学生物学与分子工程教育部重点实验室,山西 太原 030006)
植酸酶是催化植酸及其盐类水解成肌醇和磷酸的一类酶的总称,可降低饲料中植酸的抗营养作用,提高单胃动物磷的吸收率,降低磷的污染,目前在食品特别是饲料领域得到了广泛的应用[1-2]。植酸酶广泛存在于自然界的动物、植物和微生物组织中。按照三维结构和生化特点的不同,目前植酸酶可以分为三大类:组氨酸酸性磷酸酶植酸酶(histidine acid phosphatases,HAPs)、β-螺旋桨植酸酶(β-propeller phytases,BPPs)、半胱氨酸磷酸酶植酸酶或紫色酸性磷酸酶植酸酶(purple acid phosphatases,PAPs)[3-4]。其中,BPPs有时也被称为β-折叠桶磷酸酶或中性植酸酶。BPPs主要来源于芽孢杆菌。芽孢杆菌生产植酸酶可以促进农作物和植物根部吸收无机磷或植酸,而被称作“植物生长促进细菌”(PGPR),如解淀粉芽孢杆菌[5]。从作物根部分离产植酸酶的芽孢杆菌,从而获得中性植酸酶基因,开展植酸酶的研究是目前研究植酸酶的一种途径[6]。
目前,对β-螺旋桨植酸酶研究数据还比较少,然而β-螺旋桨植酸酶可能是自然界中分布最广的一类植酸酶,在水产动物养殖中有良好应用前景[7]。为了获得新的产β-螺旋桨植酸酶菌株,并开展中性植酸酶结构与功能的研究,本研究从大豆根部土壤微生物中进行筛选,获得两株产植酸酶的芽孢杆菌,并对其进行16S rRNA鉴定。对其酶学性质进行初步研究,通过PCR技术获得2株芽孢杆菌植酸酶基因的完整开放阅读框,并对其进行生物信息学分析。为进一步探讨中性植酸酶的结构与功能以及植酸酶的产业化应用提供数据。
1 材料与方法
1.1 菌种
土样取自山西运城植物大豆根际距地表0.5cm的土壤,利用活性检测方法分离得到两株芽孢杆菌,用于克隆的大肠肝菌菌株E.coli DH5α保存在本实验室。
1.2 试剂
Taq酶、pMD-18T、DNA Marker(DL2000) 日本TaKaRa公司;胶回收试剂盒、细菌基因组提取试剂盒 美国Biomiga公司;植酸钙 东京化成工业公司;植酸钠 美国Promega公司;酵母表达载体pPIC9 本实验室保存;其他试剂都为国产分析纯。
1.3 培养基
LB培养基(g/L):琼脂15、蛋白胨10、酵母提取物5、NaCl 10,pH 7.4;LPM 液体培养基:NaCl 5、葡萄糖4、CaCl23.34、MgSO41.72、MgCl21.62、酪蛋白胨1、KCl 0.54、谷氨酸0.5、大豆蛋白胨0.45,pH 7.0;PSM固体培养基(g/L)[8]:葡萄糖20、植酸钙2、NH4NO35、KCl 0.5、CaCl22、MgSO4·7H2O 0.5、MnSO4·4H2O 0.01、FeSO4·7H2O 0.01、琼脂糖15,pH 7.0。
1.4 方法
1.4.1 土壤中产植酸酶芽孢杆菌筛选与16S rRNA鉴定
将从不同地方采集的土样各1g分别溶于10mL的灭菌蒸馏水中,充分振荡后置于85℃的水浴锅内加热15min,静置过夜放大培养,取该培养液0.5mL涂布LB固体培养基,30℃培养箱培养过夜,挑取菌落转接于PSM固体培养基,30℃培养2~3d,挑取产生透明圈的菌落。
16S rRNA鉴定:用细菌基因组提取试剂盒提取所要鉴定细菌基因组,设计一对特异性引物Forward primer 8~27F:5’-AGAGTTTGATCCTGGCTCAG-3’,Reverse primer 1492R:5’-GGTTACCTTGTTACGACTT-3’进行PCR扩增,反应参数为:94℃、45s;52℃、45s;72℃、1min,共进行30个循环。扩增产物采用1%的琼脂糖凝胶电泳检测,并使用胶回收试剂盒回收纯化。最后,纯化回收产物送生工生物工程(上海)有限公司进行测序。
1.4.2 菌株粗酶液酶活力的测定
将100mL发酵产物12000r/min离心10min,取出上清获得粗酶液进行酶学性质研究。取 0.2mL上清粗酶液,加入0.8mL 6.25mmol/L的植酸钠(用含1mmol/L CaCl2的0.1mmol/L Tris-HCl (pH7.0)配制),37℃保温15min,加入1mL 5% TCA终止酶活反应,然后加入1mL硫酸亚铁-钼酸铵显色液,700nm波长处测定吸光度以计算出无机磷含量。对照为先在0.2mL的粗酶液中加入1mL TCA使酶灭活,再加入同体积的底物保温。酶活力单位(U)定义为:在一定条件下,每分钟释放出1μmol无机磷所需的酶量为一个酶活性单位。所有酶活测定数据重复3次。
1.4.3 菌株粗酶液酶学性质
1.4.3.1 酶的最适反应pH值
粗酶液在37℃、不同的pH值条件下进行酶促反应测定其最适pH值。底物植酸钠用不同pH值的含1mmol/L CaCl2的0.2mmol/L缓冲液配制(pH4.0、5.0为HAc-NaAc缓冲液;pH 6.0、7.0、8.0为Tris-HCl缓冲液)。
1.4.3.2 酶的最适反应温度
粗酶液在 Tris-HCl(pH 7.0)含1mmol/L CaCl2缓冲液体系及不同温度(30、35、40、45、50、55、60、65、70、75、80℃)下进行酶促反应。
1.4.3.3 Ca2+对酶活性的影响
粗酶液在Tris-HCl(pH7.0)中0.03mmol/L和1mmol/L CaCl2浓度条件下分别在60℃与65℃进行酶促反应测定。
1.4.4 菌生长密度和相对产酶量的关系
分别挑取两株菌的单克隆到5mL LB培养基中30℃过夜培养,按照0.5%转接到100mL LPM培养基中表达。每12h取培养液测定酶活和OD600nm值。
1.4.5 植酸酶基因的扩增
中性植酸酶序列的扩增:使用细菌基因组提取试剂盒,对所筛选出的两株芽孢杆菌进行基因组DNA提取。根据GenBank报道的Bacillus的序列,参考已报道[6]芽孢杆菌基因起始密码子和终止密码子两侧序列,设计引物:F-up:5’-AGTGATAAAAGAGGAGG-3’,R-down:5’-GCTGCACAAGCTGCTTTC-3’,由生工生物工程(上海)有限公司合成。以提取的基因组为模板,采用PCR技术扩增中性植酸酶基因开放阅读框。反应参数为:94℃、45s,47℃、45s,72℃、1min,共进行30个循环。扩增产物使用胶回收试剂盒回收纯化。将4μL回收纯化产物与1μL pMD-18T克隆载体反应体系中加5μL SolutionⅠ过夜连接。连接产物转化大肠杆菌DH5α,提取质粒并送生工生物工程(上海)有限公司进行测序。
1.4.6 SWISS-MODEL对Phy(ycD)和 Phy(ycE)建模分析
去除了信号肽的Phy(ycD)和Phy(ycE)运用SWISSMODEL服务器(http://swissmodel.expasy.org/)同源建模,采用晶体结构(PDB DOI:10.2210)为模板。运用软件Spdbv对同源模型的4个不同氨基酸位点进行分析。
2 结果与分析
2.1 产植酸酶菌株的筛选与16S rRNA鉴定结果
挑取分离得到的单菌落,在液体培养基30℃过夜培养后,在含有植酸钙的PSM固体培养基上划线,可以明显看到在菌落的附近有水解圈的产生(图1)。并且通过镜检观察到细菌芽孢为无色,椭圆形,芽孢位置居中或端生,菌体为红紫色。可以确定经培养得到的微生物是芽孢杆菌[9]。16S rRNA测序结果为1200bp左右,与GenBank已报道的序列进行比较,发现与枯草芽孢杆菌的16S核苷酸同源性为100%,因此认为分离的两株细菌为枯草芽孢杆菌。分别命名为Bacillus sp. YCD、YCE。

图 1 芽孢杆菌YCD(a)和YCE(b)在PSM培养基上生长产生水解圈Fig.1 Transparent circles of the Bacillus subtilis isoaltes on PSM
2.2 菌株粗酶液酶学性质的初步测定
2.2.1 酶的最适反应pH值
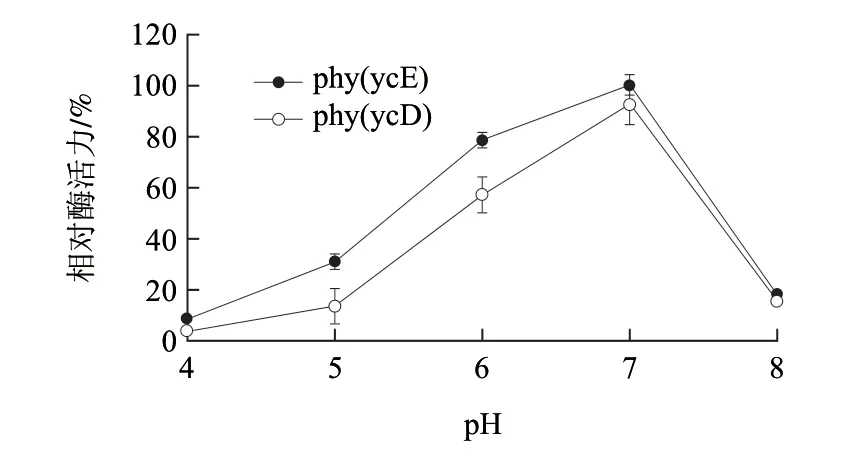
图 2 粗酶液中植酸酶的最适pH值Fig.2 Optimal pH of phytase in cell lysate
在37℃不同pH值的缓冲液中对两株芽孢杆菌粗酶液进行酶活测定,由图2可知,phy(ycD)、phy(ycE)最适pH值都在7.0左右,而当pH 4.5时,残余酶活力不到10%。与以往报道[6]的芽孢杆菌植酸酶相比残余酶活力低,推测是因为芽孢杆菌表达粗酶液中植酸酶的含量低的缘故。
2.2.2 酶的最适反应温度

图 3 粗酶液中植酸酶的最适温度Fig.3 Optimal temperature of phytase in cell lysate
在不同温度下测定其酶活,由图3可知,60℃时,phy(ycD)、phy(ycE)植酸酶酶活力达到最大,phy(ycE)相对酶活力高于phy(ycD)的酶活力。
2.2.3 Ca2+对表达产物酶活性的影响

图 4 Ca2+对酶活性的影响Fig.4 Effects of Ca2+ on phytase activity
以前有文献报道[10-12]来源于Bacillus subtilis的植酸酶,有Ca2+依赖性,在含有不同Ca2+浓度的缓冲液中,在60℃对2株芽孢杆菌植酸酶活性进行测定,由图4可知,含有1mmol/L Ca2+的缓冲液测定的相对酶活力明显高于含有0.03mmol/L Ca2+的缓冲液测定的值。表明分离的这2株菌株的植酸酶酶学性质受Ca2+的影响。
2.3 菌生长密度和相对产酶量的关系
为了研究菌生长密度和产酶量之间的关系,将2株芽孢杆菌转接到LPM培养基中表达,由图5可知,约20h后两株芽孢杆菌生长密度达到最大,Bacillus sp. YCE的OD600nm值大于Bacillus sp.YCD的OD600nm值。随着时间的增长酶的表达量不断增长,到达120h时,Bacillus sp. YCE的表达量不再升高,而Bacillus sp.YCD的表达量还有升高趋势。可能是随着时间的推移,由于营养物质消耗,次生代谢产物增多,菌已不再增长,但是还在向培养液中分泌植酸酶。
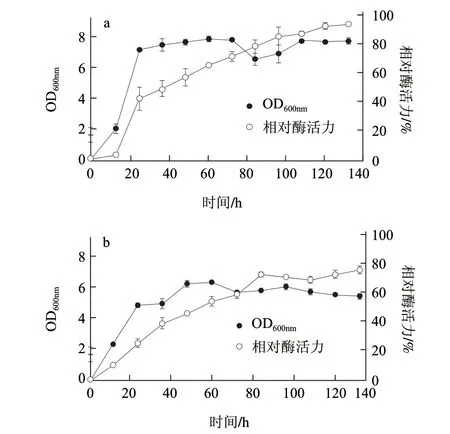
图 5 芽孢杆菌菌体YCE(a)和YCD(b)生长与相对产酶量Fig.5 Growth curve and phytase yield of Bacillus sp.YCD and Bacillus sp.YCE
2.4 植酸酶基因的扩增

图 6 植酸酶基因phy(ycD)和phy(ycE) PCR扩增产物Fig.6 Electrophoresis of PCR products of phy(ycE) and phy(ycD)
分别以分离得到的两株Bacillus subtilis基因组DNA为模板,进行 PCR扩增目的基因。PCR的扩增产物电泳结果见图6。PCR 产物为1.1kb的单一条带,片段大小与预期相符合。序列分析表明,从2个菌株中获得的序列不完全相同,分别命名为phy(ycD)和phy(ycE)。其中phy(ycE)序列已提交GenBank(序列登录号为JQ257502),所产植酸酶属于中性植酸酶。根据Signal P3.0信号肽预测软件分析,N端的26个氨基酸为信号肽,信号肽的切割位点在+26位的Ala之后。
phy(ycD)和phy(ycE)核苷酸序列一致性为98%,氨基酸序列上有5个氨基酸不同。phy(ycE)与基因库中已登录的中性植酸酶基因(DQ346196.1、DQ346195.1、EF536824.1)的核苷酸序列一致性在90%以上,但是通过氨基酸序列分析发现已报道的这3个中性植酸酶3个位点(S161、A344、E363)完全相同,而与本实验分离的phy(ycE)不同,phy(ycE)中这3个位点分别为(G161、T344、G363)。特别是363这个位点由酸性氨基酸谷氨酸变为甘氨酸,这可能会造成酶学性质差异。而phy(ycD)与基因库中已登录的中性植酸酶基因的序列最高同源性达到100%。
2.5 phy(ycD)、phy(ycE)同源建模分析
从大豆根部分离2株芽孢杆菌菌株,克隆出2个中性植酸酶基因phy(ycD)、phy(ycE),成熟蛋白有4个氨基酸不同,酶学性质也有差异,4个氨基酸造成了酶学性质的差异,通过同源建模,Spdbv软件分析,4个氨基酸(phy(ycD)/147N、161S、344A、363E,phy(ycE)/147K、161G、344T、363G)位所处的二级结构位置都不同,如图7中方框所示,依次分别位于酶分子的“Loop”结构,酶分子内部β-折叠片层结构,反向的β-折叠片层结构,以及α-螺旋结构的末尾。图中红色圆点代表Ca2+。

图 7 植酸酶phy(ycD)、phy(ycE)的同源建模Fig.7 Homology structure modeling and analysis of phytase phy(ycD) and phy(ycE)
3 讨 论
芽孢杆菌是土壤和植物微生态的优势微生物种群之一,具有很强的抗逆能力和抑菌防病增产作用。有报道称很多细菌生长在植物根部帮助植物吸收营养物质,其中许多芽孢杆菌能产中性植酸酶[5,13-14]。来源于其他微生物的中性植酸酶也有报道,如Janthinobacterium sp.[15]。芽孢杆菌植酸酶有高的热稳定性,最适pH值接近中性约在7.0~8.0之间。
本研究从运城大豆根部土壤分离出2株产植酸酶芽孢杆菌,并且克隆出2个中性植酸酶基因,从编码中性植酸酶的结构基因来看,它们与以往分离到的酸性植酸酶基因均无同源性,这2个中性植酸酶基因phy(ycD)和phy(ycE)核苷酸序列一致性为98%,氨基酸序列上有5个不同,其中1个位于信号肽内,另外4个位于成熟肽中,而第147位的氨基酸处在“Loop”结构上,它附近有个Ca2+,此Ca2+结合在酶分子的低亲和位点,并且与底物的结合有关[16-17],可能对酶学性质的影响比较大。Goward等[18]通过研究发现来源于大肠杆菌的苹果酸脱氢酶“Loop”结构处于酶分子的活性中心附近,把“Loop”结构上的精氨酸突变为谷氨酸提高了酶的热稳定性。第363位上的氨基酸分别为甘氨酸和谷氨酸,由于氨基酸性质的不同可能也造成了酶学性质的不同。通过NCBI检索与已报道的植酸酶核苷酸和氨基酸序列比对分析,phy(ycD)和 phy(ycE)与来源于枯草芽孢杆菌的phyC[19],解淀粉芽孢杆菌FZB45的 phy[5],核苷酸序列一致性为68%。在氨基酸序列上,与phyC和phy的一致性约为71%,而与Huang Huoqing等[20]从冰河土分离的Pedobacter nyackensis MJ11 CGMCC 2503菌株产生的中性植酸酶氨基酸一致性仅仅约为21%。对中性植酸酶酶学性质研究也有很多报道,如Rao等[6]对来源于芽孢杆菌的植酸酶在大肠杆菌中进行表达,表达的酶大多以包含体的形式存在,在含有一定浓度的脯氨酸的情况下,通过变复性实验,获得有活性的酶分子,进行酶学性质实验,发现在pH5.0~8.0,温度25~70℃都有活性,Ca2+对酶的再折叠和活性是必需的。Gulati等[13]从豆科植物根部土壤筛选出可以生产中性植酸酶的1株乳酸芽孢杆菌,并且对植酸酶进行纯化,酶学性质研究,发现最适温度为70℃,最适pH值范围在7~8之间,Ca2+可以提高它的热稳定性。姚斌等[21]利用大肠杆菌表达来源于枯草芽孢杆菌的中性植酸酶,经过纯化对其性质研究,在37℃最适pH值为7.5,55℃条件下pH值为7.0;最适温度55℃。本研究通过植酸钙固体筛选培养基PSM从毛豆根部筛选出2株产中性植酸酶芽孢杆菌,进一步通过LPM液体产酶培养基对酶学性质进行研究,由于表达宿主就是原始芽孢杆菌,酶的表达量低,通过SDS-PAGE未能检测出来,但能够测到酶的活性。对酶学性质进行初步研究,发现37℃条件下,Phy(ycD)和Phy(ycE)最适pH值为7.0。属于中性植酸酶。最适温度约为60℃,并且Ca2+对其酶学性质有影响。从酶学性质比较可以确定,本实验分离的这2种菌株所产的植酸酶属于β-螺旋桨植酸酶家族。目前,已将这两个植酸酶分别在大肠杆菌中进行了表达,通过SDS-PAGE检测到与预期分子质量大小一致的蛋白表达条带。下一步实验计划是对在大肠杆菌中表达的重组Phy(ycD)、Phy(ycE)植酸酶进行纯化,对酶进行定量,然后对这两种酶的性质和结构进行系统研究,探讨结构与功能的关系。同时尝试在真核宿主细胞中表达该植酸酶,通过基因改造提高表达产量和酶的活性,为中性植酸酶的进一步开发应用提供实验数据。
[1] REDDY N R, SATHE S K, SALUNKHE D K. Phytates in legumes and cereals[J]. Advances in Food Research, 1982, 28: 1-92.
[2] BOHN L, MEYER A S, RASMUSSEN S K. Phytate: impact on environment and human nutrition. A challenge for molecular breeding[J]. Journal of Zhejiang University Science B, 2008, 9(3): 165-191.
[3] MULLANEY E J, ULLAH A H. The term phytase comprises several different classes of enzymes[J]. Biochemical and Biophysical Research Communications, 2003, 312(1): 179-184.
[4] OH B C, CHOI W C, PARK S, et al. Biochemical properties and substrate specificities of alkaline and histidine acid phytases[J]. Applied Microbiology and Biotechnology, 2004, 63(4): 362-372.
[5] IDRISS E E, MAKAREWICZ O, FAROUK A, et al. Extracellular phytase activity of Bacillus amyloliquefaciens FZB45 contributes to its plant-growth-promoting effect[J]. Microbiology, 2002, 148(Pt 7): 2097-2109.
[6] RAO D E, RAO K V, REDDY V D. Cloning and expression of Bacillus phytase gene (phy) in Escherichia coli and recovery of active enzyme from the inclusion bodies[J]. Journal of Applied Microbiology, 2008, 105(4): 1128-1137.
[7] 丁强, 杨培龙, 黄火清, 等. 植酸酶发展现状和研究趋势[J]. 中国农业科技导报, 2010, 12(3): 27-33.
[8] MAKAREWICZ O, DUBRAC S, MSADEK T, et al. Dual role of the PhoP approximately P response regulator: Bacillus amyloliquefaciens FZB45 phytase gene transcription is directed by positive and negative interactions with the phyC promoter[J]. Journal of Bacteriology, 2006, 188(19): 6953-6965.
[9] 宋大新, 范长胜, 徐德强, 等. 微生物实验教程[M]. 上海: 复旦大学出版社, 1989: 79-103.
[10] OH B C, CHANG B S, PARK K H, et al. Calcium-dependent catalytic activity of a novel phytase from Bacillus amyloliquefaciens DS11[J]. Biochemistry, 2001, 40(32): 9669-9676.
[11] KEROVUO J, LAPPALAINEN I, REINIKAINEN T. The metal dependence of Bacillus subtilis phytase[J]. Biochemical and Biophysical Research Communications, 2000, 268(2): 365-369.
[12] TRAN T T, HASHIM S O, GABER Y, et al. Thermostable alkaline phytase from Bacillus sp. MD2: effect of divalent metals on activity and stability[J]. Journal of Inorganic Biochemistry, 2011, 105(7): 1000-1007.
[13] GULATI H K, CHADHA B S, SAINI H S. Production and characterization of thermostable alkaline phytase from Bacillus laevolacticus isolated from rhizosphere soil[J]. Journal of Industrial Microbiology & Biotechnology, 2007, 34(1): 91-98.
[14] HU Y, WANG H N, WU Q, et al. Enzymological properties of a phytase from Bacillus subtilis WHNB 02[J]. J Southwest Agric Univ, 2005, 27(6): 770-773.
[15] ZHANG R, YANG P, HUANG H, et al. Molecular and biochemical characterization of a new alkaline beta-propeller phytase from the insect symbiotic bacterium Janthinobacterium sp. TN115[J]. Applied Microbiology and Biotechnology, 2011, 92(2): 317-325.
[16] SHIN S, HA N, OH B, et al. Enzyme mechanism and catalytic property of beta propeller phytase[J]. Structure, 2001, 9(9): 851-858.
[17] HA N, OH B, SHIN S, et al. Crystal structures of a novel, thermostable phytase in partially and fully calcium-loaded states[J]. Nature Structural Biology, 2000, 7(2): 147-153.
[18] GOWARD C R, MILLER J, NICHOLLS D J, et al. A single amino acid mutation enhances the thermal stability of Escherichia coli malate dehydrogenase[J]. European Journal of Biochemistry, 1994, 224(1): 249-255.
[19] KEROVUO J, LAURAEUS M, NURMINEN P, et al. Isolation, characterization, molecular gene cloning, and sequencing of a novel phytase from Bacillus subtilis[J]. Applied and Environmental Microbiology, 1998, 64(6): 2079-2085.
[20] HUANG Huoqing, SHAO Na, WANG Yaru, et al. A novel betapropeller phytase from Pedobacter nyackensis MJ11 CGMCC 2503 with potential as an aquatic feed additive[J]. Applied Microbiology and Biotechnology, 2009, 83(2): 249-259.
[21] 姚斌, 袁铁铮, 王元火, 等. 来源于Bacillus subtilis的中性植酸酶基因的克隆及在大肠杆菌中的表达[J]. 生物工程学报, 2001(1): 11-15.
