壳聚糖修饰的PLGA纳米颗粒固定化碱性磷酸单酯酶的技术研究
2013-12-23高启禹李宏彬陈红丽孔雨周晨妍
高启禹 李宏彬 陈红丽 孔雨 周晨妍
(1.河南新乡医学院生命科学技术学院 河南省遗传性疾病与分子靶向药物重点实验室培育基地,新乡 453003;2.河南新乡医学院公共卫生学院,新乡 453003;3.河南师范大学生命科学学院,新乡 453003)
碱性磷酸单酯酶(Alkaline phosphatase,AKP,EC3.1.3.1)是一种能催化各种磷酸单酯水解释放出无机磷的酶,通常以前体的形式广泛存在于原核及真核生物的外周胞质中,最终在膜通道中形成成熟的碱性磷酸单酯酶[1]。该酶是一种非特异性的水解酶,能水解赖氨酸、精氨酸等碱性氨基酸组成的肽键、酰胺键及酯键等[2]。作为一种膜结合蛋白,一般可从小牛、猪和鸡等动物的肠粘膜上提取[3],但由于从动物体所获得的目的蛋白在稳定性、材料来源及分离纯化上存在严重的缺陷,因此影响着AKP在DNA体外重组及化妆品等领域的广泛应用。同时作为分离获得的游离酶,在保质期、重复利用率、应用成本及稳定性上往往无法满足生产需要。因此选用一定的固定化材料对游离酶进行固定,可有效改善酶的应用范围及应用价值。目前纳米材料已成为酶固定化新型载体研究的热点,已在酶的固定化研究中得到了广泛的探讨[4,5]。壳聚糖修饰的乳酸-羟基乙醇酸共聚物(PLGA)作为纳米材料,能够体现纳米载体良好的生物相容性、较大的比表面积、较小的颗粒直径、较小的扩散限制、有效提高载酶量及在溶液中能稳定存在等优点[6]。
本研究在重组大肠杆菌碱性磷酸单酯酶基因的克隆、表达及纯化的基础上,通过合成的壳聚糖-PLGA纳米材料为载体,对碱性磷酸单酯酶进行了固定,同时采用戊二醛为交联剂,优化AKP的固定化条件,探讨固定化酶与游离酶的酶学特性,旨在为该酶的进一步应用提供参考。
1 材料与方法
1.1 材料
PLGA(M=10 000-30 000,乳酸与羟基乙醇酸的摩尔比为50∶50,山东省医疗器械研究所),壳聚糖(低分子量,脱乙酰度85%,Sigma公司),重组大肠杆菌phoA(由华东理工大学分子生物学实验室提供),Sephadex G-75、DEAE-纤维素(北京鼎国生物技术有限公司),谷胱苷肽(氧化型、还原型)、尿素、琼脂糖、戊二醛等试剂采购于国药集团化学试剂有限公司。
1.2 方法
1.2.1 CS-PLGA纳米粒的制备 采用超声乳化法制备纳米粒,见参考文献[7,8]。
1.2.2 碱性磷酸单酯酶的分离与纯化 将含有外源基因的重组菌培养后收集培养液,4 000 r/min,常温离心20 min后收集菌体并超声破碎,将破碎液在4℃、12 000 r/min下离心20 min,弃上清液,在沉淀中加入6 mL去离子水,搅拌后于4℃、12 000 r/min下离心20 min,重复洗涤后保留沉淀。在沉淀中加入1 mL溶解液(8 mol/L尿素),搅拌并于4℃冰箱放置溶解2 h。其后在4℃、12 000 r/min下再离心20 min,得上清液。在冰浴条件下缓慢加入复性液(0.01 mol/L pH8.0 Tris-HCl缓冲液+1 mmol/L氧化型谷胱苷肽+1 mmol/L还原型谷胱苷肽的混合液+1 mmol/L MgCl2+0.16 mol/L尿素),同时用玻棒轻轻搅匀后置于冰箱复性48 h,测活。
将粗酶液采用DEAE-纤维素凝胶及Sephadex G-75凝胶层析后洗脱、浓缩、透析,获得纯化的碱性磷酸单酯酶液。
1.2.3 标准曲线的建立 标准曲线的建立见参考文献[9]。在405 nm处测吸光值,得标准曲线,其线性回归方程为:y=1.242 9x-0.054 3,R2=0.991 8。结果表明对硝基苯酚在此浓度范围内与吸光度呈良好的线性关系,可以用于酶活力的测定。
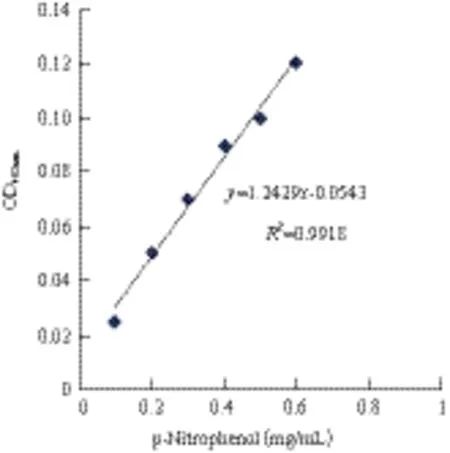
图1 对硝基苯酚标准曲线
1.2.4 碱性磷酸单酯酶酶活测定 以对硝基酚磷酸二钠为底物,根据水解磷酯键所产生的对硝基酚量测定酶活力。在37℃、pH10.0条件下,每分钟转化产生1 μmol/L对硝基酚的酶量为1个酶单位。具体为:分别在试管中加入250 μL、0.02 mol/L对硝基酚磷酸二钠及750 μL Na2CO3-NaHCO3(pH10.0,0.1 mol/L)的底物缓冲液,混匀,在水浴37℃预热5 min,加入250 μL酶液(空白对照管用缓冲液替代),立即混匀后,37℃保温反应20 min。立即加入0.5 mL 0.5 mol/L NaOH溶液终止反应,于分光光度计中测定A405值。固定化酶活力测定时用一定量的固定化酶替换原酶液并用缓冲液定容,测定相应吸光值并确定相对酶活力。
相对酶活力:以同组试验中酶活最高点的值记为100,相对酶活为其他试验点酶活值与该值之比。
固定化酶活力回收率(%)=固定化酶活力/投入的游离酶活力×100%
1.2.5 碱性磷酸单酯酶的固定化 取50 mg CS-PLGA纳米粒,加入1 mL Tris-HCl缓冲液(0.05 mol/L,pH7.6)充分搅拌后超声15 min。再加入10 mL分离纯化的酶溶液,在4℃搅拌吸附2 h后用4%的戊二醛溶液交联1.5 h。再于4℃下固定10 h,离心弃去上清液,再用缓冲液洗去固定化酶表面游离酶后得固定化酶,4℃保存备用。
1.2.6 正交试验数据处理方法 依据单因素试验结论,进行正交试验设计,优化碱性磷酸单酯酶的固定化条件。
2 结果
2.1 纳米材料的电镜扫描分析
纳米粒的扫描电镜显示(图1),未被壳聚糖修饰的PLGA纳米粒球状形态较规则(图1-A),相互间结合度较小,而被修饰的纳米材料结合较紧密(图1-B),说明PLGA纳米粒表面被壳聚糖进行了有效修饰。

图1 纳米粒子的电镜扫描
2.2 突变酶的表达及纯化
SDS-PAGE分析(图2)表明,重组大肠杆菌中碱性磷酸单酯酶得到了高效表达,同时经凝胶层析后获得了纯度较高的酶液,其分子量介于43-66.2 kD之间,与AKP的理论分子量约50 kD相符合。
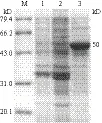
图2 SDS-PAGE分析凝胶层析产物
2.3 单因素试验结果
设定固定化方法中其他影响因子不变,以选择的影响因素为研究对象,探讨在单因素条件下固定化酶的相对酶活力。
2.3.1 CS-PLGA纳米粒的质量分数对固化酶活力的影响 由图3可知,CS-PLGA纳米颗粒的质量分数对固定化酶的活力有一定的影响,当质量分数浓度高于50 mg时,固定化酶的相对活力有所下降,可能较高浓度的载体在扩散限制、有效载酶量等方面影响酶促反应的进行。
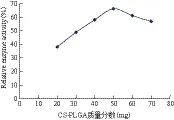
图3 CS-PLGA纳米粒质量浓度对固定化酶活力的影响
2.3.2 戊二醛体积分数对固化酶活力的影响 采用双功能试剂戊二醛进行交联固定对酶的固定化效果具有重要影响。图4表明,在戊二醛浓度较低时,酶的结合量少,因而固定化酶活性较低。但当戊二醛浓度过高时,过多的戊二醛与酶结合,使酶的空间刚性增加,柔性降低,从而影响酶与底物的结合,其适宜的戊二醛浓度约为4%。
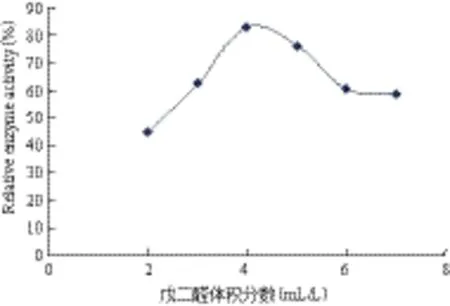
图4 戊二醛体积分数对固定化酶活力的影响
2.3.3 交联时间对固定化酶活力的影响 由图5可知,固定化碱性磷酸单酯酶的活力在交联时间1.5 h时最高。主要是由于低于1.5 h时,戊二醛和酶蛋白的结合不完全,而高于1.5 h时,过多的醛基对酶分子本身进行了相应的修饰,致使固定化酶活力降低。
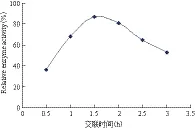
图5 交联时间对固定化酶活力的影响
2.3.4 固定化时间对固定化酶活力的影响 由图6可以看出,固定化酶的活力受固定化时间的影响。在固定化时间为10 h 时,固定化酶的活力达到最大值。同时由于酶与载体的结合需要相应的时间,因此固定化初期其酶活较低,但在达到最大值后,延长固定化时间会导致酶交联程度过高,形成的载体结构对酶的结合能力降低,从而影响到酶促反应的速率。
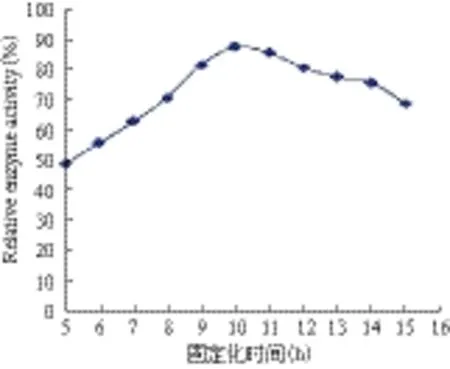
图6 固定化时间对固定化酶活力的影响
2.3 CS-PLGA纳米材料固定木聚糖酶的条件优化

表1 因素水平表
由表1和表2可知,对于固定化碱性磷酸单酯酶的活力,根据极差分析R值可以看出,影响固定化酶酶活的因素主次顺序依次为A、C、B、D,根据其K值判断组成的最优组合为A2C3B2D1,即最佳固定化条件为纳米颗粒质量分数50 mg、戊二醛体积分数4%、交联时间2.0 h、固定化时间9.0 h。经验证试验,在极差分析得到的最佳条件下,测得固定化酶的酶活回收率为76.2%。
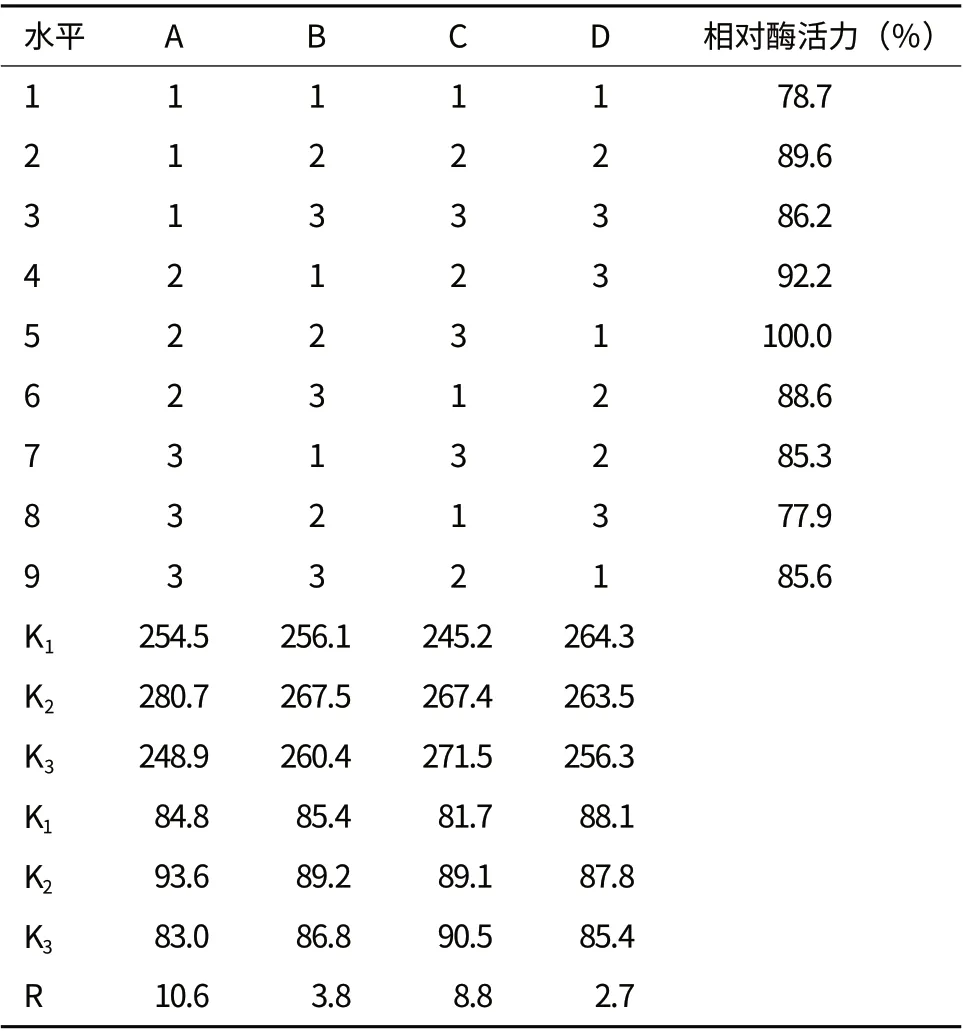
表2 正交试验结果分析
2.4 固定化和游离酶最适pH值及pH稳定性
酶分子在水溶液环境中的解离状态和酶与底物的亲和力都受到pH的影响。经标准差(SD)分析及图7显示,AKP被固化后其最适反应pH值有所变化,pH分别由9.5变化为10.0,且保持了较高的活性。同时对热稳定性的研究(图8)发现,在碱性条件下,固定化酶更稳定。
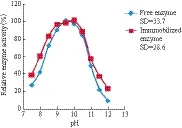
图7 pH对游离酶及固定化酶酶活力的影响
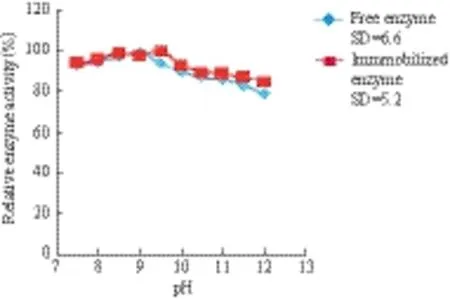
图8 游离酶及固定化酶的pH稳定性
2.5 固定化木聚糖酶的最适温度和热稳定性
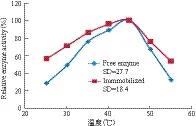
图9 温度对游离酶及固定化酶的影响
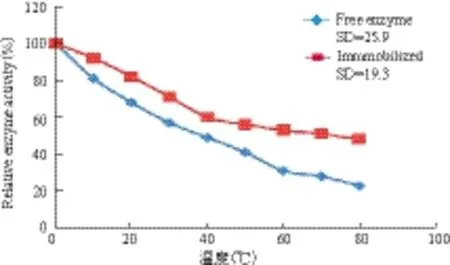
图10 游离酶及固定化酶的温度稳定性
温度对酶活性有显著影响,在一定的温度范围,由于产生了更多的活化分子而使酶的活性升高,但温度过高会引起蛋白变性,导致酶活性逐渐丧失。图9显示,游离酶与固定化酶的最适温度未发生明显变化,均为45℃,但经SD分析发现,固定化酶的适应温度范围较自由酶更加广泛。同时对固定化酶的热稳定性研究(图10)发现,在45℃水浴保温90 min后,固定化酶的活性保持在60%左右,而游离酶的活力约为40%,说明酶被固定化后其热稳定性有所增强。
3 讨论
自酶固定化技术诞生近百年以来,各种固定化载体材料获得了大量研究,特别是随着纳米技术的发展,纳米材料作为固定化酶的新型载体,在酶的固定化应用上体现了极高的表面积/体积比,致使固定化的物质集中化,从而提高了酶的固载量,获得了较优良的固定化酶。但是在对不同酶进行纳米材料固定化的应用研究中发现,单一地采用未经修饰的纳米材料的固定化效果往往会因为材料本身的自我团聚而导致酶活性的严重下降[10]。因而采用某些试验技术,在合成的纳米载体表面引入不同的化学基团(如-CHO、-NH、-OH、-COOH、-SH等),或连接上具有特殊功能的大分子物质(如糖类、酯类等),从而构建具有复合功能的纳米材料。研究表明,复合材料的固定化效果更加明显,能在保持较高酶活的同时,拓宽了酶的稳定性,改善了酶的操作半衰期等[11],从而为提高酶的工业化应用奠定了较好的应用前景。
4 结论
通过对PLGA纳米材料载体进行壳聚糖的修饰,获得了复合材料CS-PLGA,同时采用戊二醛为交联剂,对在重组大肠杆菌中表达的碱性磷酸单酯酶进行了分离纯化和固定,探讨了酶的最佳固定化条件。通过单因素分析、正交设计研究发现,在纳米颗粒质量分数50 mg、戊二醛体积分数4%、交联时间2.0 h、固定化时间9.0 h条件下,固定化酶的活力最高。同时对游离酶及固定化酶的最适pH、最适温度及pH稳定性和热稳定性进行了相应的探讨,研究发现,AKP采用纳米载体CS-PLGA固定后,拓宽了其最适反应条件及其稳定性。
[1] 余同, 张营, 赵欣平, 等.牛小肠碱性磷酸酶部分性质研究[J].四川大学学报:自然科学版, 2009, 46(6):1838-1844.
[2] 蒋益众, 邱耀进, 郭春祥, 等.高纯度, 高活力碱性磷酸单酯酶的制备[J].中国生化药物杂志, 1983, 1:16-18.
[3] Bradshuw RA, Fiorella LH. Amino acid sequence of E.coli alkaline phosphatase. Proc Natl Acad Sci USA, 1981, 78(6):3473-3477.
[4] Dreaden EC, Alkilany AM, Huang X, et al. The golden age:Gold nanoparticles for biomedicine [J]. Chem Soc Rev, 2012, 41:2740-2779.
[5] Pan Y, Du X, Zhao F, et al. Magnetic nanoparticles for the manipulation of proteins and cells [J]. Chem Soc Rev, 2012, 41:2912-2942.
[6] Shakeel AA, Qayyum H. Potential applications of enzymes immobilized on/in nano materials:A review [J]. Biotechnology Advances, 2011, 9(5):1016-1028.
[7] 陈红丽, 唐红波, 杨文智, 等.生物素化壳聚糖修饰的PLGA纳米粒的制备及表征[J].高等学校化学学报, 2010, 31(8):1682-1687.
[8] Chen HL, Yang WZ, Chen H, et al. Surface modification of mitoxantrone-loaded PLGA nanospheres with chitosan [J]. Colloids and SurfacesB:Biointerfaees, 2009, 73(2):212-218.
[9] 邱蔚然, 张小来, 张游铸.固定化碱性磷酸酯酶的研究[J].生物化学与生物物理学报, 1990, 22(3):185-188.
[10] 薛群基, 徐康.纳米化学[J].化学进展, 2000, 12(4):431-434.
[11] 黄赋, 王振刚, 万灵书, 等.壳聚糖修饰纳米纤维膜表面对氧化还原酶行为的影响[J].高等学校化学学报, 2010, 31(5):1060-1064.
