SC-04抗生素的生物活性测定
2013-12-23李文斌李增波刘仙俊
李文斌 李增波 刘仙俊
(太原科技大学化学与生物工程学院,太原 030021)
生物农药易被自然界分解而不污染环境,能耗低、投资少,因此,利用微生物产生的生物活性物质作为开发生物农药的研究受到了世界各国的极大重视[1-3]。近年来,阿维霉素在农业上的成功应用,引起了人们对农用抗生素开发的浓厚兴趣[4,5]。通过对本实验室分离保存的菌样进行平板抑菌试验、离体组织和大田测定试验发现SC-04菌发酵液对辣椒疫霉、草莓枯萎等园艺作物病害具有良好的防治效果。本研究通过对SC-04菌发酵液的稳定性分析及其抗菌物质的极性分析,优化其生物活性物质SC-04抗生素的分离提取方法,对抑菌谱进行分析,研究对辣椒早疫病菌和辣椒疫霉病菌等大多数病原真菌的抑制效果,旨在为开发其利用价值提供参考。
1 材料与方法
1.1 材料
1.1.1 抗生素产生菌 SC-04菌发酵液。
1.1.2 培养基
1.1.2.1 种子培养基(g/L) 蔗糖10,酵母膏5,牛肉膏3,蛋白胨3,CaCO32,水1 000 mL,pH7.2。
1.1.2.2 发酵培养基(g/L) 黄豆粉34,淀粉10,蔗 糖2,鱼 粉10,K2HPO41,MgSO4·7H2O 0.5,CaCO32,ZnSO40.01,FeSO4·7H2O 0.01,NaCl 2,水1 000 mL,pH7.2。
1.1.3 主要试剂 分析纯甲醇、丙酮、石油醚、氯仿、乙酸乙酯、正丁醇均由天津市化学试剂三厂生产;青霉素、链霉素、四环素、红霉素均由华北制药集团生产。
1.1.4 靶标菌 辣椒疫霉病菌(Phytophthora capsici);辣椒早疫病菌(Alternaria solani);小麦赤霉病菌(Fusarium graminearum);葡萄灰霉病菌(Botrytis cinerea Pers);黄瓜炭疽病菌(Colletotrichum lagenarium);西瓜枯萎病菌(Fusarium oxysporum);葡萄炭疽病菌(Colletotrichum gloeosporioides);黄瓜枯萎病菌(Fusarium oxysporum f. sp. cucumerinum);烟草赤霉病菌(Fusarium graminearum);水稻稻瘟病菌(Pyricularia oryzae);白菜炭疽病菌(Colletotrichum higginsianum Sacc);白菜黑斑病菌(Alternaria brassicicola);番茄黑霉病菌(Botrytis cinerea);番茄灰霉病菌(Botrytis cinere);棉花枯萎病菌(F. f. sp. vasinfectum);草莓枯萎病菌(Fusarium oxysporium Schl);金黄色葡萄球菌(Staphylococcus aureaus);埃希氏大肠杆菌(Escherichia coli);青霉(Penicillium);黑曲霉(Aspergillus niger)。以上菌种均由本实验室从中国工业微生物菌种保藏管理中心购得。
1.2 方法
1.2.1 发酵滤液的稳定性分析
1.2.1.1 时间稳定性测定 将SC-04菌株发酵滤液于常温下保存1、7、30和90 d,以辣椒疫霉为病原指示菌,以发酵原液作为对照,以生长速率法即抑菌活性试验测定其相对抑菌率(%)[20,21],根据活性损失率来确定保存时间稳定性。
1.2.1.2 热稳定性测定 将SC-04菌株发酵滤液于70℃和100℃下分别处理10、30和60 min,同时在121℃下处理30 min,以辣椒疫霉为病原指示菌,以发酵原液作为对照,参照前述生长速率法测定其相对抑菌率(%),根据活性损失率来确定其热稳定性。
1.2.1.3 酸碱稳定性测定 将SC-04菌株发酵滤液用1 mol/L HCl和1 mol/L NaOH调整pH为1-14,25℃下保存6 h后再调回初始pH(8.3),以辣椒疫霉为病原指示菌,以发酵原液作为对照,参照前述生长速率法测定其相对抑菌率(%),根据活性损失率来确定其酸碱稳定性。
1.2.1.4 UV稳定性测定 将SC-04菌株发酵滤液与培养基按1∶10的比例混合,待平板凝固后,在超净台上用紫外灯照射20 min,以辣椒疫霉为病原指示菌,以未照紫外线的平板作为对照,参照前述生长速率法测定其相对抑菌率(%),根据活性损失率来确定其酸碱稳定性。
1.2.2 抗菌物质极性分析 将100 mL发酵上清液加入等体积的石油醚、氯仿、乙酸乙酯及正丁醇的三角瓶中,于室温置于摇床振荡,充分混合。静置过夜,分别测定上层有机相和下层水相的抑菌活性。
1.2.3 抑菌谱测定 将发酵粗提物用甲醇溶解后,采用滤纸片法进行粗提物的活性检测。
2 结果
2.1 发酵滤液的稳定性分析
2.1.1 常温下的稳定性 发酵滤液常温保存较长时间活性损失很小,保存90 d时,活性损失率仅为14.8%(表1),说明SC-04菌株常温下稳定性较好。

表1 不同保存时间的发酵液抑菌率
2.1.2 热稳定性 SC-04菌株发酵液具有较强的热稳定性。随着各温度(70℃和100℃)热处理时间延长,活性损失率呈升高趋势;在70℃和100℃下处理10 min,活性损失率分别为14.6%和19.4%,二者相比差距不大,与对照相比,活性损失不显著;121℃下处理30 min活性损失率为63.3%,与对照相比,活性损失较大(表2)。因此,发酵液的预处理应控制在合适的温度和时间内。

表2 不同热处理的发酵滤液抑菌率
2.1.3 酸碱稳定性 由表3可知,SC-04菌株发酵液在pH4.0-12.0以内活性差异不大,其活性损失率不超过20%;与对照相比,当酸碱度过高时,即在pH<3.0或pH>12.0时活性损失率明显提高。因此,在不影响活性的前提下,可通过控制发酵液的酸碱度来改变发酵液的流变性,以利于对SC-04菌株发酵产物有效组分的分离提取工作的进行。

表3 不同pH的发酵滤液抑菌率
2.1.4 UV稳定性 发酵液经紫外线(UV)照射后抑菌率为75.7%,未经UV照射的抑菌率为76.4%,其抑菌情况见图1。当发酵滤液经紫外线照射30 min后,抗菌活性物质的稳定性有所下降,但影响不大,该活性物质对紫外线基本稳定。

图1 UV稳定性结果
2.2 发酵液预处理方法的建立
发酵结束后,发酵液除含有所需要抗生素外,还存在大量的菌体和各种代谢产物等,这些杂质不仅使发酵液黏度增高,而且还会影响后续的提取操作。为改善发酵液的流变特性,同时除去对后续纯化操作有影响的杂质,常常需要预处理。发酵液中还含有某些无机盐,会直接影响成品质量(灰分增高),因此预处理也应将有影响的无机离子,特别是高价金属无机离子,如Ca2+、Fe3+和Mg2+除去。从该发酵液稳定性试验结果来看,该菌株有较好的热和酸碱稳定性,因此将原始发酵液5 000 r/min离心得上清液,上清液用草酸调pH到6.0,70℃下处理10 min,离心沉淀得发酵上清液。
2.3 抗菌物质的极性分析
发酵上清液的萃取结果(表4)表明,发酵液中的抗菌物质能溶于氯仿、乙酸乙酯等极性较强的有机溶剂,且乙酸乙酯的萃取效果更好,而不溶于非极性溶剂石油醚和强极性溶剂正丁醇。根据相似相溶原理,可大致判断该抗菌物质极性较强,同时发酵上清液萃取试验结果显示,活性物质既能溶于水又能溶于溶媒,是一种脂溶-水溶性抗生素,一般可采用脂溶性抗生素提取。鉴于该物质能被氯仿和乙酸乙酯萃取,且乙酸乙酯比氯仿萃取效果好,确定发酵上清液可以采用乙酸乙酯为溶剂进行萃取。
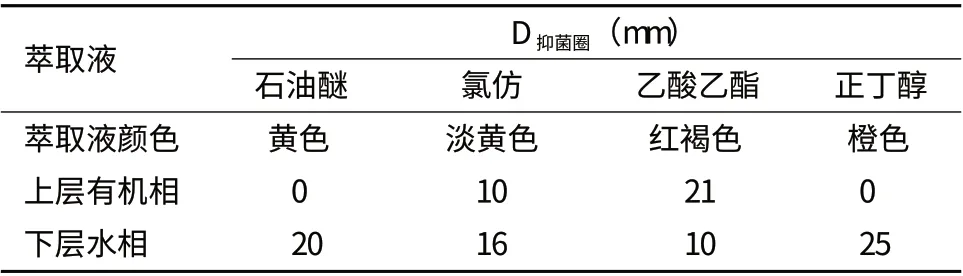
表4 发酵液上清萃取试验结果
2.4 抗菌粗提物的抑菌谱测定
SC-04发酵液乙酸乙酯粗提物的抑菌谱很广,其对大多数病原真菌都有较好的抑制效果,抑菌圈直径都在10 mm以上,其中辣椒早疫病菌和辣椒疫霉病菌的抑菌圈直径分别为32 mm和30 mm(表5)。
3 讨论
农用抗生素是现代生物技术和化学工程结合发展的产品,易被土壤微生物分解而不污染环境,对人畜安全,选择性高,在农业病虫害的防治上具有广阔的发展前途[6-10]。由于自然界微生物种类繁多,从中寻找有特殊生理活性的物质还有很大潜力。农用抗生素由微生物发酵产生,在抗生发酵液中,除抗生活性物质外还含有很多其它物质[11,12]。因此还必须对其进行分离纯化来进一步研究其各种理化性质。目前抗生素的提取精制方法有吸附法、溶媒萃取法、离子交换法、沉淀法外,还经常采用逆流分配法、色谱法、高压液相层析等分离纯化方法[13-17]。对抗生素进行分离纯化之前,应对抗菌有效成分做一些初步试验,了解其热、酸碱稳定性及UV稳定性,判断其电离特征等[19-21],在确保分离纯化过程中活性成分不失活的前提下,确定其最佳分离提取方法。

表5 SC-04号粗取物的抑菌谱
4 结论
通过SC-04菌发酵液的稳定性分析,确定了发酵液的预处理方法。将原始发酵液5 000 r/min离心得上清液,上清液用草酸调pH至6.0,70℃条件下处理10 min,离心沉淀得发酵上清液。抗菌物质的极性分析确定乙酸乙酯为该抗生活性物质的最佳提取溶剂。该抗生物质抑菌谱较广,对辣椒早疫病菌和辣椒疫霉病菌等大多数病原真菌都有较好的抑制效果,且抑菌活性较强。
[1] 陈代杰.微生物药物学[M].北京:科学出版社, 2001.
[2] 陈秀奇.新型生物农药氨苷霉素的分离工艺及其结构鉴定[D].杭州:浙江大学, 2003.
[3] 刘秋.抗真菌生物农药-凯地菌素的研究[D].沈阳:沈阳农业大学, 2002.
[4] 王成霞.农用抗生素8832#的发酵制备及活性组分分离提取方法研究[D].天津:南开大学, 2000.
[5] 刘明周.农用抗生素94166-Ⅱ、94166-Ⅲ的分离纯化及结构鉴定[D].上海:华东理工大学, 2002.
[6] 刘茂田.农抗9512-2的分离分析及生物理化特性的研究[D].武汉:华中农业大学, 2003.
[7] 王浩.一种抗真菌新抗生素的研究[D].济南:山东大学, 1997.
[8] 董立.拮抗链霉菌Men-myco-93-63的复壮及其抗生素的提取纯化[D]. 保定:河北农业大学, 2002.
[9] 伍学纲.农用抗生素94166-Ⅳ、Ⅴ的分离纯化及结构鉴定[D].上海:华东理工大学, 2002.
[10] 《中华人民共和国药典》[M].(1977年版).
[11] 刘泉勇, 胡江春, 薛德林, 等.海洋细菌LU-B02生物活性物质发酵条件及理化性质研究[J].微生物学杂志, 2001, 21(1):10-12.
[12] 刘光烨, 林洋.胶胨状芽孢杆菌拮抗菌株活性物质形成条件及其性质初步研究[J].微生物学通报, 2003, 30(1):22-26.
[13] 张瑞平.菌株S15发酵条件、抗生素提取及对白菜黑斑病防治效果的初步研究[D].保定:河北农业大学, 2001.
[14] 李海涛.农抗武夷菌素的分离纯化和结构鉴定[D].北京:协和医科大学中国医学科学院, 2001.
[15] 胡志钰.海洋动植物共附生放线菌农抗活性物质的初步研究[D].厦门:厦门大学, 2001.
[16] 李铭刚, 文孟良, 李一青.薄层层析指导下的嗜碱放线菌菌株YIMGQ-14次生代谢产物研究[J].微生物学报, 2003, 4(3):481-486.
[17] 夏海洋.农抗A<9901>-I素分离鉴定及生物理化特性研究[D].武汉:华中农业大学, 2002.
[18] 顾觉奋.分离纯化工艺原理[M].北京:中国医药科技出版社, 2000.
[19] 顾学斌, 陶黎明, 徐文平.磷氮霉素PN-2的分离鉴定及活性研究初报[J].农药学学报, 2002, 4(1):75-79.
[20] 刘秋, 于基成, 刘长建.龟裂链霉菌菌株MY02发酵液中抗菌物质的稳定性测定[J].湖北农业科学, 2004, 43(1):51-54.
[21] 刘晓妹, 陈秀蓉, 蒲金基.两株芽孢杆菌无菌液抗菌谱及稳定性测定[J].中国生物防治, 2003, 19(4):141-143.
